术前血清淀粉样蛋白A对食管鳞状细胞癌患者预后的影响
2015-01-03方盛华陈艳贞王碧荣邓旭斌
方盛华 陈艳贞 王碧荣 邓旭斌
临床研究论著
术前血清淀粉样蛋白A对食管鳞状细胞癌患者预后的影响
方盛华 陈艳贞 王碧荣 邓旭斌
目的 探讨术前血清淀粉样蛋白A(SAA)水平对食管鳞状细胞癌患者预后的影响。方法回顾性研究单纯接受食管癌根治术的174例食管鳞状细胞癌患者的临床资料。采用ROC曲线评估SAA总体预测精度并确定临界值点。用Kaplan-Meier法进行生存分析,组间差异采用Log-rank检验。单因素、多因素预后分析采用Cox比例风险回归模型。结果174例食管鳞状细胞癌患者的1、3、5年生存率分别为72.0%、62.0%和44.0%,其术前SAA水平均与预后有关,其中SAA低水平组平均生存时间比高水平组长50.6个月(72.0个月vs.21.4个月,P<0.001)。根据术后TNM病理分期(Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期)将研究对象分为4个亚组。在亚组分析中,术前SAA升高对术后病理分期Ⅰ期、Ⅱ期和Ⅲ期患者均提示预后不良,差异具有统计学意义(P均<0.001)。对于Ⅳ食管鳞状细胞癌患者,SAA水平对预后的影响无统计学意义(P=0.818)。在Cox回归分析中SAA>7.50 mg/L为食管鳞状细胞癌术后患者预后的独立影响因素(P<0.001)。结论食管鳞状细胞癌患者术前SAA水平升高提示预后不良,在单纯接受手术治疗的食管鳞状细胞癌患者中,术前SAA水平可以作为预后的影响因素。
血清淀粉样蛋白A;食管鳞状细胞癌;生存;预后
食管癌是患病率和致死率较高的恶性肿瘤之一[1-3]。随着临床诊断、分期和治疗上的进步,不同分期食管癌患者的生存期均有所提高,而相同分期的食管癌患者预后却存在较大的差异[4]。研究表明血清淀粉样蛋白A(SAA)的浓度与恶性肿瘤的预后有着密切的关系[5-9]。本研究选取单纯接受手术治疗的食管鳞状细胞癌患者作为研究对象,主要探讨术前SAA水平对预后的影响。
对象与方法
一、研究对象
2003年1月至2006年12月在广州医科大学附属肿瘤医院接受食管癌根治术的174例食管鳞状细胞癌患者。入组标准:①接受食管癌根治术(R0切除)且术后病理为食管鳞状细胞癌;②术前未行新辅助放射、化学治疗或其他治疗;③术前检查未发现任何器官或组织存在炎症;④既往无其他恶性肿瘤病史;⑤术前检查未发现远处转移。
二、方法
回顾性收集患者术前评估项目包括:病史采集和全身体格检查、血常规、生化常规、正侧位X线胸片、食管吞钡、颈胸腹增强CT、超声食管镜和必要的心肺功能评估。所有入组患者均行食管癌根治术。术后随访:第1~2年每3个月1次,第3~5年每6个月1次,第5年以后每年1次。病理及分期:所有的术后标本均送至本院病理科行常规病理检查,并确诊为食管鳞状细胞癌,术后病理分期采用美国肿瘤联合会(AJCC)2010版分期标准[26]。
三、血清标本收集以及SAA测定
患者的血标本在术前1 d收集,约10 ml,血标本收集后在1 h内离心,并将血清保存在-80℃~-70℃冰箱内。SAA的测定采用速率散射比浊法。实验仪器选用德国西门子公司全自动蛋白分析仪(BN Pro Spec System),实验试剂盒选用德国西门子医疗诊断产品有限公司多克隆抗体试剂盒(Siemens Healthcare Diagnostics Products Gmbh,Germany)。
四、统计学处理
应用SPSS 19.0统计软件。分类资料统计描述采用率表示;无序分类资料组间对比采用χ2检验,等级资料组间对比采用秩和检验。采用ROC曲线评估SAA总体预测精度并确定临界值点。用Kaplan-Meier法进行生存分析,组间差异采用Log-rank检验。单因素、多因素预后分析采用Cox比例风险回归模型。假设检验均为双侧,检验水准α=0.05。
结 果
一、食管鳞状细胞癌患者临床及病理学资料
174例入组的食管鳞状细胞癌患者年龄为58 (31~80)岁,其中男131例,女43例。食管鳞状细胞癌患者SAA的水平高低与病理G分级、T分级和TNM分期均有关,与年龄、性别、肿瘤位置和N分级均无关,见表1。
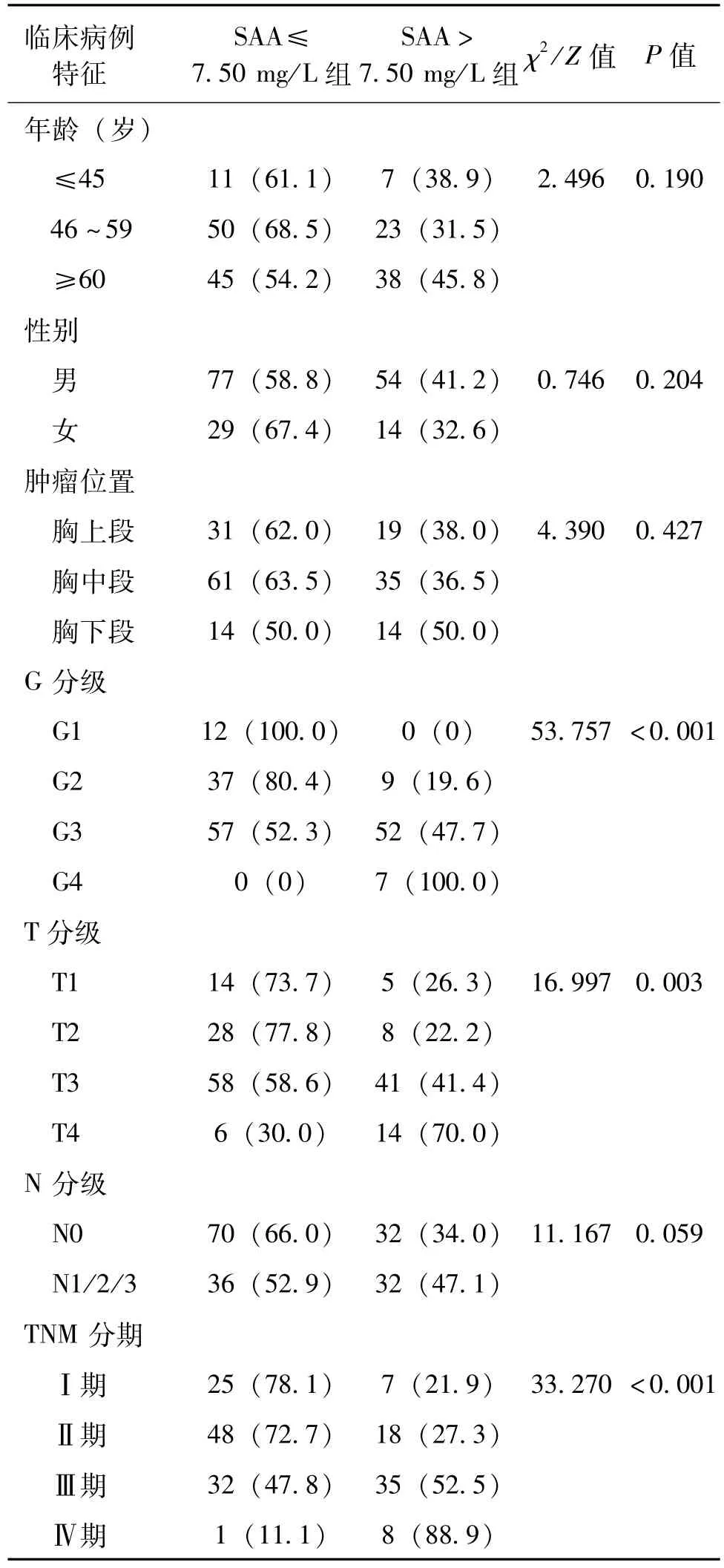
表1 食管鳞状细胞癌患者临床病理学资料 例(%)
二、SAA水平与临床病理特征之间的关系
SAA的ROC曲线下面积(AUC)为0.816(P <0.001,95%CI 0.749~0.883),临界值取7.50 mg/L(敏感度为67.4%,特异度为91.5%),见图1。
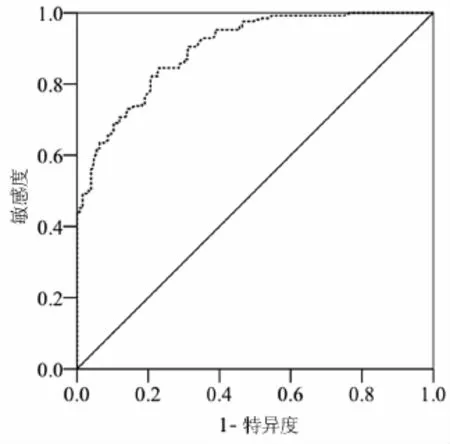
图1 SAA的ROC曲线图
三、SAA和临床病理特征对食管鳞状细胞癌患者预后的影响
174例患者中位生存时间和平均生存时间分别为65.6个月和49.2个月。1年、3年和5年生存率分别为72.0%、62.0%和44.0%。食管鳞状细胞癌患者术前SAA水平与预后有关,其中SAA低水平组平均生存时间(72.0个月)比高水平组(21.4个月)长50.6个月(P<0.001,图2A)。根据术后病理分期(Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期)将研究对象分为四个亚组。在亚组分析中(图2B/C/D),术前SAA升高对I期、Ⅱ期和Ⅲ期患者均提示预后不良,差异具有统计学意义(P值均<0.001)。对于Ⅳ期食管鳞状细胞癌患者,术前SAA水平对预后的影响无统计学意义(P=0.818)。
四、Cox比例风险回归模型评价术前SAA水平在食管鳞状细胞癌患者预后中的作用
单因素和多因素分析结果均提示术后病理G分级、N分级、TNM分期、SAA水平高低可影响食管鳞状细胞癌患者的生存率,见表2。
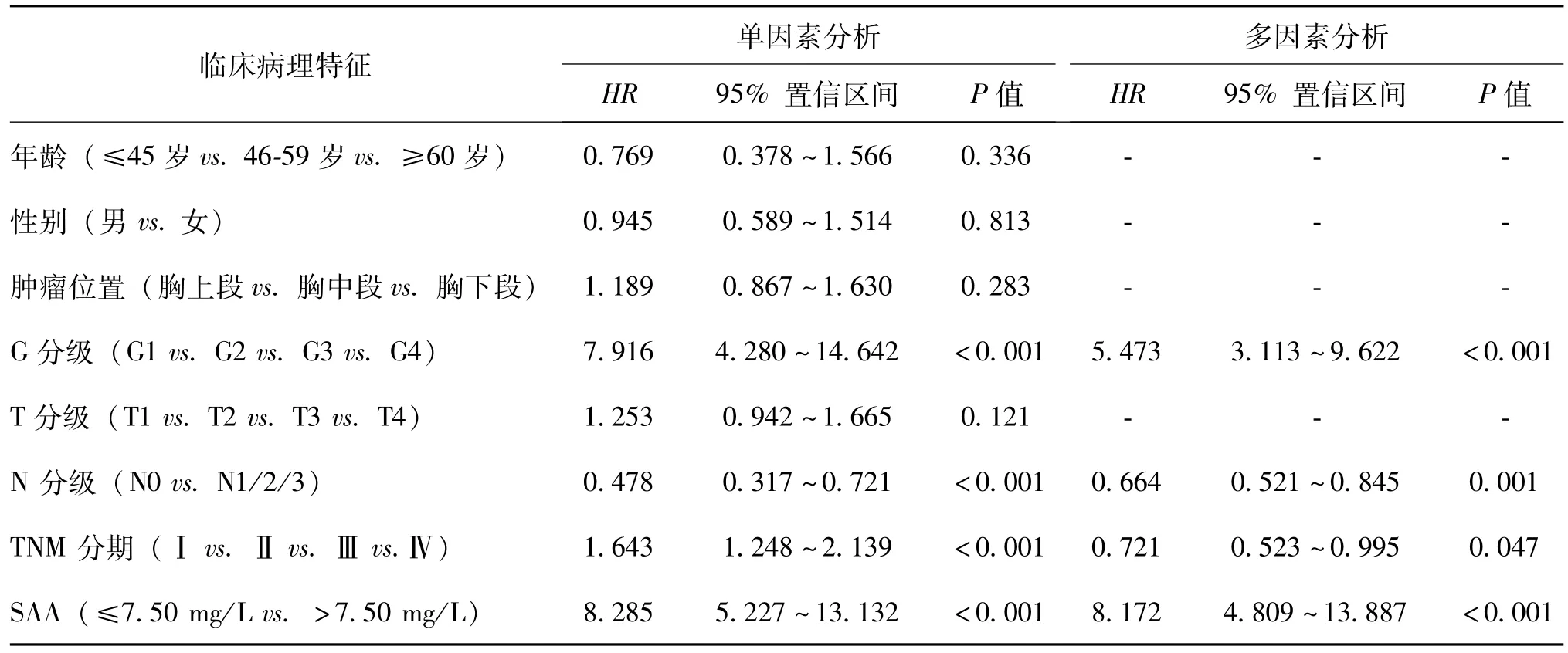
表2 单因素和多因素Cox比例风险回归模型分析
讨 论
食管癌是患病率和致死率较高的肿瘤之一。近些年来,炎症反应相关的一系列标志物逐渐进入肿瘤学家的视线中,各项研究逐渐发现他们在肿瘤的发生、发展方面也发挥着重要作用。
SAA是急性相蛋白,除了发挥炎症标志物的作用外,在肿瘤发展过程中的作用越来越得到重视,作为肿瘤预后预测指标方面也有新发现。由于SAA水平长期以来用在预测急性或者慢性炎症方面,在预测恶性肿瘤患者预后方面仍在探索,所以目前还没有相关正常值或者临界值的共识。在以往的研究中,大部分采用了它们作为预测炎症时的正常值或临界值。本研究在探索SAA浓度的临界值时采用了ROC曲线法。
在本研究中,生存分析结果示食管鳞状细胞癌患者SAA水平升高提示预后不良。在亚组分析中,SAA能在TNM分期Ⅰ期、Ⅱ期和Ⅲ期3个亚组水平发现食管鳞状细胞癌预后的差异。
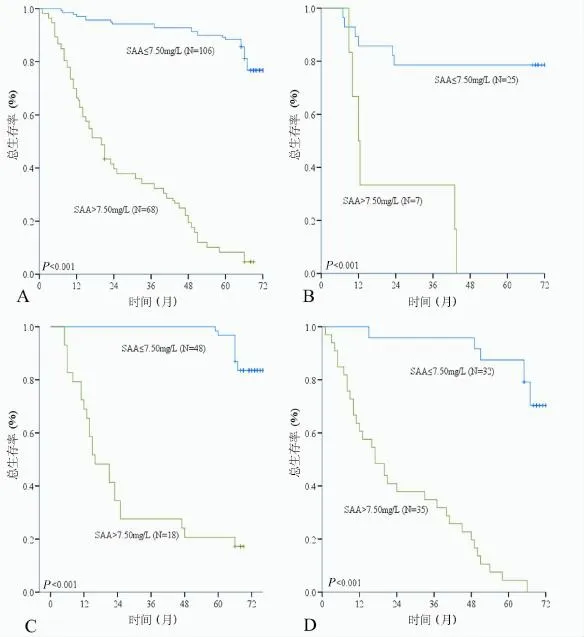
图2 术后食管鳞状细胞癌患者生存曲线图
术前SAA水平高低与肿瘤分化程度、T分级和TNM分期有关,且在Cox比例风险模型多因素分析中术前SAA水平可以作为食管鳞状细胞癌预后的独立影响因素。对于这一结果,可能的解释有:①炎症相关肿瘤的预后可能与机体炎症反应程度有关,预后差的患者体内炎症程度较重,SAA作为炎症反应的标志物也随着升高;②作为细胞外基质黏附分子,SAA可以改变不同细胞在细胞外基质中的黏附方式,从而形成复杂的细胞外基质复合物。在肿瘤相关的炎症反应中,细胞外基质复合物作为核心因子,可以启动多种信号通路,包括能激活不同致癌基因的胞内途径和包含转录因子、细胞因子、趋化因子的胞外途径。最终,细胞外基质复合物在分泌炎症因子的同时可以修饰细胞黏附、迁移和活化;③肿瘤细胞自身也可以分泌大量SAA,而且SAA通过它在中性粒细胞上的甲酰肽受体2在肿瘤免疫抑制中发挥一定作用[10-14]。
综上所述,对于食管鳞状细胞癌患者术前SAA水平升高提示预后不良。在单纯接受手术治疗的食管鳞状细胞癌患者中,术前SAA水平可以作为预后的影响因素。
[1]Jemal A,Bray F,Center MM,Ferlay J,Ward E,Forman D.Global cancer statistics.CA Cancer J Clin,2011,61(2):69-90.
[2]Enzinger PC,Mayer RJ.Esophageal cancer.N Engl JMed,2003,349(23):2241-2252.
[3]Ke L.Mortality and incidence trends from esophagus cancer in selected geographic areas of China circa 1970-90.Int J Cancer,2002,102(3):271-274.
[4]辜树勇,林少波,傅俊惠,杜泽森.紫杉醇脂质体联合奈达铂行食管癌新辅助化学治疗的近期疗效观察.新医学,2013,44(5):323-327.
[5]McArdle PA,Mir K,Almushatat AS,Wallace AM,Underwood MA,McMillan DC.Systemic inflammatory response,prostate-specific antigen and survival in patients with metastatic prostate cancer.Urol Int,2006,77(2):127-129.
[6]Tsilidis KK,Branchini C,Guallar E,Helzlsouer KJ,Erlinger TP,Platz EA.C-reactive protein and colorectal cancer risk:a systematic review of prospective studies. Int J Cancer,2008,123(5):1133-1140.
[7]Scott HR,McMillan DC,Forrest LM,Brown DJ,McArdle CS,Milroy R.The systemic inflammatory response,weight loss,performance status and survival in patients with inoperable non-small cell lung cancer.Br J Cancer,2002,87(3):264-267.
[8]Pierce BL,Neuhouser ML,Wener MH,Bernstein L,Baumgartner RN,Ballard-Barbash R,Gilliland FD,Baumgartner KB,Sorensen B,McTiernan A,Ulrich CM.Correlates of circulating C-reactive protein and serum amyloid A concentrations in breast cancer survivors. Breast Cancer Res Treat,2009,114(1):155-167.
[9]Yokoi K,Shih LC,Kobayashi R,Koomen J,Hawke D,Li D,Hamilton SR,Abbruzzese JL,Coombes KR,Fidler IJ.Serum amyloid A as a tumor marker in sera of nude mice with orthotopic human pancreatic cancer and in plasma of patients with pancreatic cancer.Int J Oncol,2005,27(5):1361-1369.
[10]Urieli-Shoval S,Shubinsky G,Linke RP,Fridkin M,Tabi I,Matzner Y.Adhesion of human platelets to serum amyloid A.Blood,2002,99(4):1224-1249.
[11]Mantovani A,Garlanda C,Allavena P.Molecular pathways and targets in cancer-related inflammation.Ann Med,2010,42(3):161-170.
[12]De Santo C,Arscott R,Booth S,Karydis I,Jones M,Asher R,Salio M,Middleton M,Cerundolo V.Invariant NKT cells modulate the suppressive activity of IL-10-secreting neutrophils differentiated with serum amyloid A.Nat Immunol,2010,11(11):1039-1046.
[13]Moshkovskii SA.Why do cancer cells produce serum amyloid A acute-phase protein?Biochemistry(Mosc),2012,77(4):339-341.
[14]Lee MS,Yoo SA,Cho CS,Suh PG,Kim WU,Ryu SH.Serum amyloid A binding to formyl peptide receptor-like 1 induces synovial hyperplasia and angiogenesis. J Immunol,2006,177(8):5585-5594.
Prognostic value of preoperative serum amyloid A in esophageal squamous cell carcinoma
Fang Shenghua,Chen Yanzhen,Wang Birong,Deng Xubin.Department of Medical Oncology,Guangzhou Medical University Cancer Center,Guangzhou 510095,China
Objective To evaluate the prognostic value of preoperative serum amyloid A(SAA)in esophageal squamous cell carcinoma(ESCC).MethodsClinical data of 174 patients with ESCC who had undergone esophagectomy alone were retrospectively analyzed.The overall predictive accuracy and cut-off value of SAA levels were evaluated by the receiver operating characteristic(ROC)curve.Survival analysis was conducted by the Kaplan-Meier method.Group comparison was analyzed by the log-rank test.Uni-and multi-variate prognosis was evaluated using Cox's proportional hazards model.ResultsThe 1-,3-,and 5-year overall survival(OS)rates for the entire cohort of ESCC patients were 72.0%,62.0%and 44.0%,respectively.Preoperative SAA level was correlated with clinical prognosis.The median OS of patients with low preoperative SAA levels was 50.6 months longer compared with that of patients with high preoperative SAA levels(72.0 months vs.21.4 months,P<0.001).All patients were divided into four subgroups(stageⅠ,Ⅱ,Ⅲand IV)based upon postoperative TNM staging.Subgroup analysis revealed that elevated preoperative levels of SAA indicated poor prognosis in patients with stageⅠ,ⅡandⅢESCC(all P<0.001)rather than stage IV ESCC individuals(P=0.818).Cox's proportional hazard regression analysis revealed that SAA was an independent risk factor of postoperative prognosis of ESCC patients(P<0.001).Conclusions Elevated preoperative levels of SAA indicated poor prognosis of ESCC patients.For ESCC patients undergoing esophagectomy alone,preoperative SAA levels acted as an independent factor of clinical prognosis.
Serum amyloid A;Esophageal squamous cell carcinoma;Survival;Prognosis
2015-08-06)
(本文编辑:杨江瑜)

10.3969/j.issn.0253-9802.2015.12.010
510095广州,广州医科大学附属肿瘤医院(方盛华,王碧荣,邓旭斌);510060广州,中山大学肿瘤防治中心中心办公室(陈艳贞);
,陈艳贞
并列第一作者,陈艳贞
