常用指示剂用量对滴定反应的影响
2015-01-02桑雅丽刘春华李鑫娥
桑雅丽,刘春华,李鑫娥
(赤峰学院 化学化工学院,内蒙古 赤峰 024000)
1 前言
酸碱滴定法在定量分析实验中占了相当重要的地位,是化学分析中应用非常广泛的基本方法之一.其原理是用酸标准溶液或碱标准溶液滴定具有相反酸碱性的物质,根据标准溶液消耗的体积来计算被测物质的含量.对于反应终点的确定,一般用酸碱指示剂颜色的突变来指示终点,首先要了解酸碱指示剂的性质,变色原理及变色范围.其次,了解滴定反应中影响指示剂变色范围的因素,从而获得准确的分析结果[1].在滴定实验中,指示剂的适中加入可以有效地减少实验误差,如果指示剂加入量太少,溶液颜色变化不是很明显,不便于观察,如果加入太多,会使滴定终点溶液的颜色与指示剂的理论变色点的颜色有很大差异,再者由于指示剂为有机弱酸弱碱,会消耗一部分标准溶液,因此,指示剂的加入量过多或过少都会直接影响滴定终点的正确判断,给实验结果带来较大的误差[2].所以,酚酞指示剂的用量在酸碱滴定反应中尤为重要.
碘量法为氧化还原滴定法之一,无论是直接碘量法还是间接碘量法均以淀粉做指示剂[3].淀粉分为支链淀粉和直链淀粉两种,支链淀粉遇碘呈红紫色,直链淀粉遇碘呈蓝色,生成蓝色配合物,此反应是特征反应,灵敏度高[4].在溶液中,游离碘的含量依靠淀粉指示剂指示,若含有游离碘则溶液为蓝色.当游离碘的含量较高时,游离碘会与加入的淀粉指示剂发生氧化还原反应等副反应,从而消耗部分游离碘,导致实验结果偏低.当游离碘的浓度较低的时候,即临近终点时再加入淀粉指示剂,此时溶液呈淡黄色,游离碘已经基本反应完全,副反应所带来的影响可以忽略.在实际操作过程中,滴定速度要迅速,原因是空气中的氧易把碘离子氧化,若滴定速度过慢,则会引起较大误差,使实验结果不够准确.本实验采用无机实验室中常用的直链淀粉为研究对象,探究淀粉指示剂的用量对滴定反应的影响,从而确定淀粉指示剂的合理灵敏度用量范围.
本实验以酸碱滴定反应常用的酚酞指示剂和碘量法常用的淀粉指示剂为研究对象,探究这两种指示剂的用量对滴定反应的影响.在不影响实验结果的情况下,从而确定酚酞指示剂和淀粉指示剂的合理灵敏度使用范围.
2 实验内容
2.1 探究酚酞指示剂的用量对滴定反应的影响
2.1.1 用移液管移取25mLHAc溶液于250mL锥形瓶中,加入酚酞指示剂,用0.2005mol/L的NaOH标准溶液滴定至溶液呈微红色且半分钟内不褪色,即为终点,记录消耗NaOH标准溶液的体积[5].
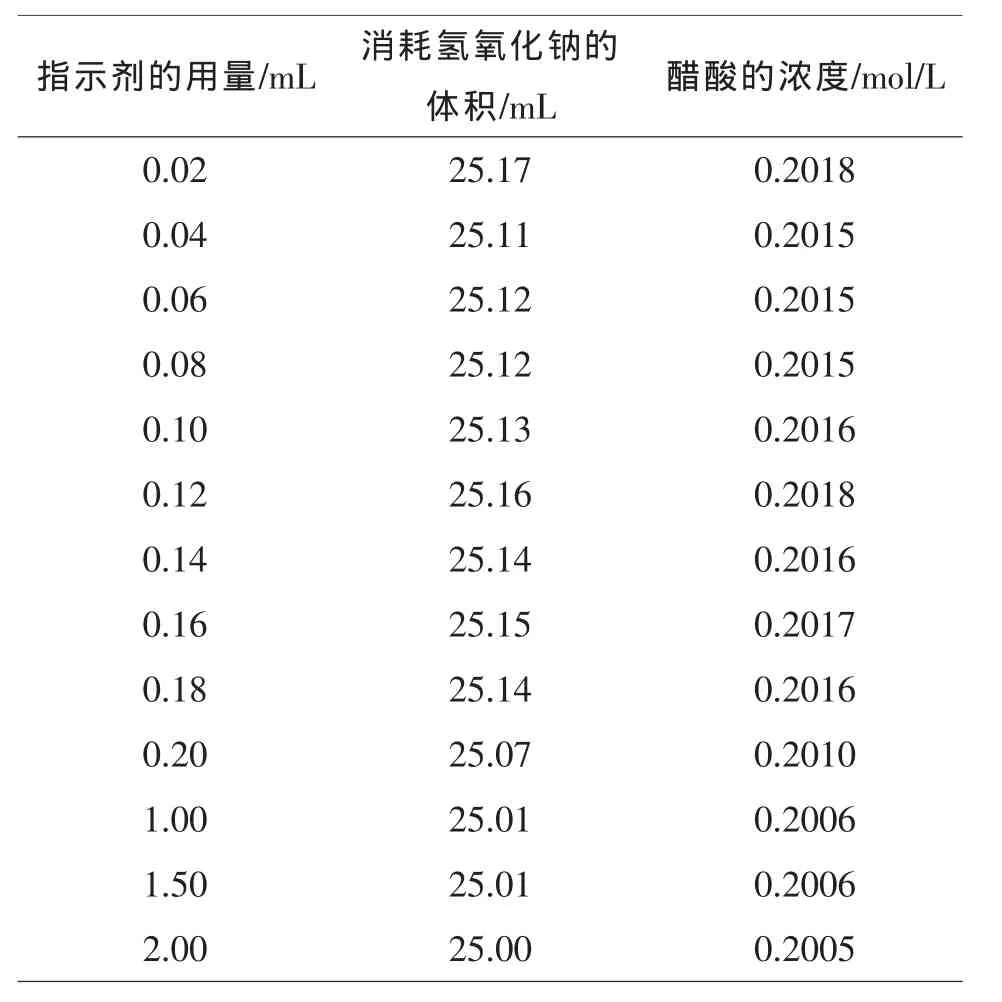
表1 酚酞指示剂的用量和消耗的NaOH的体积所对应的HAc浓度的关系数据
2.1.2 以0.1996mol/L的NaOH标准溶液滴定0.20mol/L的HCl溶液为例
用移液管移取25mLHCl溶液于250mL锥形瓶中,加入酚酞指示剂,用0.1996mol/L的NaOH标准溶液滴定至溶液呈微红色且半分钟内不褪色,即为终点.记录消耗NaOH标准溶液的体积.
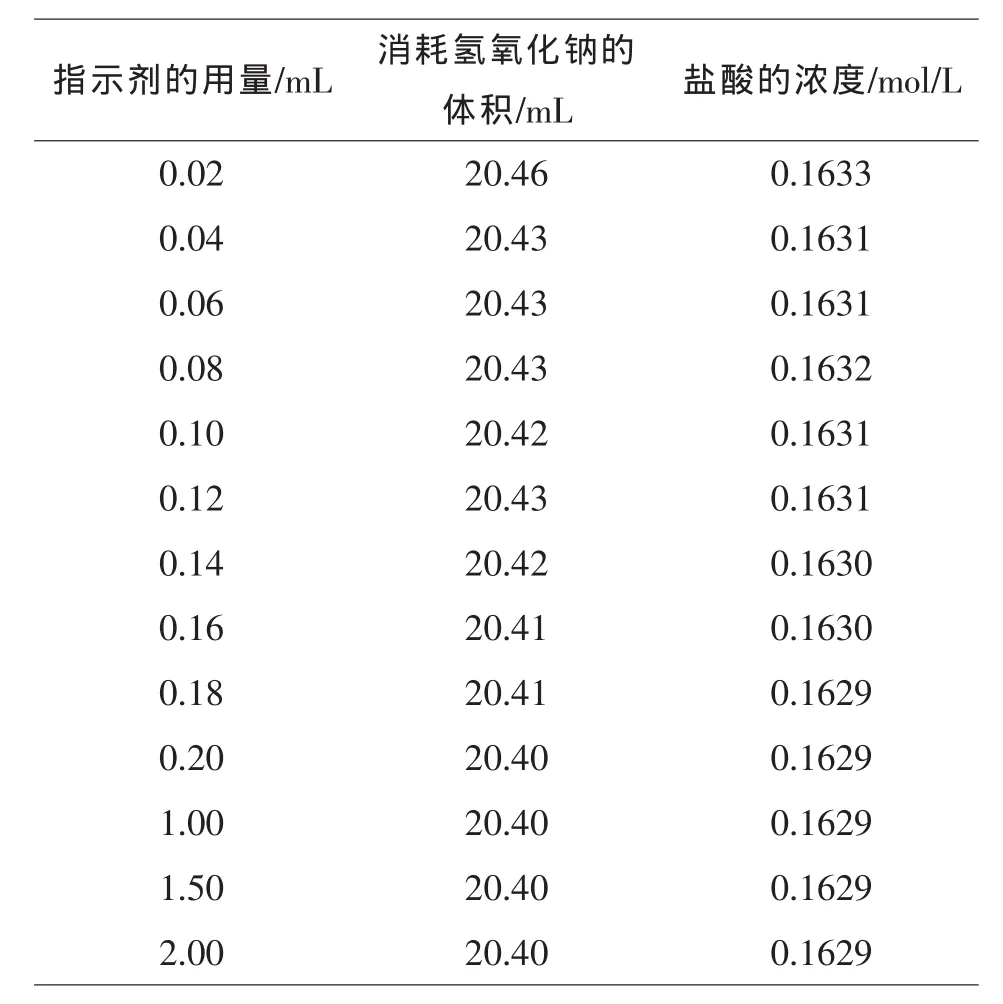
表2 酚酞指示剂的用量和消耗的NaOH的体积所对应的HCl浓度的关系数据
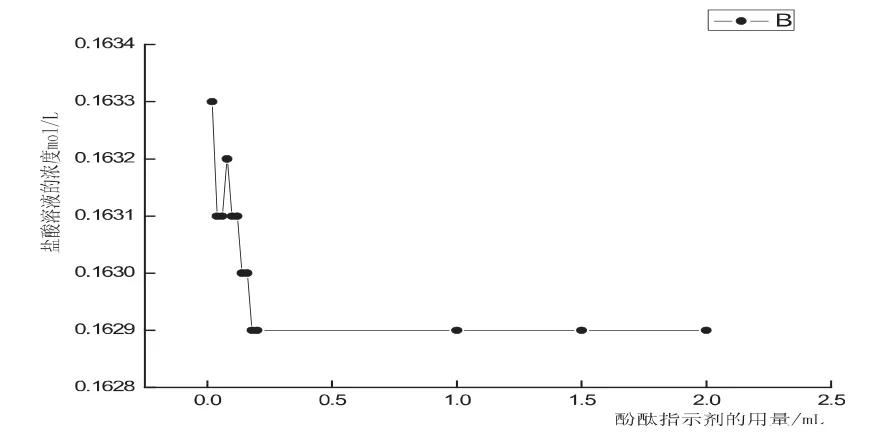
图2 酚酞指示剂的用量对HCl溶液浓度影响
2.1.3 实验分析
酚酞指示剂为有机弱酸,称酸型指示剂,对于单色指示剂酚酞来说,在溶液中有如下解离平衡:
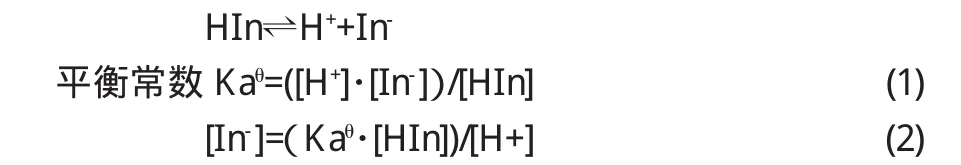
在溶液中,当碱型In-的红色达到人眼可观察的某一最低浓度[In-]min时,就能据此判断滴定终点,而这一最低浓度是一定的.
设酚酞的浓度为C,变色时:
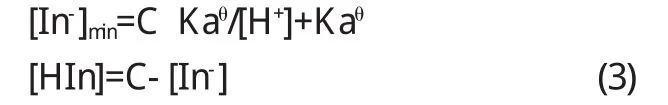
将(3)代入(2)中:[In-]min=C Kaθ/[H+]+Kaθ
若酚酞的浓度增大为C1,[In-]min不变,溶液中[H+]将增大,指示剂将在较低的pH时变色,以上分析表明,单色指示剂的用量增加,变色范围向pH减少的方向移动,即消耗的NaOH的体积逐渐减小.
2.1.4 实验小结
当加入酚酞指示剂的用量为0.02mL时,由于指示剂的用量太少,临近终点时指示剂变色不灵敏,现象不明显,滴定误差大;当加入酚酞指示剂的用量为0.04-0.08mL时,临近终点时指示剂变色灵敏,现象十分明显,滴定误差小;随着指示剂用量的增加,临近终点时指示剂变色的灵敏度逐渐降低,现象不明显,滴定误差大.所以,在不影响实验结果的情况下,酚酞指示剂的合理灵敏度使用范围为0.04-0.08mL.
2.2 探究淀粉指示剂的用量对滴定反应的影响
用0.0050mol/L的Na2S2O3标准溶液分别滴定0.0100 mol/L的KI-I2的饱和溶液,0.0200mol/L的KI-I2的饱和溶液和H2O-I2的饱和溶液:用10mL吸量管取1号瓶上层清液,注入250mL锥形瓶中,再注入40mL蒸馏水,用0.0050 mol/L的Na2S2O3标准溶液分别滴定到溶液为淡黄色时,将0.2%的淀粉溶液加入溶液中,溶液变为蓝色,当蓝色刚好消失时停止滴定,对Na2S2O3标准溶液体积的消耗进行记录.用同样的方法滴定2号瓶上层清液.用0.0050mol/L的Na2S2O3标准溶液滴定用50mL移液管移取的3号瓶上层清液,操作方法同上,并在表中记录数据[6].

表3 淀粉指示剂的用量对Na2S2O3滴定0.0100mol/L的KI-I2的饱和溶液所消耗的体积数据

表4 淀粉指示剂的用量对Na2S2O3滴定0.0200mol/LKI-I2的饱和溶液所消耗的体积数据

表5 淀粉指示剂的用量对Na2S2O3滴定H2O-I2的饱和溶液所消耗的体积数据

表6 淀粉指示剂的用量对本实验平衡常数的数据
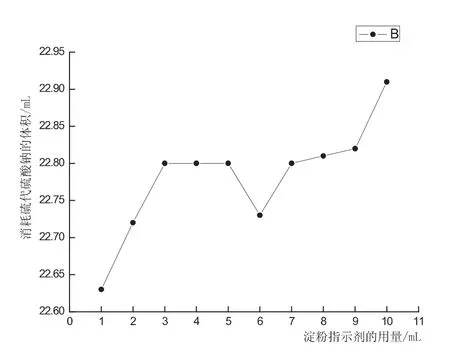
图3 淀粉指示剂的用量对Na2S2O3滴定0.0100mol/L的KI-I2的饱和溶液所消耗的体积影响
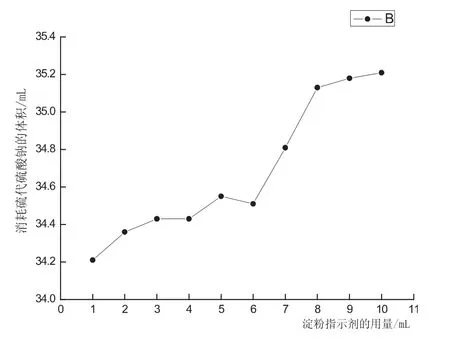
图4 淀粉指示剂用量对Na2S2O3滴定0.0200mol/LKI-I2的饱和溶液所消耗的体积影响

图5 淀粉指示剂的用量对Na2S2O3滴定H2O-I2的饱和溶液所消耗的体积影响
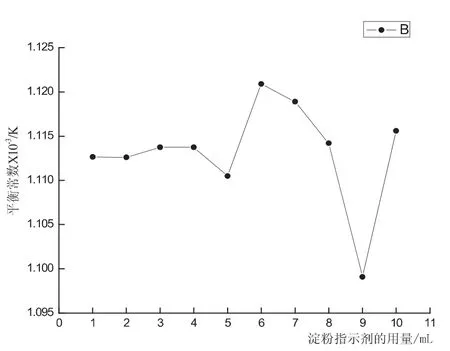
图6 淀粉指示剂的用量对平衡常数的影响
2.2.2 实验分析
淀粉分子可以形成分子内氢键而构成螺旋结构,螺旋结构中有一定空隙,刚好能容纳碘分子进入,碘分子与淀粉之间借助于范德华力联系在一起形成一种络合物[7].随着淀粉指示剂的用量的增加,导致更多的I2被淀粉包裹的更加严密,所以Na2S2O3不易与I2发生反应,会消耗更多的Na2S2O3参与反应.
本实验中指示剂的用量对Kθ值没有较大影响(本实验Kθ值在1.0×10-3~2.0×10-3范围内合格),只是对指示剂的变色灵敏度有影响,滴定终点颜色的判断与指示剂的用量有很大的关系,终点颜色的判断对实验会产生很大的影响.
2.2.3 实验小结
当加入淀粉指示剂1-2mL时,由于指示剂用量过少,指示剂变色不灵敏,现象不明显,滴定误差大;当加入淀粉指示剂3-5mL时,指示剂变色灵敏,现象十分明显,滴定误差小;随着指示剂用量的增加,灵敏度逐渐降低,现象不明显,滴定误差大.所以,在不影响实验结果的情况下,0.2%的淀粉指示剂的合理灵敏度使用范围为3-5mL.
3 实验总结
实验结果表明:在不影响实验结果的情况下,酚酞指示剂的合理灵敏度使用范围为0.04-0.08 mL;0.2%的淀粉指示剂的合理灵敏度使用范围为3-5mL.
〔1〕顾作宁,刘治洲.酸碱滴定反应中指示剂的选用[J].城市技术监督,2000(10):34-35.
〔2〕李芳清.酸碱滴定中指示剂对滴定分析准确度的影响[J].东华理工学院学报,2006,29(1):88-91.
〔3〕张小林,戴兴德.碘淀粉显色稳定性实验探究[J].化学教育,2006,27(11):54.
〔4〕黎碧坚,刘国珍,练翠雯.淀粉指示剂的研究[J].中国卫生检验杂志.2007,17(6):1129-1130.
〔5〕醋酸电离度和电离常数的测定.无机化学实验[M].(第三版).高等教育出版社,2001.128-129.
〔7〕郑翠英.淀粉与碘显色实验影响因素的探究[J].实验设计与技术,2011(7/8):70.
