Luminol-K3[Fe(CN)6]流动注射化学发光体系检测头孢吡肟
2015-01-01俞宏松李晓璐
俞宏松,翟 倩,李晓璐,郭 晶,易 钢
(重庆医科大学 检验医学院 临床检验诊断学教育部重点实验室,重庆 400016)
头孢吡肟(Cefepime)为布迈-施贵宝公司(BMS)开发的新型第四代头孢菌素,其抗菌谱广,对多数革兰阳性菌及革兰阴性菌有抗菌活性,特别对产Ⅰ型β-内酰胺酶的革兰阴性杆菌有很强的抗菌活性。其抗菌作用机制是通过与细菌细胞的1个或多个青霉素结合蛋白(PBPs)相结合,影响细菌细胞壁的合成与代谢,从而起到抗菌作用[1]。目前,头孢吡肟的测定方法主要有高效液相色谱法[2]、离子交换色谱法[3-4]、荧光法[5]、分光光度法[6]等,而用流动注射化学发光法测定头孢吡肟尚未见文献报道[7-9]。
流动注射分析(FIA)是在热力学非平衡条件下,通过载流驱动重现技术来处理试样或试剂区带的动态定量分析技术,具有分析速度快、准确度和精密度好、自动化程度高以及可与多种检测手段相结合等优点[10-12]。化学发光具有灵敏度高、线性范围宽、操作简单等优点[13-15]。将流动注射技术与化学发光检测联用构成的流动注射化学发光检测法已成为近年来药物分析的新手段之一[16-18]。
1 实验部分
1.1 仪器与试剂
MPI-B型多参数化学发光分析测试系统(西安瑞迈电子有限公司);KQ3200DB型数控超声清洗器(昆山市超声仪器公司);Milli-Q纯水仪(密理博中国公司)。
头孢吡肟标准品储备液(1.0×10-4g/mL):准确称取0.010 g头孢吡肟标准品(中国食品药品检定研究所),用水溶解并定容至100 mL容量瓶(棕色),于4℃冰箱中储存备用,使用时以水逐级稀释至所需浓度;NaOH溶液(1 mol/L):称取4 g氢氧化钠用水溶解并定容至100 mL容量瓶(棕色)中备用,使用时以水逐级稀释;鲁米诺储备溶液(2.0×10-3mol/L):准确称取0.035 4 g鲁米诺,用0.1 mol/L NaOH溶液溶解并定容于100 mL棕色容量瓶中,使用时以0.1 mol/L NaOH溶液逐级稀释;K3[Fe(CN)6]储备液(2.0×10-3mol/L):准确称量0.065 9 g K3[Fe(CN)6],用水溶解并定容至100 mL棕色容量瓶中,使用时以水逐级稀释。其他试剂均为分析纯,实验用水为去离子水(Milli-Q,≥18 MΩ·cm)。
1.2 实验方法
流动注射化学发光分析装置如图1所示,各种实验溶液被泵入,在六通阀充分混合后发生化学发光反应,产生的光信号经光电倍增管检测。当注入水时检测到的发光信号为空白信号(I0);当注入一定浓度的头孢吡肟时检测到的增强发光信号为Ia,用相对发光强度ΔI=Ia-I0进行定量分析。
2 结果与讨论
本研究发现,在碱性介质中,头孢吡肟对Luminol-K3[Fe(CN)6]体系的化学发光强度具有显著增强作用(图2),据此建立了流动注射化学发光测定头孢吡肟的新方法,并对针剂中头孢吡肟含量进行了测定。
2.1 反应物混合顺序的影响
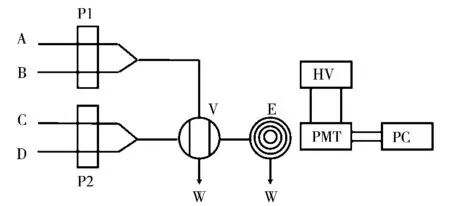
图1 流动注射化学发光分析流路图Fig.1 Schematic diagram of flow injection chemiluminescence(CL)analysis system
实验发现,反应物混合顺序对化学发光强度具有较大影响。分别按照以下混合顺序进行实验:①(头孢吡肟 +鲁米诺)+(K3[Fe(CN)6]+氢氧化钠);②(头孢吡肟+氢氧化钠)+(鲁米诺+K3[Fe(CN)6]);③(头孢吡肟 +K3[Fe(CN)6])+(氢氧化钠+鲁米诺)。结果表明,进样方式①所得ΔI最大且稳定,因此选择此种方式进样。
2.2 实验条件的优化
2.2.1 碱性介质的选择 本实验发光效应需在碱性介质中进行,因此碱性介质种类的选择对实验有较大影响。分别在同浓度的NaOH,Na2CO3,NaHCO33种碱性介质中测定头孢吡肟对Luminol-K3[Fe(CN)6]体系化学发光的增强能力。结果表明,在NaOH溶液中,头孢吡肟对发光体系的增强能力最强。因此选用NaOH为实验的碱性介质。
2.2.2 NaOH浓度的影响 在0.06~0.16 mol/L范围内考察了NaOH浓度对化学发光强度的影响。如图3A所示,NaOH溶液浓度为0.12 mol/L时ΔI较大,之后随着NaOH浓度的增加其发光效应逐渐趋于稳定,因此实验选择NaOH的浓度为0.12 mol/L。
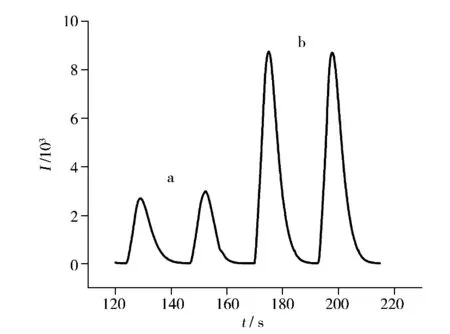
图2 化学发光增强曲线图Fig.2 Enhanced curve of the chemiluminescence system
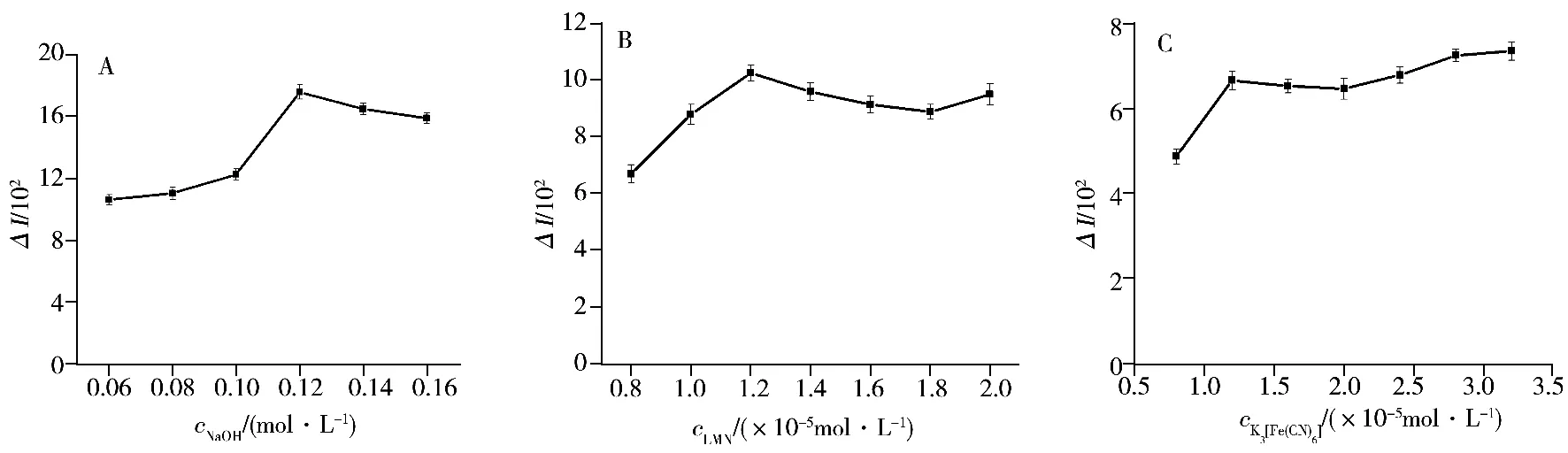
图3 各化合物浓度对体系化学发光强度的影响Fig.3 Effect of compound concentrations on CL intensities of the system
2.2.3 鲁米诺浓度的影响 鲁米诺是本实验体系的发光剂,其浓度会影响体系的发光强度、检测灵敏度及线性范围。在固定其他条件不变的情况下,考察了鲁米诺浓度在8.0×10-6~2.0×10-5mol/L范围内对化学发光强度的影响(图3B)。结果发现,当鲁米诺浓度为1.2×10-5mol/L时,实验体系的发光效应较强且稳定;随着鲁米诺浓度的继续增加,发光强度的变化趋于稳定,因此实验选用鲁米诺浓度为1.2×10-5mol/L。
2.2.4 K3[Fe(CN)6]浓度的影响 K3[Fe(CN)6]是本实验体系的氧化剂,其浓度同样影响体系的发光强度及检测灵敏度。固定其他实验条件不变,考察了K3[Fe(CN)6]浓度在8.0×10-6~3.2×10-5mol/L范围内对发光强度的影响(如图3C)。结果显示,当K3[Fe(CN)6]浓度为1.2×10-5mol/L时ΔI较大;随着K3[Fe(CN)6]浓度的继续增加,体系的发光强度变化逐渐趋于稳定,因此实验选用K3[Fe(CN)6]的最佳浓度为1.2 ×10-5mol/L。
2.3 仪器参数的选择
研究发现,采样时间、蠕动泵的泵速、光电倍增管负高压值影响发光体系的稳定性、信噪比以及化学发光强度。通过实验优化,仪器参数设定如下:采样时间为5 s,蠕动泵的泵速为30 r/min,光电倍增管负高压为700 V。
2.4 线性范围与检出限
在上述优化实验条件下,头孢吡肟在3.0×10-6~4.0×10-5g/mL浓度范围内与相对发光强度ΔI呈良好的线性关系,线性方程为ΔI=434.58+76.26lgρ,相关系数为0.999 6。对2.0×10-5g/mL的头孢吡肟标准溶液连续测定11次,其相对标准偏差(RSD)为1.5%。根据IUPAC建议,以3倍空白标准偏差计算出方法的检出限为2.8×10-6g/mL。
2.5 干扰试验
在优化实验条件下,考察了头孢吡肟针剂中主要添加剂(L-精氨酸)和实验中可能的干扰物对头孢吡肟含量测定的干扰。以相对误差小于5%为允许量,对1.0×10-5g/mL头孢吡肟进行多种物质的干扰实验。结果表明,100倍的Na+、K+、Cl-、葡萄糖,50倍的PO3-4、Zn2+、SO2-4,20倍的L-精氨酸、淀粉、糊精、乳糖,以及等倍浓度的Ca2+与Mg2+均不干扰测定。由于头孢吡肟针剂中上述干扰物质的实际含量均低于允许量,因此无须分离或其他处理,可直接测定。
2.6 实际样品的测定
准确称取头孢吡肟针剂(悦康集团)0.010 g,加水溶解并定容至100 mL,使用时以水稀释其浓度至工作曲线范围。头孢吡肟针剂溶液稀释20倍后,头孢吡肟的标记浓度为5.0×10-6g/mL。采用本方法对针剂中的头孢吡肟含量平行测定9次,得平均值为5.03×10-6g/mL,RSD为1.3%。分别按照低、中、高3个浓度水平进行加标回收实验,测得的回收率分别为97%,102.3%,98.5%,RSD分别为0.6%,1.1%,1.9%,结果如表1所示。

表1 样品回收率试验结果Table 1 Results of recovery test
3 结论
本文基于头孢吡肟在碱性介质中对Luminol-K3[Fe(CN)6]化学发光体系具有明显的增强作用,建立了测定头孢吡肟的新方法。该方法灵敏度高,线性范围宽,重复性好,用于头孢吡肟针剂的检测,结果满意。该方法有望成为临床检测头孢吡肟浓度的方法之一。
[1]Chen H Y,Lin Y,Dong P.Chin.Pharm.J.(陈华英,林阳,董平.中国药学杂志),2009,2(4):67-71.
[2]Shi Y H.Chinese Medicine Guide(史玉红.中国医药指南),2013,11(7):497-499.
[3]Guo J Z,Cui H,Zhou W,Wang W.J.Photochem.Photobiol.A,2008,193:89-96.
[4]Wang J Y,Song S J,Wu Q H,Wang C,Wang Z.Spectrosc.Spectral Anal.(王珺瑫,宋双居,吴秋华,王春,王志.光谱学与光谱分析),2011,31(9):2517-2521.
[5]Boro R C,Kaushal J,Nangia Y,Wangoo N,Bhasin A,Suri C R.Analyst,2011,136:2125 -2130.
[6]Wang W,Duan M R,Zhai Y J,Bi S Y,Kang W J,Xu X D.Chin.J.Spectrosc.Lab.(王玮,段梦茹,翟一静,毕思远,康维均,徐向东.光谱实验室),2013,30(3):1488-1492.
[7]Ji Z P,Yu J D,Hu X Y.Univ.Chem.(嵇正平,郁金丹,胡效亚.大学化学),2012,27(6):65-68.
[8]Chen X L,Yang J,Xu S J,Xiao L J.Chin.J.Anal.Chem.(陈效兰,杨娟,徐淑静,肖柳婧.分析化学),2009,37(11):1622-1626.
[9]Ma M Y.Appl.Chem.Ind.(马明阳.应用化工),2014,43(5):954-956.
[10]Li Y X,Yang P,Wang P,Wang L.Anal.Bioanal.Chem.,2007,387:585-592.
[11]Ji Z L,Zhang J K,Li J G.Chin.J.Anal.Chem.(汲中玲,张泾凯,李建国.分析化学),2009,16(1):128.
[12]Xiong H T,Tang Z H,Nie F,Zheng X W.J.Instrum.Anal.(熊海涛,唐志华,聂峰,郑行望.分析测试学报),2013,32(2):244-248.
[13]Xiong X Y,Tang Y H,Yu C L,Han X N.Northewest Pharm.J.(熊迅宇,唐玉海,于春玲,韩小年.西北药学杂志),2006,12(25):569-574.
[14]Yuan J,Wang W,Kang W J,Xu X D.J.Instrum.Anal.(苑洁,王玮,康维钧,徐向东.分析测试学报),2011,30(12):1436-1439.
[15]Li H S,Zhao M,Liang C,Zhao C J.China Pharm.(李海珊,赵曼,梁晨,赵春杰.中国药业),2010,29(5):82-84.
[16]Li L J,Zhong Z H,Feng J,Chen Q F,Cheng H,Huang W Y,Kong H J,Wu J L.J.Instrum.Anal.(李利军,钟招亨,冯军,陈其锋,程昊,黄文艺,孔红星,吴健玲.分析测试学报),2007,26(1):125-127.
[17]Fan X M,Wang S M,Yin Z M,Su Z K,Chen F Y,Wang X S,Cui F L.J.Instrum.Anal.(樊雪梅,王书民,尹治民,苏智魁,陈凤英,王宪生,崔凤灵.分析测试学报),2012,31(7):873-876.
[18]Wang J,Qu J Y,Zhu L L,Wang J Z,Wang Y.J.Instrum.Anal.(王珏,屈建莹,朱莉莉,王金中,王越.分析测试学报),2011,30(1):91-94.
