蕨菜多糖提取条件研究
2015-01-01李文琼
张 莉,李文琼
(1.皖西学院生物与制药工程学院,安徽 六安237012;2.兰州军区疾病预防控制中心,甘肃 兰州730020)
蕨菜又名拳头菜,如意菜,龙爪菜等,含有多种对人体有益的营养成分[1-2]。近年来已成为深受人们热爱的山野菜[2-4]。蕨菜中含有丰富的黄酮类物质,其含量高达7.28%[5],目前,研究发现蕨菜黄酮具有抗氧化以及增强机体免疫功能等保健作用[4-7]。目前,有关蕨菜化学成分分析,尤其是黄酮类化合物的研究较多[5-7],多糖具有生理功能[8-9],但对于蕨菜多糖的相关研究报道较少,本文以皖西大别山产出野生蕨菜为原料,对其多糖的提取条件进行相关研究,多糖提取的原料也可采用提取黄酮类化合物后的残渣,因此本研究为蕨菜的进一步的开发,综合利用蕨菜资源提供了依据。
1 材料和方法
1.1 材料
蕨菜:2014年4月购于安徽霍山县。
蕨菜粉:新鲜蕨菜103℃烘箱干燥,粉碎,过40目筛。
1.2 仪器及试剂
1.2.1 仪器
TD5-2自动离心机(长沙平凡仪器表有限公司);HH-2恒温水浴锅(国华电器有限公司);TU-1901型紫外可见光分光光度计(北京普析通用仪器设备有限公司);101AS-2型不锈钢数显电热干燥箱(上海浦东跃欣科学仪器厂);FA1004型电子天平(上海精科天平)等。
1.2.2 试剂
无水乙醚,无水乙醇,葡萄糖,浓硫酸,苯酚等均为国产分析纯。
1.3 实验方法
1.3.1 蕨菜粉的脱脂处理
取蕨菜粉放于烘箱,103℃烘至恒重,将蕨菜粉用滤纸包成滤纸包,用无水乙醚作为提取剂,水浴45℃加热,索氏提取法脱脂。直到洗脱液无色,拿出滤纸包,放在通风处等乙醚挥发到气味比较淡时放入烘箱,103℃烘至恒重。
1.3.2 蕨菜粉的醇处理
把脱脂后的滤纸包放入索氏提取器,用无水乙醇作为提取剂,90℃恒温水浴加热,直到提取筒内液体为无色,脱醇溶性杂质。拿出过滤好的纸包,放在通风处让乙醇挥发至醇味比较淡时放进干燥箱中,103℃烘至恒重。
1.3.3 蕨菜多糖含量的测定:苯酚硫-酸法[10-11]
(1)绘制葡萄糖标准曲线[12]
葡萄糖标准品在105℃下烘干至恒定重量后,准确称取0.100 0g置于100mL烧杯中加20mL蒸馏水溶解,转移至100mL容量瓶中,加蒸馏水定容至刻度,摇匀备用,浓度为1mg/mL,即为储备液。将储备液稀释10倍作为标准溶液,浓度为0.1mg/mL。
准确移取葡萄糖标准溶液0.0、0.1、0.2、0.3、0.4、0.5mL于试管中,补水至2mL,分别加入1mL 6%苯酚溶液,摇匀后迅速加入5mL浓硫酸,摇匀。将各试管于40℃水浴保温30min后取出,冷水浴冷却至室温,在490nm处测其吸光度,以试剂空白作参比。得到回归方程:A=9.557 1C-0.091 9,R2=0.993 3。
(2)样品吸光度的测定
分别从样液中取0.5mL溶液稀释20倍后,取1.0mL稀释液于试管中,按标准曲线测定方法测定吸光度。计算提取率。
1.3.4 单因素实验
(1)料液比单因素实验[13]
分别称取蕨菜干粉置于锥形瓶中(n=2),设定水浴温度为70℃,提取时间为2h,并且料液比为1∶10,1∶20,1∶30,1∶40和1∶50,水浴加热回流提取。提取结束,过滤,滤液用蒸馏水定容至100mL。分别测定其中多糖含量。
(2)提取时间单因素实验[13]
分别称取蕨菜干粉置于锥形瓶中(n=2),设定料液比为1∶20,提取温度70℃,分别设定提取时间为1h,2h,3h,4h,5h,水浴加热浸提。提取结束,过滤,滤液用蒸馏水定容至100mL。分别测定其中多糖含量。
(3)浸提温度单因素实验[13]
分别称蕨粉干粉置于锥形瓶中(n=2),设定固液比为1∶20,提取时间2h,分别设定提取温度为50℃、60 ℃、70 ℃、80 ℃、90 ℃,2小时后,提取结束,过滤,滤液用蒸馏水定容至100mL。分别测定其中多糖含量。
1.3.5 正交试验因素水平[14-15]
在单因素实验的基础上,选用L9(33)正交实验,正交因素水平如下:

表1 正交试验因素水平
2 结果与分析
2.1 蕨菜粉预处理去杂质分析
在对蕨菜粉进行预处理时,经过无水乙醚脱脂,无水乙醇去除醇溶性杂质,由公式:醇溶性物质含量(%)=(未脱去醇溶性物质滤纸包质量-已脱去醇溶性物质滤纸包质量)÷蕨菜粉质量×100%

表2 蕨菜粉醇溶性杂质
从表2知,蕨菜内含有醇溶性物质,经过无水乙醇的处理,蕨菜包的质量明显减少,经过计算,得出醇溶性物质含量为2.76%。
2.2 单因素实验结果
2.2.1 料液比对蕨菜多糖提取率的影响
由图1可知,随料液比的加大,多糖提取率渐渐提高,固液比从1∶10到1∶20增长快速直至料液比1∶20之后,多糖提取率提高不明显。且考虑到溶剂量的加大为后续的浓缩等步骤增加负担,因此,最合适的料液比为1∶20。
2.2.2 提取时间对多糖提取率的影响
由图2可知,提取时间小于3h时,随着提取时间的增加,提取率明显提高,3h后整个曲线慢慢平稳,最后趋于稳定,接着增加提取时间,但曲线还是趋于平缓,由此得出提取时间最优为3h。

图1 料液比对多糖提取率的影响

图2 提取时间对多糖提取率的影响
2.2.3 提取温度对多糖提取率的影响
由图3可知,从50℃到80℃,随着提取温度的升高,多糖得率呈现出先增加后下降的上升趋势,从80℃到90℃,提取温度升高,多糖得率出现下降,因此,蕨菜多糖提取的最佳温度为80℃。
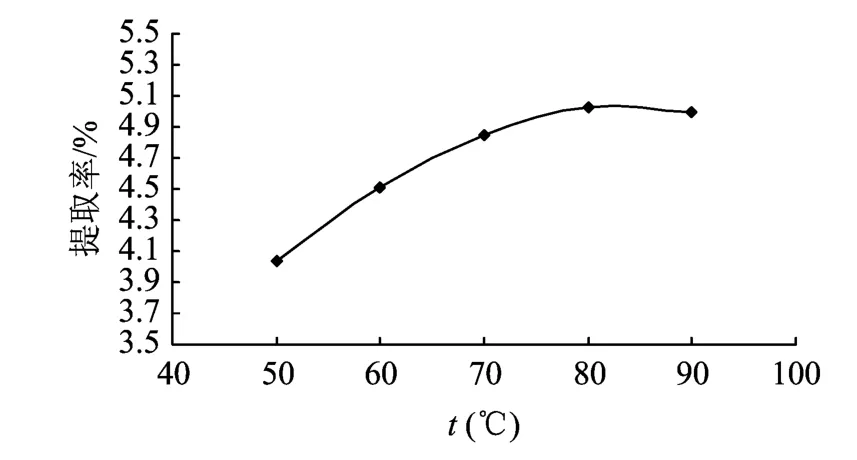
图3 提取温度对多糖提取率的影响
2.3 正交试验结果与分析
根据表3、4知,极差R剖析得出,蕨菜多糖的提取率影响因素主顺序为A>B>C。即固液比对蕨菜多糖的提取率影响最小,浸提时间其次,而浸提温度对蕨菜多糖的提取率影响最大,对提取效果影响显著。最优提取工艺:A3B3C2,提取率:6.23%。

表3 L9(34)正交试验结果分析表
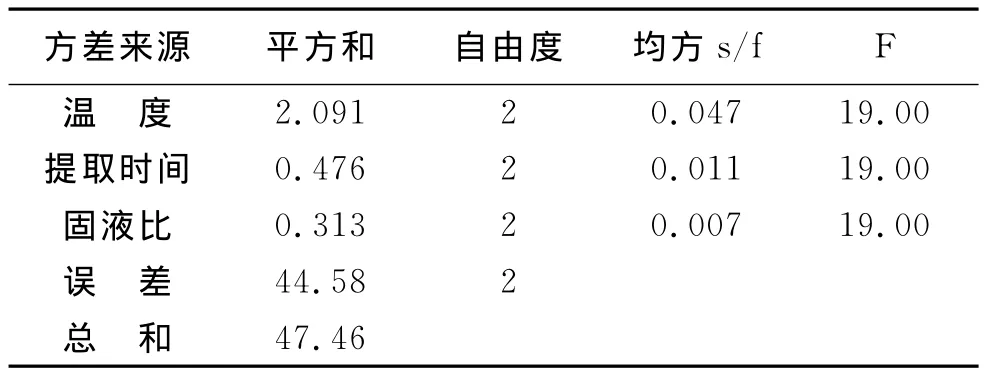
表4 L9(34)正交方差分析
2.4 验证实验
用正交试验得出的最佳条件A3B3C2,即提取温度为90℃,提取时间为4h,固液比为1∶20,进行验证实验。样品量1.000 0g,平行实验3组。

表5 验证实验结果
3次重复实验表明,该方法重现性好,结果稳定可靠。
3 小结
通过正交试验法优化蕨菜多糖的提取工艺条件,对蕨菜多糖提取率的影响因素进行了排序为:A>B>C,即最佳提取工艺为A3B3C2,浸提温度为90℃,浸提时间为4h,固液比为1∶20,提取率为6.23%。
[1]安徽植物志协作组.安徽植物志(第1卷)[M].合肥:安徽科学技术书出版,1985.
[2]李海燕,王立川,唐伟斌.栽培蕨菜与野生蕨菜和常见栽培蔬菜营养成分的对比分析[J].安徽农业科学,2008,36(14):2868-2869.
[3]张莉,陈乃富,吴美.蕨根茎及老嫩叶中黄酮含量的比较[J].食品与发酵工业,2006,32(11):43-46.
[4]陈乃富.蕨菜黄酮类化合物的提取及其抗氧化作用[J].食品与发酵工业,2003,29(11):63-66.
[5]陈乃富,黄新华,季洪武.蕨菜黄酮对小鼠体内丙二醛含量的影响[J].生物学杂志,2006,23(4):30-33.
[6]张莉,陈乃富,谷仿丽,等.蕨菜黄酮提取物的免疫调节作用[J].中国中医药科技,2009(1):30-31.
[7]张莉,陈乃富,王晨.败酱黄酮类化合物的提取条件研究[J].中国林副特产,2007,03:14-16.
[8]赵国华,陈宗道,李至孝,等.活性多糖的研究进展[J].食品与发酵工业,2001,27(7):45-45.
[9]张晓静,刘会东.植物多糖提取分离及药理作用的研究进展[J].时珍国医国药,2003,14(8):495-496.
[10]马红樱,张德禄,胡春香,等.植物活性多糖的研究进展[J].西北师范大学学报,2004,40(3):12-14.
[11]邬卫东,张晓文.硫酸-苯酚法测定枸杞多糖含量[J].中草药,2003,(3):38-39.
[12]陈靖,邹艳丽,徐成东,等.方秆蕨中多糖含量的测定安徽农业科学[J].2012,40(6):3280-3281.
[13]段文昌,赵海泉,张莉,等.盐肤木果实多糖提取工艺研究[J].皖西学院学报,2012,28(5):6-7.
