杜仲叶总黄酮降血脂作用研究
2015-01-01雷燕妮张小斌
雷燕妮,张小斌
(商洛学院生物医药与食品工程学院,陕西商洛 726000)
杜仲叶(Eucommia folium)为杜仲科植物杜仲Eucommia ulmoides Oliv.的干燥叶,为2010版《中国药典》收载品,夏、秋二季枝叶茂盛时采收,晒干或低温烘干。气微,味微苦,具有补肝肾、强筋骨之功效[1]。研究发现杜仲主要有效成分为黄酮类、环烯醚萜类、木质素、杜仲胶等成分[2]。邓素兰等[3]研究表明杜仲叶中黄酮类成分含量丰富,且在民间常有饮用杜仲嫩叶茶来调节血脂的报道[4]。现代药理学研究表明,杜仲具有降血脂、抗肿瘤及免疫调节等药理作用[5]。关于杜仲药理作用研究已相当成熟,而对杜仲叶的研究则成为了热点。
近些年来,随着人们生活水平的日益提高,由饮食习惯而导致的高血脂、脂肪肝等疾病的发病率正逐年增加,目前,除了饮食控制和强化体育锻炼之外,就是依靠药物治疗[6]。然而,理想的治疗高血脂的药物在目前仍然比较匮乏。本实验通过建立大鼠高血脂模型,以非诺贝特为阳性对照药,观察杜仲叶总黄酮(Total Flavonoids of Eucommia Folium,TFEF)对高血脂动物模型的降血脂作用,以期为进一步开发治疗高血脂药物提供理论依据。
1 材料与方法
1.1 实验动物
健康雄性 Wistar大鼠,体重为120~250 g,SPF级,购于陕西医药控股集团生物制品有限公司,生产许可证号:SCXK(陕)2008-005;使用许可证号:SYXK(陕)2008-006。
1.2 药物与试剂
杜仲(购于商洛市香菊制药公司,产地商洛,经陕西省商洛市中药材GAP科研工程中心张小斌教授鉴定为杜仲科植物杜仲的树叶)。芦丁对照品(中国食品药品检定研究院);速眠新Ⅱ注射液(吉林省敦化市圣达动物药品有限公司,批号:20120404);非诺贝特(北京京丰制药有限公司,批号:100603);甲基硫氧嘧啶(江苏常州康普药业有限公司,批号:20020366);胆固醇、牛磺胆酸钠(西安绿郡生物科技有限公司);猪油(市售板油熬制);乙腈、甲醇、甲酸、冰醋酸(天津天力化学试剂厂);甘油三酯测定试剂(浙江东瓯生物工程有限公司,批号:200305002);总胆固醇测定试剂(咸宁吉斯生物科技有限公司,批号:20090428);高密度脂蛋白胆固醇(上海荣盛生物技术有限公司,批号:2401199);低密度脂蛋白胆固醇(上海荣盛生物技术有限公司,批号:2401196);水为自制纯水,其他试剂均为化学分析纯。
1.3 仪器
MK3酶标分析仪,美国热电公司;LC-2010型高效液相色谱仪,日本岛津公司;759CRT型紫外可见分光光度计,上海荆和分析仪器有限公司;ACS-ZE01型电子计重秤,杭州万特衡器有限公司;HH-600型数显三用恒温水箱,江苏省金坛市友联仪器研究所;DV114C型电子天平,美国奥豪斯;ZH-B6大鼠代谢笼,淮北正华生物仪器设备有限公司。
1.4 杜仲叶总黄酮的制备及组成分析
1.4.1 杜仲叶总黄酮的制备 以超声波辅助法提取杜仲叶总黄酮[7],按照料液比(g/mL)1∶15,超声浸提时间2 h,反复浸提3次,超声功率0.45 W/cm2,再采用柱层析法进行纯化。
1.4.2 杜仲叶总黄酮组成分析 参照郭孝武[8]所用方法测定杜仲叶总黄酮含量。采用HPLC法测定黄酮类成分组成及其含量,具体方法参照2010 版《中国药典》[1]。
1.5 高血脂动物模型的建立
取健康Wistar大鼠35只,体重110~170 g,常规饲养,自由取食、饮水一周后观察,无异常,随机分为两组:5只为正常对照组,30只为造模组,两组均以基础饲料饲喂。参照刘建文[9]所用方法制备:高脂饲料(4%的胆固醇、10%的猪油、0.2%的甲基硫氧嘧啶和86%的基础饲料),饲喂7~10天即可形成明显的高脂血症。造模组每天同一时间饲喂等量的高脂饲料,正常对照组在每天同一时间饲喂相等数量的基础饲料,连续喂到第10天,参照文献[10]中1.2.2的方法判断造模是否成功[10],随后,在造模组中挑选25只造模成功的大鼠,以开展后续实验。
1.6 进行动物分组、给药及样品处理
1.6.1 将动物分组及其给药剂量 把已经成功造模的高血脂大鼠平均分为5组,每组6只,分别为:模型组、阳性组、高剂量组、中剂量组和低剂量组,每天定时给模型组和阳性组两个对照组饲喂等体积的蒸馏水,分别用90,30,10 mg/(kg·d)的杜仲叶总黄酮对给药组大鼠灌胃,给予阳性药对照组15 mg/(kg·d)非诺贝特,连续给药30天。
1.6.2 动物给药及处理 给药过程中,除正常对照组外,其余各组上午继续给予高脂饲料5 g/100 g。
给药方式:各组大鼠每天灌胃给予供试药品1次(阳性对照药物以及不同剂量的杜仲总黄酮),灌胃量为1.5 mL/100 g体重,连续给药30天。
平时观察并进行记录:在代谢笼中饲养大鼠,将各实验组大鼠的活动情况每天定期观察,并记录其进食量与进水量,于每周同一时间称量大鼠体重;最后一次给药结束后,将各组大鼠禁食14小时,再次进行体重称量之后处死,麻醉(肌肉注射速眠新Ⅱ),抽取其新鲜血液,并将血清分离,将其肝脏组织取出后制成组织匀浆,分别用1.2中试剂盒测定大鼠血清和肝脏相关指标[11-14]。
1.7 血脂指标测定
所有血液和肝组织指标均采用试剂盒检测,严格按照试剂盒操作说明进行,以酶法或比色法测定。
1.8 数据处理
剔除异常数值,所有实验数据采用SPSS 17.0进行分析,结果均以“均数±标准差”表示,对数据进行t检验。
2 结果与分析
2.1 杜仲叶总黄酮成分分析
杜仲叶中黄酮得率为20.3%,比色法测得制备的杜仲叶黄酮提取物的质量分数为83.7%,纯度相对较高。杜仲叶总黄酮的HPLC分析见图1,可见杜仲叶总黄酮主要由4种成分组成,分别是山奈酚、槲皮素、紫云英苷和芦丁。
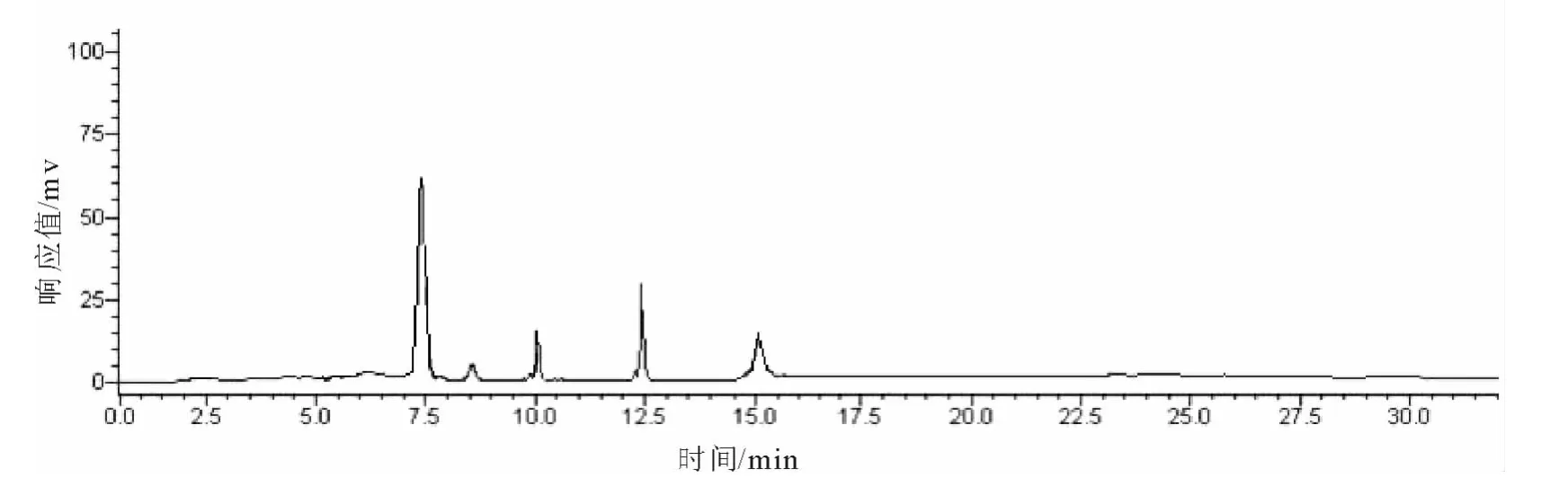
图1 杜仲叶总黄酮HPLC图Fig.1 The total flavonoids from Eucommia ulmoides leaves HPLC diagram
2.2 杜仲叶总黄酮对大鼠体重的影响
在整个试验中,所有试验动物均能正常生长,活动情况亦未出现异常现象,无异常死亡情况。各组试验动物数量均控制在5~8只范围内,使其符合药理活性实验的要求。最后,全部大鼠处理均符合实验动物伦理学要求。从表1可以看出,各组大鼠体重均有所增加,但各组间每周平均体重差异不明显(P>0.05)。与模型对照组比较发现,在试验结束之前,禁食后高剂量组的最终体重有显著降低(P<0.05),其余各组无显著性差异(P >0.05)。
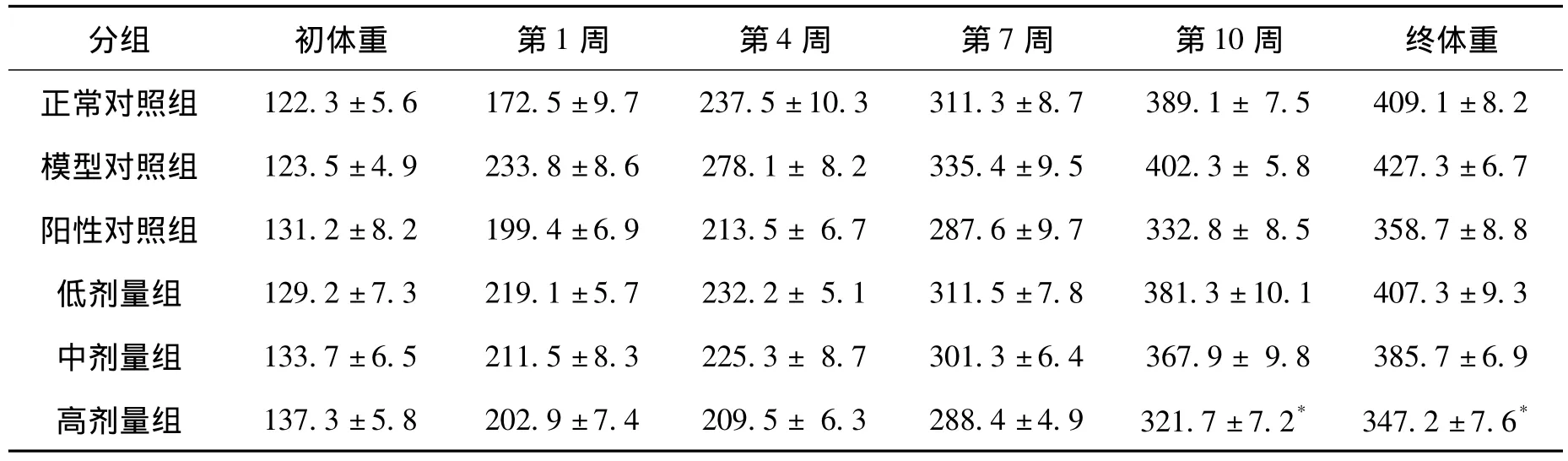
表1 杜仲叶总黄酮对大鼠体重的影响Tab.1 Effect of total flavonoids of Eucommia ulmoides leaves on weight of rats(x ±s,g,n=6)
2.3 杜仲叶总黄酮对高血脂大鼠血脂指标的影响
试验结束之后,经过对样品进一步处理和检测发现,与正常对照组比较,各模型组均有显著性或极显著性差异(P<0.05或P<0.01),说明本次成功完成造模试验。经过对大鼠喂食杜仲叶总黄酮一个月,对比给药组(高、中、低剂量组和阳性组)与模型组中的总胆固醇、甘油三酯、低密度脂蛋白胆固醇、脂蛋白以及载脂蛋白B含量,以上各成分含量均有不同程度降低(P<0.05或P<0.01);而高密度脂蛋白和载脂蛋白A则有不同程度升高,如表2和表3。当给药剂量为75 mg·kg-1时,TC,HDL-C和LP-a指标水平均高于正常组,而TG,LDL-C,APo-A和APo-B的水平略低于正常组;同时,与相同剂量的阳性药物相比,给药组的降血脂作用要稍逊一筹,但无显著性差异(P>0.05)。
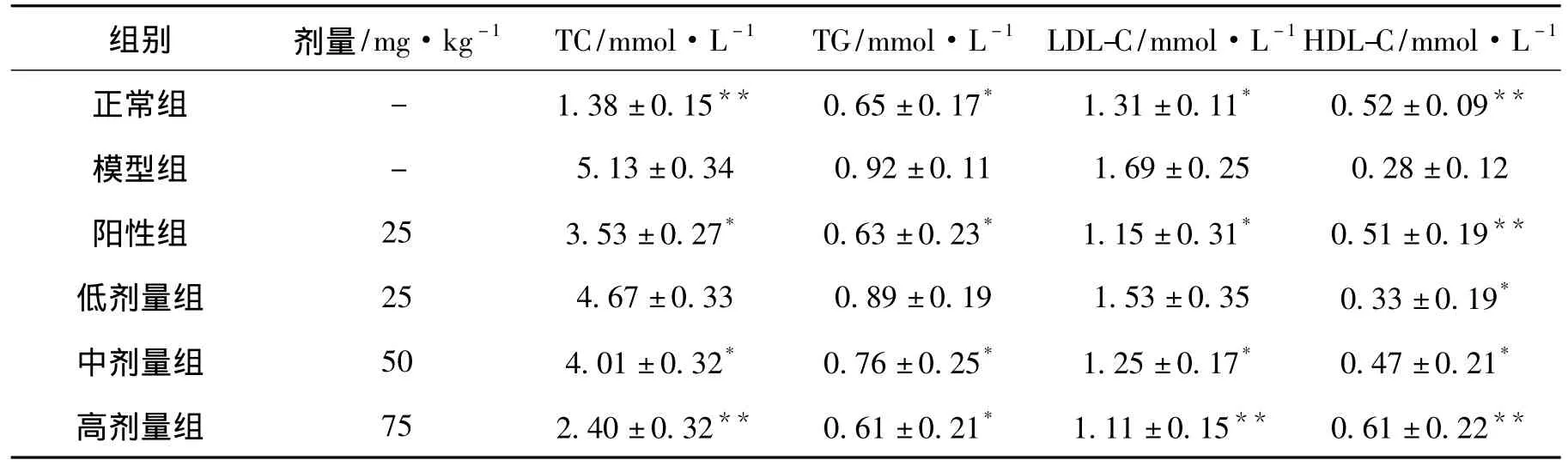
表2 杜仲叶总黄酮对大鼠血脂水平的影响Tab.2 Effect of total flavonoids of Eucommia ulmoides leaf on serum lipid level in rats(x ± s,mmol·L-1,n=6)

表3 杜仲叶总黄酮对大鼠血脂水平的影响Tab.3 Effect of total flavonoids of Eucommia ulmoides leaf on serum lipid level in rats(x ± s,mmol·L-1,n=6)
2.4 杜仲叶总黄酮对高血脂大鼠肝脏组织中脂质含量的影响
由表4可见,在模型组中,大鼠肝脏组织中的总胆固醇和甘油三酯含量与正常组比较,有显著增高(P<0.05或P<0.01);在阳性对照组及杜仲叶总黄酮给药组(高、中剂量组)与正常组相比较,其肝脏组织中甘油三酯和总胆固醇含量有显著降低(P<0.05或P<0.01);而与模型组相比较,正常组肝脏组织中的所有指标均低于其他组。另外,肝脏指数无明显变化。

表4 杜仲叶总黄酮对大鼠肝组织中脂质含量及肝脏指数的影响Tab.4 Effect of total flavonoids of Eucommia ulmoides leaveson lipid content and index of liver in rat liver(x ± s,n=6)
3 结论与讨论
中药复方治疗高血脂,辨证施治,可达到标本兼治的目的,其降脂作用缓和且药效持久,副作用小。因而,研制出具有降高血脂的新型中药就显得很有必要[6]。
现代研究表明,血脂长期过高,易引发动脉粥样硬化和冠心病等心脑血管疾病。动脉硬化通常不易察觉,通过不定期检查血液中有关血脂指标含量,可及时发现并预防动脉硬化。通过对实验性高血脂大鼠血脂水平的检测研究,与模型对照组相比较,发现杜仲叶总黄酮剂量组能够明显改善高血脂大鼠的血脂水平,并且呈现一定的量-效关系,表明杜仲叶总黄酮具有较好的降血脂作用。综上所述,杜仲叶总黄酮具有降低高血脂模型大鼠血脂水平的作用。
[1] 国家药典委员会.中华人民共和国药典.2010版1部[M].北京:中国医药科技出版社,2010:154-155.
[2] 程光丽.杜仲有效成分分析及药理学研究进展[J].中成药,2006,28(5):723-725.
[3] 邓素兰,余继宏,管林.杜仲不同部位总黄酮含量的测定[J].生物化学工程,2007,41(3):37-38.
[4] 张瑛朝,张廷敏,郭代立,等.复方杜仲叶合剂对人体降压作用的实验研究[J].中成药,2001,23(6):418-421.
[5] 彭红梅,李小姝.杜仲药理作用研究现状及应用展望[J].中医学报,2013,28(1):72-73.
[6] 武聪.人参皂苷降解物对高血压高血脂大鼠心肝肾的形态学研究[J].吉林大学学报(医学版),2007,33(2):1-5.
[7] 袁英髦,曹雁平.超声波辅助提取杜仲皮中的杜仲胶和杜仲黄酮[J].食品科学技术学报,2014,32(2):67-71.
[8] 郭孝武.超声提取杜仲中黄酮类物质工艺研究[J].陕西师范大学学报(自然科学版),2005,32(2):67-71.
[9] 刘建文.药理实验方法学:新技术与新方法[M].北京:化学工业出版社,2008:259-276.
[10]雷燕妮.黄芩总黄酮对高血脂大鼠的降血脂作用研究[J].动物医学进展,2014,35(7):61-65.
[11]刘建文.药理实验方法学:新技术与新方法[M].北京:化学工业出版社,2008:279-288.
[12]徐超,王鸿飞,邵兴锋,等.香榧子油抗氧化活性及降血脂功能研究[J].中国粮油学报,2012,27(8):43-47.
[13]周素梅,盛清凯,路长喜,等.不同燕麦品种的辅助降血脂功效研究[J].中国粮油学报,2011,26(3):25-29.
[14] EVERSON G T.Bile acid metabolism and its role in human cholesterol balance[J].Semin Liver Dis,1992,12(4):420-428.
