桑黄菌丝体对H22荷瘤小鼠肿瘤生长的影响
2015-01-01吴亚召张文隽宋延平谢婷婷李玲梅
雷 萍,吴亚召,张文隽,宋延平,杜 芳,杨 洁,谢婷婷,李玲梅
(1.陕西省微生物研究所,陕西西安 710043;2.陕西省中医药研究院,陕西西安 712000)
肿瘤是在各种致癌因素作用下,机体在基因水平上局部组织的某一个细胞失去对其生长的正常调控,导致其克隆性异常增生而形成的异常病变。目前,肿瘤的治疗方法主要有以下几类:外科治疗,肿瘤的外科治疗即手术治疗,是治疗某些肿瘤的最有效的方法,是肿瘤治疗较为传统的方法之一,化疗和放疗,化疗是用化学药物[1]进行治疗,属于肿瘤的全身治疗方法,放疗,俗称“烤电”“照光”,是利用电离辐射来治疗肿瘤的一种方法;生物疗法,是通过生物反应修饰剂(BRM)对肿瘤进行治疗,反应修饰剂主要包括细胞因子、免疫活性细胞、单克隆抗体及其偶联物、肿瘤分于疫苗等;中医药治疗肿瘤,中医药治疗运用整体观念、正邪学说、辩证理论等高度概括了肿瘤的发病机理和病程转归,对肿瘤的治疗起着重要的指导意义。在这几种主要治疗方法中,中医药治疗肿瘤越来越受到人们的重视。
桑黄菌(Phellinus ignairius)又名裂蹄木层孔菌,是一种多年生珍贵药用真菌[2-3]。子实体单生,主要生长于桑树、杨树、白桦树等阔叶树的枯立木树干上[4]。桑黄寄生树种不同,颜色、形状以及所含有效活性成分亦不同[5]。桑黄菌味微苦,桑黄子实体具很好的抗癌活性,含落叶松蕈酸、麦角甾醇等。日本人 Ikekaw T等[6]在1968年发现,桑黄野生子实体的水提取物对小鼠肉瘤S180的抑制率为 96.7%,Sasaki T[7]等发现桑黄发挥抗癌作用的单体物质为多糖,桑黄多糖具有促使肿瘤细胞自我毁灭的诱导细胞自杀活性作用,可以防止肿瘤细胞附着于体内,同时拥有肿瘤转移作用[8]。温克[9]等人以小鼠胃癌和 S180肉瘤为模型,研究比较桑黄、灵芝、阿加里斯茸PL-2,PL-5的抗癌活性,结果显示桑黄在4种药物中有较好的抑瘤作用,分别为43.09%和46.07%。桑黄是目前国际公认的抗癌效果较好的大型真菌之一[10]。Ajijh.t.a等研究了桑黄乙酸乙酯、甲醇和水的提取物,然后用来分别抗Dalton淋巴腹水癌和Ehrlich腹水癌,发现水提物对它们没有细胞毒素作用,而这3个提取物对DLA引起的小鼠肿瘤细胞有着显著的生长抑制作用。桑黄产品作为抗肿瘤药物具有极大的药用价值和开发潜力[11]。桑黄菌丝体可通过发酵工程大规模生产,克服子实体资源匮乏的缺点。
1 材料与方法
1.1 实验动物与瘤株
1.1.1 实验动物 清洁级KM小鼠,50×3只,雌性或雄性,体重20±2g,购于西安交通大学实验动物中心。动物合格证号:0012286;0012296;0011714。
所有实验动物均给予小鼠标准颗粒饲料,实验在二级动物室进行,净化室温度在20~25℃;相对湿度在40% ~70%。门窗密闭,使用空气净化系统,送新风全口开启,送风机隔日换机一次,人流和废弃物等按规定的方向运行,不得逆转。试验结束后,对处死动物的尸体、垃圾袋装后及时清理。
1.1.2 瘤株 小鼠H22肉瘤细胞:由中国医学科学院药物研究所引进,解放军第四军医大学实验动物中心提供。
1.2 试验药物
100%桑黄菌丝体(陕西省微生物研究所菌种资源中心三室,批号20121010)。注射用环磷酰胺(国药准字H14023686,批号04120101,山西普德药业股份有限公司生产)。
1.3 主要仪器设备
BS210S电子天平(精确度0.1 mg,北京赛多利斯天平厂)。XSZ-D2 9818504显微镜(重庆光学仪器厂)。TDL-4型低速台式离心机(上海安亭科学仪器厂)等。
1.4 剂量设置及配制
桑黄菌丝体急毒的最大耐受量是15 g/kg,取其1/5作为中剂量,即3.0 g/kg,加一倍为大剂量6.0 g/kg,减一倍为小剂量1.5 g/kg。称取桑黄菌丝粉末6 g,加蒸馏水至20 mL配制成30%桑黄菌丝体混悬液,为大剂量,稀释成为15%,7.5%为中、小剂量,给药体积均为0.2 mL/10 g。环磷酰胺(CTX):按20 mg/kg剂量灌胃给药。
1.5 H22实体瘤小鼠模型的制备
取冻存的肝癌H22细胞瘤株,常规复苏,用PBS调整瘤细胞浓度为1×107/mL,取0.5 mL(活细胞数为5×106)接种于3只小鼠腹腔内,约一周后小鼠出现癌性腹水。待癌性腹水长至7~10 d后无菌抽取癌性腹水,PBS洗涤2次,每次2 000 r/min,离心10 min。离心后弃上清液,显微镜下计数,调整活细胞浓度为1×107个/mL,吹打混匀后备用。按0.2 mL/只接种于小鼠右腋皮下,即为小鼠H22实体瘤模型。需注意配置细胞悬液到小鼠接种完成需在冰域中进行,并在1 h内完成。
1.6 动物分组
接种H22瘤细胞后24h,将动物随机分为5组,每组10只,即模型对照组、阳性药对照组(CTX)、桑黄菌丝体大、中、小剂量组。
1.7 给药剂量
模型对照组按0.2 mL/10 g灌胃给予纯净水,1次/d;阳性对照组按剂量20㎎/㎏灌胃给予环磷酰胺(CTX),体积为0.2 mL/10 g,1次/d;桑黄菌丝体按上述浓度体积给药,1次/d,连续给药10次。
1.8 测定荷瘤小鼠抑瘤率
末次给药后24h内用拉脱颈椎法处死动物,称重,解剖取瘤,计算肿瘤抑制率。
肿瘤抑制率%=(对照组平均瘤重-给药组平均瘤重)/对照组平均瘤重×100%
1.9 统计学处理
按上述方法重复3批试验,以验证药物抑瘤效果。每批应用不同性别的动物以消除性别差异的影响,但同一批次的动物必须使用同一性别。
2 结果与分析
结果见表1-表4,结果表明,除环磷酰胺阳性组第一、第三批及3批平均小鼠体重增长明显低于模型组外(P<0.01),试验其余各组动物体重均匀增长,模型组肿瘤生长良好。桑黄菌丝体6.0 g/kg,3.0 g/kg,1.5 g/kg 剂量组及环磷酰胺组3批小鼠H22实体瘤生长均明显低于对照组(P<0.01或 P<0.05),平均抑制率分别为43.6% ,36% ,26% ,57.2% 。
表1 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用(±S)第1批♀Tab.1 Inhibitory effect of Phellinus myceliumr on H22 tumor-bearing mice( ± S)The first batch♀

表1 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用(±S)第1批♀Tab.1 Inhibitory effect of Phellinus myceliumr on H22 tumor-bearing mice( ± S)The first batch♀
注:与模型组比较:**P<0.01
组 别 动物(只)(始/末) 动物体重/g(始/末) 瘤重/g 抑制率/%模型组28.24 10/10 20.9±1.1/26.2±3.0 1.01±0.12 -CTX组 10/10 20.5±0.7/22.2±0.8** 0.43±0.17** 57.20大剂量组 10/10 20.8±1.0/24.2±2.7 0.56±0.14** 44.37中剂量组 10/10 20.4±0.5/24.8±3.7 0.65±0.13** 34.81小剂量组 10/10 20.7±1.2/24.8±2.1 0.71±0.10**
表2 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用(±S)第2批♂Tab.2 Inhibitory effect of Phellinus myceliumr on H22 tumor-bearing mice( ± S)The second batch♂

表2 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用(±S)第2批♂Tab.2 Inhibitory effect of Phellinus myceliumr on H22 tumor-bearing mice( ± S)The second batch♂
注:与模型组比较:**P<0.01
组 别 动物(只)(始/末) 动物体重/g(始/末) 瘤重/g 抑制率/%模型组 10/10 20.3±0.9/25.1±3.0 1.12±0.14—27.28 CTX组 10/10 19.8±0.8/23.3±0.9 0.37±0.09** 65.85大剂量组 10/10 20.0±0.8/25.4±3.2 0.66±0.22** 40.12中剂量组 10/10 20.0±0.9/26.9±2.5 0.70±0.12** 36.92小剂量组 10/10 20.0±0.7/26.1±2.2 0.81±0.14**
表3 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用±S)第3批♀Tab.3 Inhibitory effect of Phellinus myceliumr on H22 tumor-bearing mice(± S)The third batch♀
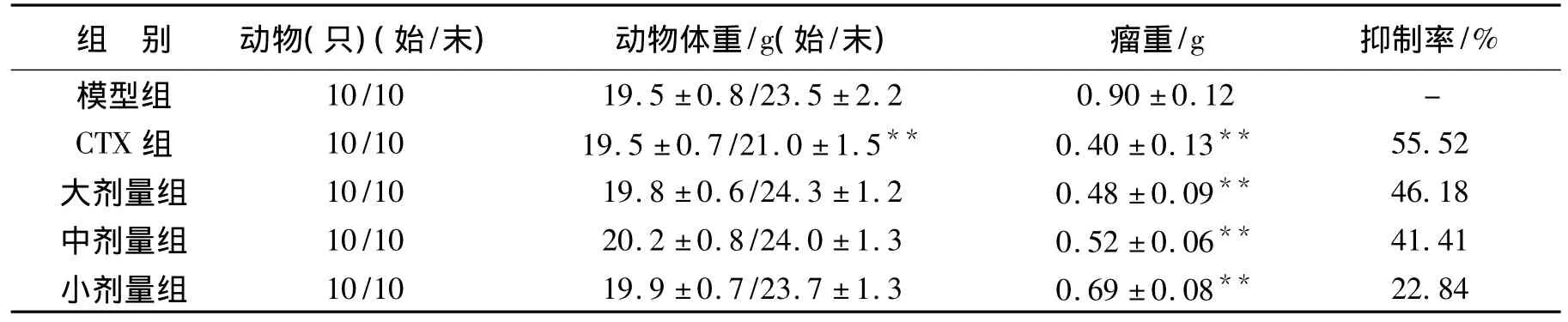
表3 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用±S)第3批♀Tab.3 Inhibitory effect of Phellinus myceliumr on H22 tumor-bearing mice(± S)The third batch♀
注:与模型组比较:**P<0.01
images/BZ_91_333_2875_2142_2950.png模型组22.84 10/10 19.5±0.8/23.5±2.2 0.90±0.12 -CTX组 10/10 19.5±0.7/21.0±1.5** 0.40±0.13** 55.52大剂量组 10/10 19.8±0.6/24.3±1.2 0.48±0.09** 46.18中剂量组 10/10 20.2±0.8/24.0±1.3 0.52±0.06** 41.41小剂量组 10/10 19.9±0.7/23.7±1.3 0.69±0.08**
表4 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用±S)(合计)Tab.4 Inhibitory effect of Phellinus myceliumr on H22tumor-bearing mice ± S)(Total)

表4 桑黄菌丝体对荷H22小鼠实体瘤的抑制作用±S)(合计)Tab.4 Inhibitory effect of Phellinus myceliumr on H22tumor-bearing mice ± S)(Total)
注:与模型组比较:** P<0.01,*P<0.05
组别 动物(只)(始/末) 动物体重/g(始/末) 瘤重/g 抑制率/%模型组26.12 30/30 20.2±1.1/24.9±2.9 1.01±0.15 -CTX组 30/30 19.9±0.8/22.2±1.4** 0.40±0.13** 59.52大剂量组 30/30 20.2±0.9/24.6±2.5 0.57±0.17** 43.56中剂量组 30/30 20.2±0.8/25.2±2.9 0.62±0.13** 37.71小剂量组 30/30 20.2±0.9/24.9±2.1 0.74±0.12**
3 结论
试验期间无小鼠死亡,模型组肿瘤生长良好,本品连续给小鼠灌胃给药,3批试验对荷H22小鼠实体瘤的平均抑瘤率达到30%以上,且重复性良好,说明桑黄菌丝体对小鼠H22实体瘤有明显的抑制作用。
[1] 张万国,胡晋红,蔡溱,等.桑黄抗犬鼠肝纤维化与抗脂质过氧化[J].中成药,2002,24(4):281.
[2] 卯晓岚.中国大型真菌[M].郑州:河南科技出版社,2000:465-468;477.
[3] 雷萍,孙悦迎,张文隽,等.野生桑黄菌种分离与培养特性研究初报[J].食用菌学报,2007,14(2):71-75.
[4] DAI Y C.Phellinus sensu lato(Aphyllophorales,Hymenochaetaceae)in East Asia[J].Acta Bot Fennici,1999,166:111-115.
[5] 宋力,孙培龙,郭杉杉,等.桑黄的研究进展[J].中国食用菌,2004,24(3):7-15.
[6] IKEKAWA T,NAKANISHI M,UEHARA N,et al.Antitumor action of some Basidiomycetes,especially Phllinus linteus[J].Gann,1968,59(2):155.
[7] SASAKI T,ARAI Y,IKEKAWA T,et al.Antitumor polysaccharides from some polyporaceae,Ganoderma applanatum(Pers.)Pat and Phellinus linteus(Berk.Et Curt)Aoshima[J].Chem.Pharm.Bull,1971,19(4):821-826.
[8] 傅海庆.桑黄多糖的研究进展[J].包装与食品机械,2008,26(5):32-36.
[9] 温克,陈劲,李红.桑黄等四种抗癌药物抗癌活性比较[J].吉林大学学报(医学版),2002,28(3):247-249.
[10]雷萍,吴亚召,张文隽,等.秦巴山区桑黄18SrDNA的序列与亲缘关系分析[J].西北大学学报(自然科学版),2012,42(4):620-622.
[11]雷萍,张文隽,吴亚召,等.秦巴山区野生桑黄人工驯化栽培技术研究初报[J].西北大学学报(自然科学版),2014,44(1):71-74.
