粒毛盘菌YM404黑色素发酵、纯化及其染色效果
2014-12-31郭赓艺殷坤才
郭赓艺, 蒋 科, 李 兰, 殷坤才, 叶 明
(1.合肥工业大学 生物与食品工程学院,安徽 合肥 230009;2.马鞍山市安康菌业有限公司,安徽 马鞍山 243000)
0 引 言
黑色素是通过多羟基酚氧化而成的构造不规则的类多酚聚合体[1],存在于动物、植物及微生物中,通常对温度、pH 值、光照等较稳定[2-3]。利用微生物发酵产黑色素,成本较低,易于工业化。目前人们提取黑色素常用的方法是碱提酸沉法,但难以获得黑色素的单一组分,对其进行结构解析比较困难[4]。研究表明,采用分级分离的方法可以获得黑色素均一性组分[5]。
目前市场上销售的染发剂多为氧化型染发剂,其主要原料对苯二胺及其衍生物具有一定的毒性、致敏性以及致癌性,长期使用可能导致癌症[6]。有学者以五倍子、黑芝麻、儿茶等原料制备染发剂,但其提取液对天然白发的染发效果较差[7]。因此,研究与开发天然染料的无毒染发剂具有重要的应用价值。
粒毛盘菌属为腐生性真菌,深层发酵后可产生黑色素,但得率较低[8]。目前关于粒毛盘菌黑色素均一性组分的报道并不多。本文对粒毛盘菌YM404产黑色素的发酵条件进行研究,经分级分离后获得其胞外黑色的均一性组分,对其染色效果进行了评价,为粒毛盘菌黑色素资源的开发利用提供科学依据。
1 材料与方法
1.1 菌株
粒毛盘菌Lachnum YM-404菌株,子实体采集自中国云南省,由合肥工业大学微生物资源与应用研究室分离保藏。
1.2 培养基
固 体 培 养 基:ρ(葡 萄 糖)=20g/L,ρ(酵母膏)=5g/L,ρ(蛋 白 胨 )= 5g/L,ρ(琼脂)=15g/L。
液体发酵基础培养基:ρ(葡萄糖)=20g/L,ρ(蛋白胨)=5g/L,V(蒸馏水)=1 000mL。
1.3 试剂与仪器
葡聚糖凝胶 Sephadex G-100,购自美国Pharmacia公司;海飞丝去屑洗发露,广州宝洁有限公司;其他试剂均为分析纯,购自合肥博美生物科技有限责任公司。
立式压力蒸汽灭菌锅,上海申安医疗器械厂;ZHWY-2102气浴摇床,苏州净化设备有限公司;冷冻干燥机,北京博医康实验仪器有限公司;752紫外可见分光光度计,上海菁华科技仪器有限公司;ACQUITY UPLC LUT液质联用仪,美国Waters公司。
1.4 黑色素发酵条件
用打孔器接种直径6mm、菌龄一致的YM404菌块于装有150mL液体发酵基础培养基的250mL三角瓶中,26℃、160r/min培养10d。发酵液抽滤2~3次,收集发酵液,在520nm处测定其吸光度值,吸光度值越高,表明黑色素产量越高。菌丝体在50℃下烘干并且测定生物量(即菌丝体干质量),生物量越大,表明YM404生长速度越快。以吸光度值和生物量为指标,考察不同碳源(葡萄糖、麦芽糖、可溶性淀粉)、氮源(蛋白胨、胰蛋白胨、酵母浸膏)以及不同浓度L-DOPA、谷胱甘肽对YM404生长及产黑色素的影响,确定最佳发酵条件[8]。
1.5 分级分离
[9]的方法,获得粒毛盘菌 YM404黑色素(LEM404)。参考文献[7]的方法,采用葡聚糖G-100凝胶柱,以0.5%NaCO3为洗脱液,LEM404的质量浓度为20mg/mL,进样量为1mL,控制流速为300μL/min,每管收集5mL,柱温保持20℃。收集洗脱液于520nm下测定吸光度值,绘制其洗脱曲线。收集主要组分经减压浓缩后,于截留分子量为200Da的透析袋中透析48h,冷冻干燥后获得LEM404的均一组分。
1.6 质谱分析
采用质谱联用仪对LEM 404均一组分(LEM404-a)进行质谱分析。分析条件[10]:电喷雾离子源,离子源温度为110℃;扫描方式为正离子V模式;质核比的扫描范围为100~1 000;毛细管电压为2 400kV;去溶剂温度为350℃;去溶剂气流量为600L/h;锥孔电压为60V;锥孔气流量为40L/h。
1.7 染色效果
参考文献[11]的方法配制染发剂(A剂、B剂),其中配方I、Ⅱ、Ⅲ、Ⅳ以及Ⅴ的A剂水相中的LEM 404-a和对苯二胺的添加量见表1所列,其他成分与文献[11]一致;配方Ⅵ只添加0.8%LEM 404-a。取同一人的白发分别浸入各配方的染发剂中,于35℃恒温箱保温30min,观察染色结果。然后将染色后的头发浸入洗发剂(2mL洗发露与50mL蒸馏水混合)中自然保温24h,观察其是否褪色[2]。
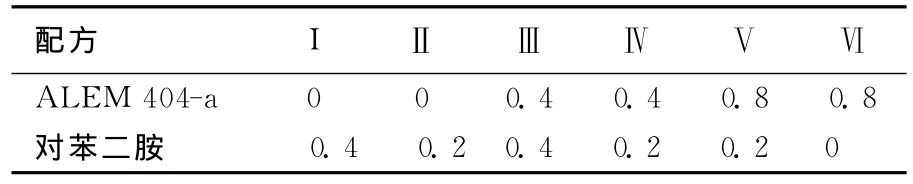
表1 各配方中LEM 404-a和对苯二胺的质量分数 %
2 结果与讨论
2.1 YM404黑色素发酵条件研究
2.1.1 碳源对生物量及黑色素产量的影响
以麦芽糖作为碳源时,YM404菌株发酵液520nm处的吸光度值与生物量均最高,如图1a所示,表明麦芽糖为YM404菌株生长及产黑色素的最适碳源。随着麦芽糖质量浓度的上升,发酵液吸光度值与生物量均呈上升趋势,如图1b所示,当麦芽糖质量分数高于25g/L时,两者均趋于稳定,选取麦芽糖最佳质量浓度为25g/L。

图1 碳源和麦芽糖对YM404生物量及黑色素产量的影响
2.1.2 氮源对生物量及黑色素产量的影响
氮源对YM404菌株生物量及黑色素产量的影响如图2所示。
从图2可看出,以酵母膏作为氮源时,发酵液在520nm处吸光度值最高。而以蛋白胨作为氮源时YM404菌株生物量达最大,但吸光度值较低。由于实验的主要目的在于提高黑色素的得率,因此以吸光度值为主要指标,选择酵母膏作为最适氮源。随着酵母膏质量浓度上升,发酵液吸光度值与生物量均呈上升趋势,当酵母膏的质量浓度高于6g/L时,两者均趋于稳定,选取酵母膏最佳质量浓度为6g/L。
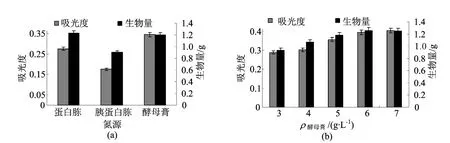
图2 氮源及酵母膏对YM404菌株生物量及黑色素产量的影响
2.1.3 L-DOPA与谷胱甘肽对YM404的影响
研究表明,二羟基苯丙氨酸(DOPA)和谷胱甘肽为黑色素合成途径的中间产物[12],在发酵液中添加L-DOPA与谷胱甘肽,可能对YM404黑色素产量有一定影响,如图3所示。
从图3a可以看出,不添加L-DOPA的空白对照组的吸光度值为0.327,生物量为0.927g。随着L-DOPA浓度的增加,发酵液的吸光度与生物量均呈先上升后下降趋势,当L-DOPA的浓度为1.25mmol/L时,发酵液吸光度值达到最大,为0.557,当浓度为0.75mmol/L时,生物量最大,为1.231g。这表明添加适量的L-DOPA有益于YM404菌株生长及黑色素的积累,过量时则起抑制作用。

图3 L-DOPA与谷胱甘肽浓度对YM404生物量及黑色素产量的影响
由图3b可看出,不添加谷胱甘肽的空白对照组的吸光度为0.351,生物量为0.827g。随着谷胱甘肽浓度的增加,YM404发酵液吸光度值与生物量均呈先上升后下降趋势,当浓度为0.75mmol/L时,吸光度和生物量都达到最大。当谷胱甘肽浓度继续增大时,吸光度值与生物量下降,表明过量添加谷胱甘肽会抑制YM404菌株生长及黑色素积累。与L-DOPA对YM404菌株生长及产黑色素的影响相比,添加谷胱甘肽对其影响较不显著,因此选择在培养基中添加1.25mmol/L L-DOPA。
综上所述,确定LEM404的最佳发酵条件如下:麦芽糖质量浓度为30g/L,酵母膏质量浓度为 6g/L,L-DOPA 浓 度 为 1.25mmol/L,160r/min,26℃恒温振荡培养10d。采用上述条件发酵粒毛盘菌YM404,可得LEM404的得率为3.45g/L。
2.2 LEM404的分级分离
LEM404经葡聚糖G-100凝胶柱洗脱,在第1~20管内出现1个吸收峰,如图4所示,收集前20管洗脱液,经透析、冷冻干燥后得均一性黑色素LEM404-a,其占LEM404总量的43.7%。
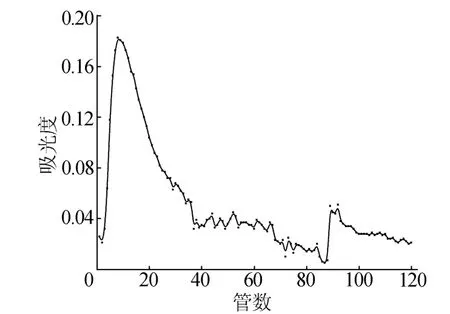
图4 LEM404葡聚糖凝胶洗脱曲线
2.3 LEM404-a的质谱分析
LEM404-a质谱如图5所示,图5中,[M]+、[M+H]+的准分子离子峰的质核比分别为432.18和433.18,可确定LEM404-a的分子量为432.18。
图5 LEM404-a质谱图
2.4 LEM404的染色效果
各配方染发剂的染色效果见表2所列。表2表明,添加LEM404-a有助于提高染发剂的染色效果,并可减少对苯二胺的使用量;当保持对苯二胺的质量分数不变时,增加LEM404-a的量,可获得最佳染色效果;而仅以LEM404-a溶液作为染发剂几乎不着色,这是由于天然黑色素较难渗透到皮层,导致其牢固度不理想,因此需少量添加对苯二胺作为渗透剂辅助染色[6]。
本研究配方Ⅴ中对苯二胺的质量分数仅为0.2%,远低于行业标准(<6%),也低于市场上现有的天然染发剂中对苯二胺的平均质量分数(约为1%)[13],表明以LEM404-a为原料制备的配方Ⅴ染发剂具有染色效果好且毒性低的优点。
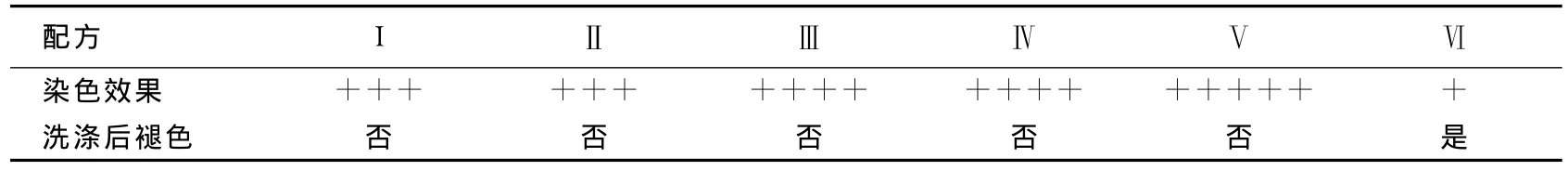
表2 LEM404-a的染色效果
3 结 论
粒毛盘菌YM404产胞外黑色素的发酵条件为:ρ(麦芽糖)=30g/L,ρ(酵母膏)=6g/L,c(L-DOPA)=1.25mmol/L,得率为3.45g/L;LEM404经分级分离后,获得均一性黑色素LEM404-a,其占LEM404总量的43.7%,相对分子质量为432.18,表明葡聚糖凝胶柱分级分离的方法可获得黑色素均一性组分;LEM404-a本身染色效果差,但以其为原料,添加少量对苯二胺(0.2%)制备的染发剂染色效果好且毒性低,是一种安全有效的染发剂,具有广阔的市场应用前景。
[参考文献]
[1] Latocha M,Chodurek E,Kurkiewicz S,et al.Pyrolytic GCMS analysis of melanin from black,gray and yellow strains ofDrosophilamelanogaster[J].Journal of Analytical and Applied Pyrolysis,2000,56:89-98.
[2] Ye M,Wang Y,Qian M S,et al.Preparation and properties of the melanin fromLachnumsingerianum[J].International Journal of Basic and Applied Sciences,2011,11(3):51-58.
[3] Dong C,Yao Y.Isolation,characterization of melanin derived fromOphiocordycepssinensis,an entomogenous fungus endemic to the Tibetan Plateau[J].Journal of Bioscience and Bioengineering,2012,113:474-479.
[4] Pratibha J,Pranali B,Solimabi W,et al.The fungusGliocephalotrichumsimplexas a source of abundant,extracellular melanin for biotechnological applications[J].World Journal of Microbiology and Biotechnology,2012,28:505-512.
[5] Olennikov D N,Agafonova S V,Stolbikova A V,et al.Melanin ofLaetiporussulphureus(Bull.Fr.)Murr sterile form[J].Applied Biochemistry and Microbiology,2011,47:298-303.
[6] 王 璐,陈渭川,刘小焕,等.天然植物染发剂研究现状[J].衡阳师范学院学报,2009,30(6):85-88.
[7] 王奎堂,陈锦仪.用儿茶及其他中药制备无毒不致癌染发剂[J].香料香精化妆品,2012,13(1):47-49.
[8] 叶 明,许庆平,陈 晓,等.LachnumYM-223产黑色素发酵及其黑色素抗氧化活性研究[J].食品科学,2009,30(17):185-189.
[9] Ye M,Chen X,Li G W,et al.Structural characteristics of pheomelanin-like pigment fromLachnumsingerianum[J].Advanced Materials Research, 2011, 284/285/286:1742-1745.
[10] Ye M,Wang Y,Guo G Y,et al.Physicochemical characteristics and antioxidant activity of arginine-modified melanin fromLachnumYM-346[J].Food Chemistry,2012,135:2490-2497.
[11] 叶 明,汪 燕,王于顺.一种粒毛盘菌黑色素染发剂及其制备方法:中国,201110094762[P].2012-09-26.
[12] Magdalena Z,Ewa C,Barbara P.EPR studies of DOPA-melanin complexes with Fe(Ⅲ)[J].Applied Magnetic Resonance,2011,40:113-123.
[13] 肖 怀,崔胜男,白志英,等.天然染发剂中对苯二胺定量分析[J].大理学院学报,2011,10(6):1-3.
