基于大体积循环进样的低丰度蛋白质富集
2014-12-26张权青高小迪张维冰张庆合
张权青, 张 磊, 高小迪, 张维冰, 张庆合*
(1. 中国计量科学研究院,北京100029;2. 华东理工大学,上海市功能性材料化学重点实验室,上海200237)
生物蛋白质在大小、相对丰度、酸碱度和疏水性等方面具有很大的差异。就相对含量而言,血液中的高丰度与低丰度蛋白质含量甚至相差达11 个数量级,这也导致一些低丰度蛋白质很难被分析检测和研究。对生物功能产生重要影响的修饰蛋白质、与重大疾病相关的蛋白质在体液或组织中的含量通常很低,也使对低丰度蛋白质检测方法的研究成为生物分析领域的一个重要研究课题。
对蛋白质样品中低丰度组分的检测通常需采用预富集的方法,通过提高其相对含量来有效地提高检测灵敏度和检测精度。常用的蛋白质富集技术主要有固相金属离子亲和色谱法(IMAC)[1-3]、分子印迹技术[4]、亲和色谱技术[5]、特殊选择性材料富集[6,7]、循环进样[8,9]等。固相金属离子亲和色谱法[10]是最常用的蛋白质富集方法之一,钱小红等[11]利用二氧化钛对腾冲嗜热厌氧菌磷酸化蛋白质进行富集研究,鉴定到25 个磷酸化蛋白质;梁鑫淼等[12]利用氧化铝进行糖肽的选择性富集,从辣根过氧化物酶解液中获得16 个糖肽,从IgG 酶解液中获得12 个糖肽。通过蛋白质印迹聚合物材料去除样品中的高含量蛋白质,可以有效避免其对低丰度蛋白质检测的影响,能够将中低含量蛋白质的鉴定数量提高20%以上[13]。
循环进样方式可以有效提高色谱分析的绝对上样量。Lv 等[8]采用循环进样结合超高效液相色谱(UPLC)-四极杆飞行时间质谱对白花前胡中的6种同分异构体进行了分离和鉴定。杜敏等[9]发展了一种基于微流控芯片的生物样品循环给样富集方法,大大提高了信号强度,降低了检出限。本文发展了一种大体积循环进样的方法,通过增加进样量与进样次数提高蛋白质样品的富集效率。
1 实验部分
1.1 仪器与试剂
依利特P1201 系列高效液相色谱系统(配UV1201 紫外-可见波长检测器,大连依利特分析仪器有限公司);超纯水仪(德国Sartorius 公司);Heal Force Neofage 1600R 高速离心机(力康生物医疗科技控股有限公司)。
甲醇、乙腈(色谱纯,天津科密欧化学试剂有限公司);乙酸(色谱纯)、乙酸铵(分析纯)(上海凌峰化学试剂有限公司);三氟乙酸(色谱纯,上海晶纯试剂有限公司);液氮(普通氮气,上海松闵气体技术有限公司)。
1.2 猪肝蛋白质的提取
[14]的蛋白质提取方法,取新鲜猪肝10 g,搅拌碾磨成泥浆,加入10 倍体积的5% (v/v)乙酸溶液,在4 ℃下搅拌过夜;在室温下以10 000 g离心30 min 后取上清液;沉淀中加入等体积乙酸混合,相同条件下离心,合并上清液,得猪肝蛋白质样品。猪肝蛋白质样品用流动相溶解后过0.45 μm油膜后备用。
1.3 实验条件
色谱柱:SinoChrom ODS-BP 色谱柱(250 mm×4.6 mm,5 μm,大连依利特分析仪器公司);流动相:A 为0.1%三氟乙酸(TFA)水溶液,B 为0.1%TFA 乙腈溶液。线性洗脱程序:0 ~10 min,5% B ~40% B;10 ~13 min,40%B ~100%B;13 ~20 min,100% B。流速:1.0 mL/min;检测波长:210 nm;柱温:室温。
2 结果与讨论
2.1 猪肝蛋白质分离条件的优化
210 nm 和280 nm 为生物蛋白质样品通常的检测波长。在相同分离条件下,210 nm 时的色谱峰信号响应明显强于280 nm,因此选择210 nm 作为检测波长进行实验。
流动相的种类与梯度条件对样品的分离有着重要的影响。以SinoChrom ODS-BP 色谱柱进行反相液相色谱分离流动相条件优化,在最佳色谱分离条件(见1.3 节)下得到图1 所示的分离结果。
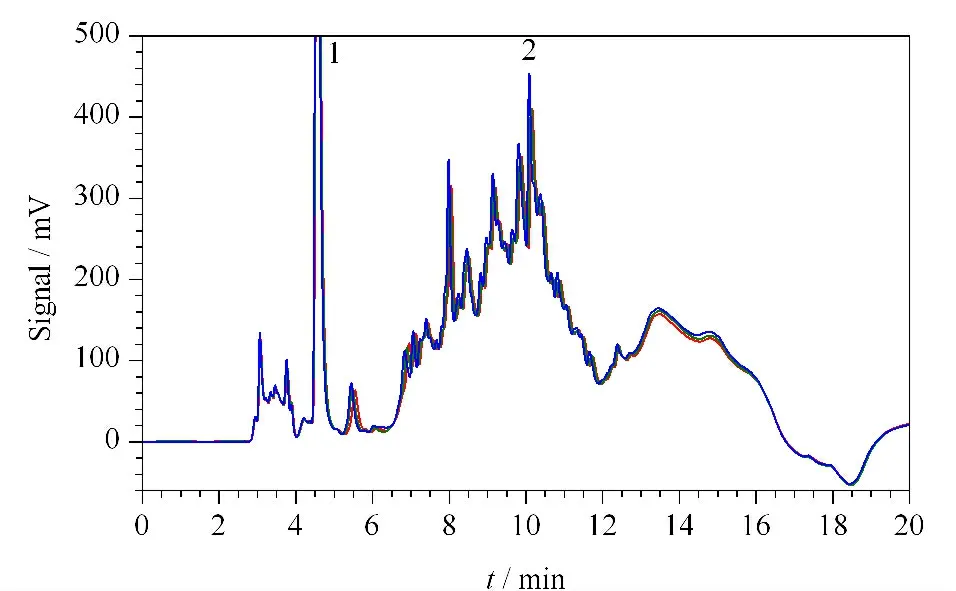
Fig.1 猪肝蛋白质的反相液相色谱分离谱图Fig.1 Chromatogram of pork liver separated by RPLC
2.2 进样的重复性
在大体积循环进样中,通过增加进样次数来增加样品的绝对进样量。根据色谱基本原理,在线性色谱条件下,同一物质在同样的色谱分离条件下保留时间不变,因此在多次色谱实验中对相同保留时间段进行收集,得到的馏分应包含相同的组分。进样重复性的好坏,直接影响到组分收集的一致性。
通过3 次重复进样,每次25 μL,考察在优化的色谱分离条件下猪肝蛋白质分离的重复性。图1 中峰1(4.57 min)和峰2(9.88 min)峰高的RSD(n =3)分别为5.9%和5.5%,表明系统及所发展的方法具有良好的进样重复性。
2.3 低丰度组分的选择与富集效率的评价
根据RPLC 的洗脱原理,不同极性组分主要依靠疏水性进行分离。相对而言,在0 ~10 min 对应的是强极性流动相,其收集的馏分为弱保留组分;在10 ~13 min 对应的流动相极性逐渐减弱,将其收集的馏分定义为中等极性组分。根据色谱峰的信号强弱,选取保留时间为7 ~9 min、11 ~13 min 的中等极性组分及17 ~19 min 的较强保留组分作为研究对象评价方法。保留时间为9 ~11 min 时,色谱峰的信号较强,经过循环进样富集后信号饱和,因此未选取此组分段进行研究。
采用大体积循环进样的方式,进样11 次,每次上样量500 μL。依次收集选择的保留时间段的组分,并将其分别合并后,氮气吹干,用流动相B 溶解定容,再次进行色谱分离。
图2 中比较了经过循环富集后17 ~19 min 的中等极性组分与原始图谱的差别。图3 和图4 中分别比较了7 ~9 min、11 ~13 min 的中等极性组分与原始谱图的差别。
从图2 ~图4 可以看出,采用循环富集的方法可以将不同时间段馏分有效去除,而其他富集目标组分的含量得到有效提高。显然,这种方法可同时用于高丰度蛋白质的去除以及低丰度蛋白质的富集。
在理想情况下,对于所收集到的馏分,其中每一种组分的绝对量为进样次数与进样体积以及其在原始样品中浓度的乘积。对于17 ~19 min 馏分中的每一种组分而言,其在富集后再次溶解的50 μL 样品中的浓度的理论值应为其在原始样品中浓度的110 倍。17 ~19 min 时间段的组分中,富集前因浓度太低谱图中未出现色谱峰;经过大体积的循环进样后,出现了新的色谱峰,其对应的保留时间为18.07、18.29 和19.15 min。

Fig.2 猪肝蛋白质17 ~19 min 组分富集(a)前、(b)后的色谱图Fig.2 Chromatograms of 17-19 min fraction of pork liver proteins (a)before and(b)after enrichment

Fig.3 猪肝蛋白质11 ~13 min 组分富集(a)前、(b)后的色谱图Fig.3 Chromatograms of 11-13 min fraction of pork liver proteins (a)before and (b)after enrichment
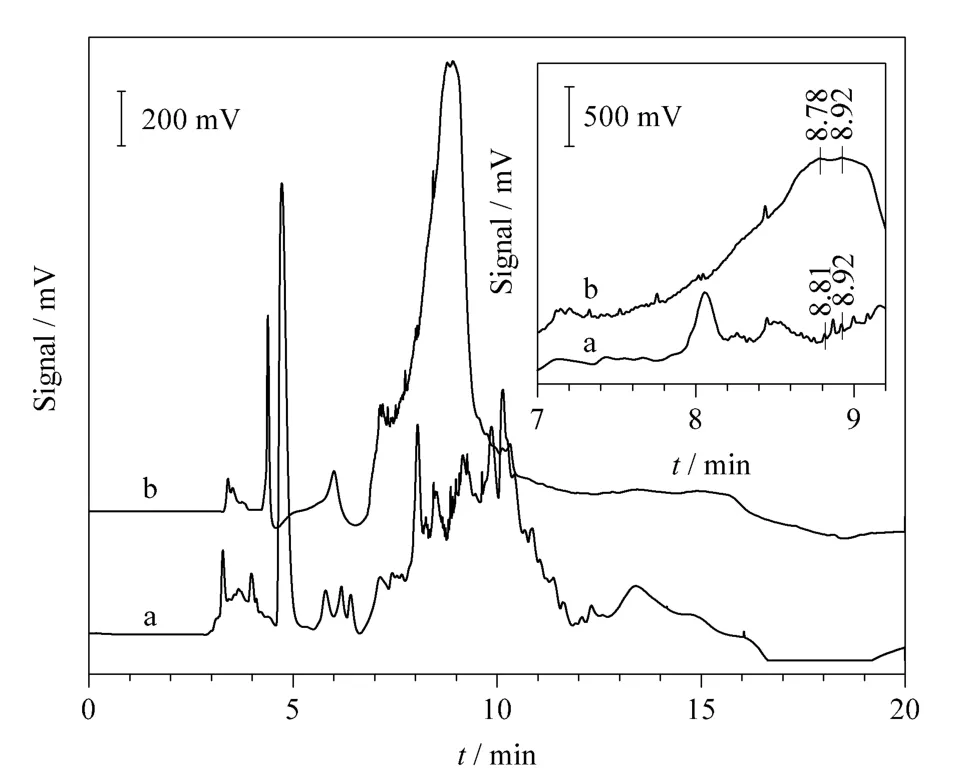
Fig.4 猪肝蛋白质7 ~9 min 组分富集(a)前、(b)后的色谱图Fig.4 Chromatograms of 7-9 min fraction of pork liver proteins (a)before and (b)after enrichment
对于11 ~13 min 的馏分以及7 ~9 min 的馏分,用流动相B 溶解至100 μL,其理论富集倍数皆为55,选择在富集前只有微弱信号的8.81、8.92、11.38 与12.58 min 组分进行研究,结果见表1。可以看出,试验与理论富集倍数相近,说明所发展的方法具有很好的稳定性和重复性。
对于不同的色谱峰,实际富集倍数有一些差别。可能是因为原始色谱图中组分丰度很低,定量结果误差较大,使得富集倍数的计算产生较大偏差,但这一现象并不影响所发展方法的实用性。

表1 不同色谱峰的富集效果Table 1 Enrichment results of different chromatographic peaks
3 结论
本文发展了一种大体积循环进样的蛋白质样品富集分离处理方法,也可用于去除高丰度蛋白质对低丰度蛋白质检测的干扰。通过增加蛋白质样品的上样体积,提高低丰度蛋白质的绝对含量;进一步采用增加样品进样循环次数的方法,提高蛋白质的富集效率。实验与理论富集效率相近。所发展的方法为生物蛋白质样品研究提供了一种新的富集制备及检测方法。
参考文献:
[1] Andersson L,Porath J. Anal Biochem,1986,154(1):250
[2] Zarei M,Sprenger A,Metzger F. J Proteome Res,2011,10(8):3474
[3] Wang S T,Wang M Y,Su X,et al. Anal Chem,2012,84(18):7763
[4] Yang K G,Zhang L H,Liang Z,et al. Anal Bioanal Chem,2012,403(8):2173
[5] Zhang X Q,Jiang Y,Li Y M,et al. Chinese Journal of Laboratory Medicine (张雪群,姜颖,厉有名,等. 中华检验医学杂志),2006,29(10):947
[6] Liu Q,Shi J B,Cheng M T,et al. Chem Commun,2012,48(13):1874
[7] Ye M L. Chinese Journal of Chromatography (叶明亮. 色谱),2013,31(1):1
[8] Lv H W,Luo J G,Wang X B,et al. Chromatographia,2013,76(3/4):141
[9] Du M,Ye X Y,Zhou Z Y,et al. Chinese Journal of Analytical Chemistry (杜敏,叶雄英,周兆英,等. 分析化学),2012,40(11):1668
[10] Bai Z F,Wang H X. Chinese Journal of Analytical Chemistry(柏兆方,王红霞. 分析化学),2009,37(9):1382
[11] Lin W,Wang J L,Qian X H,et al. Chinese Journal of Chromatography (林威,王京兰,钱小红,等. 色谱),2012,30(8):763
[12] Zhao X,Jiang W H,Liang X M,et al. Acta Chimica Sinica(赵旭,姜武辉,梁鑫淼,等. 化学学报),2013,71(3):343
[13] Liu J X,Deng Q L,Yang K G,et al. J Sep Sci,2010,33(17/18):2757
[14] Huang P. [Master Dissertation]. Changsha:Central South University of Forestry and Technology (黄平. [硕士学位论文].长沙:中南林业科技大学),2009
