miR-222下调高糖下小鼠系膜细胞TIMP3表达
2014-12-26南华大学附属第一医院内分泌科湖南衡阳421001
,, (南华大学附属第一医院内分泌科,湖南 衡阳 421001)
miR-222下调高糖下小鼠系膜细胞TIMP3表达
刘应兰,曹仁贤,杨靖
(南华大学附属第一医院内分泌科,湖南 衡阳 421001)
目的探讨miR-222是否通过靶向调控TIMP3表达参与糖尿病肾病的发生过程,从而进一步揭示糖尿病肾病的发病机制。方法运用qRT-PCR检测经25 mmol/L葡萄糖处理的小鼠系膜细胞(HG组)和对照小鼠系膜细胞(5 mmol/L葡萄糖,NG组)中miR-222和TIMP3的表达;将miR-222 mimics转染小鼠系膜细胞,以TIMP3 siRNA为阳性对照,采用Western blot检测其对TIMP3蛋白表达水平的影响。结果qRT-PCR检测结果显示,miR-222在经高糖处理的小鼠系膜细胞中的表达相对比正常浓度糖处理的小鼠系膜细胞中明显上调,而TIMP3在经高糖处理的小鼠系膜细胞中mRNA的表达相对比正常浓度糖处理的小鼠系膜细胞中明显下调;Western blot结果显示,过表达miR-222或干扰TIMP3可抑制TIMP3蛋白的表达(P<0.05)。结论miR-222可能通过调控TIMP3的表达参与糖尿病肾病的发生发展。
miRNA-222; 糖尿病肾病; 金属蛋白酶组织抑制因子3
miRNAs是一类高度保守的非编码小RNA分子,能与靶基因3′非编码区特异性结合,在转录后水平调控基因的表达,从而导致靶mRNA降解和翻译阻遏[1]。miRNAs大约调控人类三分之一的蛋白编码基因的表达。miRNAs调控很多重要的生物学过程,包括发育、细胞增殖和凋亡、细胞分化、代谢等[2],并且在很多疾病中表达异常,包括糖尿病。金属蛋白酶组织抑制因子3(TIMP3)是TIMPs家族成员之一。研究表明,TIMP3多态性与I型糖尿病肾病的发病明显相关[3],并且TIMP3在人糖尿病肾小球中差异表达[4]。研究表明,miR-222通过调控TIMP3参与胃癌的发生发展[5]。在高糖环境下,TIMP3在患糖尿病肾病的人和小鼠的肾脏中表达下调[6]。本研究拟通过采用qRT-PCR、荧光素酶报告系统以及Western blot检测miR-222是否通过靶向TIMP3参与糖尿病肾病的发生发展,为进一步阐明糖尿病肾病的发病机制提供实验依据。
1 材料与方法
1.1 细胞处理
SV40 MES 13细胞系小鼠系膜细胞株,由中山大学附属肿瘤医学研究所惠增。SV40 MES 13细胞用低糖DMEM培养基培养。消化细胞接种于6孔板中,分别用25 mmol/L葡萄糖(HG组)和5 mmol/L葡萄糖(NG组)处理SV40 MES 13细胞48 h。
1.2 主要材料
DMEM培养液购自invitrogen公司;miR-222 mimics与 scramble购自Exiqon公司;TIMP3 siRNA质粒购自santa cruz公司;TIMP3抗体和β-actin抗体购自CST公司;Trizol和Lipofectamine 2000转染试剂购自美国Invitrogen公司;用于qRT-PCR的引物由invitrogen公司合成;qRT-PCR miRNA和mRNA Detection Kit购自广州锐博生物技术公司。
1.3 qRT-PCR
采用Trizol法抽提细胞总RNA,逆转录合成cDNA。PCR扩增反应为20 μL体系,包括Taq DNA polymerase 5U/μL 0.2 μL,2×SYBR Mix 10 μL,miRNA RT product 2.0 μL,MiR-PCR primers(5 mmol/L)0.4 μL,灭菌蒸馏水7.4 μL。循环体系为:95°C 3 min,95°C 12 s,62°C 35 s,72°C 30 s,共40个循环。以β-actin为内参,所测定的mRNA的相对表达量采用2-ΔΔCT法分析。
1.4 Western blot
为了明确miR-222对TIMP3的蛋白质表达的调控,运用将Western blot检测外源表达miR-222对TIMP3蛋白表达水平的改变。将miR-222 mimics转染SV40 MES 13细胞,以转染miR-222-scramble为阴性对照,转染TIMP3 siRNA为阳性对照,转染48 h后收集蛋白,并进行蛋白浓度测定。各组取等量样本,进行SDS-PAGE凝胶电泳后将蛋白转移至PVDF膜上,5%脱脂牛奶封闭,加入TIMP3抗体或β-actin抗体,4 ℃过夜。TBST洗膜,加入二抗,室温孵育1 h,TBST洗膜,然后加ECL发光剂,X片曝光、显影、定影。
1.5 统计学处理
2 结 果
2.1 SV40 MES 13小鼠系膜细胞中miR-222和TIMP3表达水平的检测
qRT-PCR结果显示,miR-222在高糖环境下SV40 MES 13细胞中的表达(2-△△CT)为4.173±0.072,在低糖环境下的SV40 MES 13细胞中的表达(2-△△CT)为0.528±0.132,NG组明显低于HG组(P<0.05);TIMP3在高糖环境下SV40 MES 13细胞中的表达为0.237±0.246,在低糖环境下的SV40 MES 13细胞中的表达为1.216±0.163,NG组明显高于HG组(P<0.05)。
2.2 miR-222对TIMP3蛋白表达的影响
Western blot检测结果显示,转染miR-222组TIMP3和TIMP3 siRNA组蛋白表达水平较阴性对照组明显降低,提示,在SV40 MES 13小鼠系膜细胞中miR-222能下调TIMP3蛋白的表达(图1)。
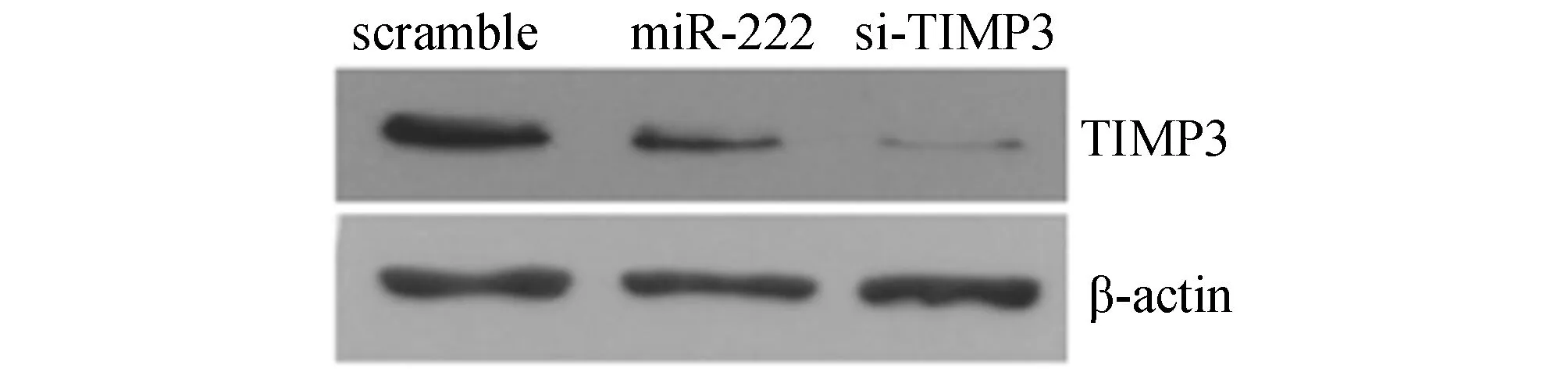
图1 Western blot检测外源表达miR-222对TIMP3蛋白表达的影响
3 讨 论
糖尿病肾病(DN)是慢性肾脏疾病的主要病因之一,在很大程度上促使了糖尿病患者的死亡率。从形态学上,糖尿病肾病主是以肾小管-间质纤维化,肾小球基底膜增厚,系膜外基质增生,从而导致纤维化,其主要原因是细胞外基质(ECM)的积聚所致。而细胞外基质的稳态主要受基质金属蛋白酶(MMPs)和金属蛋白酶组织抑制因子(TIMPs)两者之间的平衡所调控。TIMP3在肾脏中大多高表达,在小鼠中TIMP3表达缺失与炎症、肾脏纤维化和肾小管间质损伤相关[7-8]。TIMP3也是调节组织微环境包括控制炎症和纤维化的关键因子[8-9]。众所周知,炎症在糖尿病肾病的发病机理中起主导作用[10],在人类或小鼠模型研究表明,TIMP3表达下调与糖尿病并发症和代谢炎症明显相关[11-12]。
TIMPs和MMPs之间的动态生理平衡决定细胞外基质(ECM)和组织微环境的稳态。研究显示,TIMP3是TIMPs家族中在肾脏中表达最高的一种[8],TIMP3在小鼠中表达缺失,表现出对心肌病[13]和肾质性肾炎和纤维化[8]的敏感性增高。研究表明,TIMP3表达缺失能加重糖尿病的肾脏损害,主要表现为肾脏的重量增加,肾小球系膜基质增厚,尿蛋白排泄增加,而这些都是糖尿病肾病的早期特征[14]。TIMP3是MMP2活性的重要抑制因子[8,15],在Akita糖尿病的小鼠肾脏中TIMP3表达缺失能导致MMP2的活性增强。
本研究通过qPT-PCR检测发现,miR-222在高糖环境中的小鼠系膜细胞中表达上调,而TIMP3在高糖环境中的小鼠系膜细胞中表达下调。研究已证实TIMP3是miR-222直接调控的靶基因[16],本实验还通过蛋白质印迹试验证实了在小鼠系膜细胞中高表达miR-222能下调TIMP3蛋白的表达,表明TIMP3表达下调可能部分是由于miR-222表达上调所致。综上所述,本研究通过证实miRNA-222在转录后调控TIMP3的表达,从而参与糖尿病肾病的发生发展,为糖尿病肾病发展的可能分子机制提供了新的观点,也为其治疗提供了新的治疗靶点。
[1] Tang H,Deng M,Tang Y,et al.miR-200b and miR-200c as prognostic factors and mediators of gastric cancer cell progression[J].Clin Cancer Res,2013,19(20):5602-5612.
[2] Tang H,Kong Y,Guo J,et al.Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22 [J].Cancer Lett,2013,340(1):72-81.
[3] Ewens KG,George RA,Sharma K,et al.Assessment of 115 candidate genes for diabetic nephropathy by transmission/disequilibrium test[J].Diabetes,2005,54(11):3305-3018.
[4] Woroniecka KI,Park AS,Mohtat D,et al.Transcriptome analysis of human diabetic kidney disease[J].Diabetes,2011,60(9):2354-2369.
[5] 唐海林,苏坚,邓敏,等.胃癌组织中miR-222与TIMP3的表达及临床意义[J].中国肿瘤临床,2012,39(4):194-197.
[6] Fiorentino L,Cavalera M,Menini S,et al.Loss of TIMP3 underlies diabetic nephropathy via FoxO1/STAT1 interplay[J].EMBO Mol Med,2013,5(3):441-455.
[7] Basu R,Lee J,Wang Z,et al.Loss of TIMP3 selectively exacerbates diabetic nephropathy[J].Am J Physiol Renal Physiol,2012,303(9):F1341-1352.
[8] Kassiri Z,Oudit GY,Kandalam V,et al.Loss of TIMP3 enhances interstitial nephritis and fibrosis[J].J Am Soc Nephrol,2009,20(6):1223-1235.
[9] Kassiri Z,Defamie V,Hariri M,et al.Simultaneous transforming growth factor beta-tumor necrosis factor activation and cross-talk cause aberrant remodeling response and myocardial fibrosis in Timp3-deficient heart[J].J Biol Chem,2009,284(43):29893-29904.
[10] Navarro-Gonzalez JF,Mora-Fernandez C.The role of inflammatory cytokines in diabetic nephropathy[J].J Am Soc Nephrol,2008,19(3):433-442.
[11] Federici M,Hribal ML,Menghini R,et al.Timp3 deficiency in insulin receptor-haploinsufficient mice promotes diabetes and vascular inflammation via increased TNF-alpha[J].J Clin Investig,2005,115(12):3494-3505.
[12] Casagrande V,Menghini R,Menini S,et al.Overexpression of tissue inhibitor of metalloproteinase 3 in macrophages reduces atherosclerosis in low-density lipoprotein receptor knockout mice[J].Arterioscler Thromb Vasc Biol,2012,32(1):74-81.
[13] Kassiri Z,Oudit GY,Sanchez O,et al.Combination of tumor necrosis factor-alpha ablation and matrix metalloproteinase inhibition prevents heart failure after pressure overload in tissue inhibitor of metalloproteinase-3 knock-out mice[J].Circ Res,2005,97(4):380-390.
[14] Cardellini M,Menghini R,Martelli E,et al.TIMP3 is reduced in atherosclerotic plaques from subjects with type 2 diabetes and increased by SirT1[J].Diabetes,2009,58(10):2396-23401.
[15] Moore L,Fan D,Basu R,et al.Tissue inhibitor of metalloproteinases (TIMPs) in heart failure[J].Heart Fail Rev,2012,17(4-5):693-706.
[16] Zhang C,Zhang J,Hao J,et al.High level of miR-221/222 confers increased cell invasion and poor prognosis in glioma[J].J Transl Med,2012,10:119.
miR-222DownregulatestheExpressionofTIMP3inMouseHighGlucoseMesangialCells
LIU Yinglan,CAO Renxian,YANG Jing
(DepartmentofEndocrinology,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo explicit whether miR-222 involved in diabetic nephropathy progression by targeting TIMP3,thus to reveal molecular mechanism of diabetic nephropathy.MethodsA qRT-PCR was conducted for detect the expression of miR-222 and TIMP3 mRNA in high glucose condition (25 mmol/L glucose) and normal glucose condition (5 mmol/L glucose)in SV40 MES 13 mouse mesangial cells.SV40 MES 13 mouse mesangial cells were transfected with miR-222 mimics,and TIMP3 siRNA as for positivecontrol,Western blot was performed to detect the expressions of TIMP3 protein.ResultsqRT-PCR showed that miR-222 was up-regulated in high glucose condition,however,the mRNA of TIMP3 was down-regulated in high glucose condition.Western blot showed that the expressions of TIMP3 protein was inhibited by transfected with miR-222 or siR TIMP3 in SV40 MES 13 mouse mesangial cells.ConclusionmiR-222 may involvedin diabetic nephropathy progression by regulating TIMP3.
miR-222; diabetic nephropathy; TIMP3
2095-1116(2014)05-0452-03
2014-03-26
刘应兰,硕士,副主任医师,研究方向:糖尿病的发病机理,E-mail:42066645@qq.com.
R587.1
A
(此文编辑:朱雯霞)
