川穹嗪联合胚胎干细胞治疗大鼠肺纤维化的机制研究*
2014-12-25陕西省人民医院西院二病区西安710068刘延梅马少君
陕西省人民医院西院二病区 (西安710068) 刘延梅 马少君 苗 青 尙 亮
肺纤维化是多种原因引起的慢性肺间质疾病共同的病理变化,是肺组织对损伤的一种动态的病理修复过程,其病理特点为肺泡上皮细胞损伤,引起细胞外基质过度沉积,最终导致肺组织异常结构重塑[1]。但是其具体的发病机制尚未完全阐明,临床上缺乏有效的治疗手段。糖皮质激素是传统的抗肺纤维化药物,普遍应用于肺纤维化疾病的治疗,但疗效欠佳,且长期使用副作用较大,寻找新的治疗手段是目前研究的热点[2,3]。干细胞由于他特殊的免疫学特征,如低免疫原性和免疫调节功能,可能通过多靶点对免疫细胞亚群进行调节从而逆转自身免疫应答的紊乱,其多向分化的潜能有助于损伤肺泡结构的修复,为肺纤维化的治疗带来了希望的曙光[4]。川穹嗪,学名2,3,5,6-四甲基吡嗪(Tetramethylpyrazine,TMP),已有研究报道川穹嗪可以抑制纤维细胞的分裂、增殖,降低血浆内皮素含量,调节血栓素 A2(TXA2)前列腺素I2(PGI2)平衡等而抑制胶原生成[5],因此提示,川穹嗪具有抗纤维化的作用。本研究首先建立了博莱霉素(Bleomycin,BLM)诱导肺纤维化,然后通过干细胞(Embryonic stem cell,ESC)和TMP联合治疗肺纤维化,探讨治疗肺纤维化的可行性。
材料与方法
1 主要试剂 BLM哈尔滨博莱制药有限公司产品。羟脯氨酸(Hydroxyproline,Hyp)标准品,分析纯,中国科学院生物物理所中生公司产品。雄性小鼠来源的S8胚胎干细胞,由西安交通大学发育生物学教研室提供。制成浓度1.0×106/ml的单细胞作为供体。小鼠抗大鼠MMP-2、小鼠抗大鼠MMP-9、小鼠抗大鼠GAPDH单克隆抗体,均为美国Abcam公司产品。辣根过氧化物酶偶联抗小鼠抗体,美国Millipore公司产品。化学发光底物,美国Millipore公司产品。十二烷基硫酸钠(Sodium dodecylsulfate,SDS)和40%聚丙烯酰胺(Polyacrylamide),美国Amresco公司产品。其他化学试剂为国产分析纯。
2 动物分组与肺纤维化模型制备 SPF级Wistar雌性大鼠50只,体质量180±20g,购买并饲养于西安交通大学实验动物中心,自由饮食。50只大鼠随机分为正常对照组(10只)和模型组(40只)。10%水合氯醛腹腔内注射麻醉,将大鼠仰位固定于操作台,备皮,无菌条件下纵向剪开颈部皮肤分离肌肉,暴露气管,用1ml注射器向气管内一次性滴注BLM(8.5 mg/kg)或同体积的生理盐水,立即拔除针头,将动物直立旋转1~2min,使药液尽可能到达两侧肺部并均匀分布,缝合皮肤,常规饲养。实验动物随机分为5组:正常对照组(A组,注射生理盐水组)10只;肺纤维化模型组(B组)10只,气管内注入BLM;ESC治疗组(C组)10只,于气管内注入BLM后,3日后通过尾静脉给予ESC 1.0×106/ml DMEM 培养液1ml;TMP治疗组(D组)10只,于气管内注入BLM后,3d后通过尾静脉给予 TMP 100mg/kg;联合治疗组(E 组)10只,于气管内注入BLM后,3d后通过尾静脉给予ESC 1.0×106/ml DMEM 培养液1ml,之后进行尾静脉注射TMP 100mg/kg。以肺纤维化化模型组出现大鼠死亡为实验终点。
3 肺组织病理学染色 各取5组大鼠的右肺中叶组织,置入4%低聚甲醛中固定,经乙醇梯度脱水,二甲苯透明2次,石蜡包埋,切片厚度3μm,进行HE染色。
4 肺组织Hyp含量测定 采用盐酸水解法进行Hyp含量的测定,具体方法如下:称取100mg湿肺组织,4℃匀浆,加入12mol/L HCl,105℃水解18h,过滤,取100μl水解液,40℃烘干。同时取Hyp标准液样品0.2~1.6μg设为标准对照,用氯胺T溶液0.2 ml和欧氏液[含25%(w/v)对二甲基氨基苯甲醛和27.3%(v/v)高氯酸异丙醇溶液]反应,50℃水浴90 min,测定标准对照样品于波长558nm处的吸光度值(A558),计算标准曲线。同上方法测定肺组织样本A558值,根据标准曲线计算样本Hyp含量,用肺组织湿重予以校正。Hyp含量单位:μg/mg。
5 Western blot检测肺组织 MMP-2与 MMP-9蛋白的表达 采用蛋白印迹法检测MMP-2和MMP-9的表达,其具体步骤为:提取肺组织总蛋白,取30μg总蛋白进行SDS-聚丙烯酰胺变性凝胶电泳。电转移至硝酸纤维素膜上,用脱脂奶粉封闭,分别与特异性抗大鼠抗体进行孵育(MMP-2,1∶1000;MMP-9,1∶500),充分洗涤后孵育辣根过氧化物酶偶联抗小鼠抗体,ECL化学发光,X线摄片。将同一张蛋白印迹膜曝光后,用0.5%SDS洗脱抗体,再用GAPDH进行孵育杂交以作为内参照。每项实验重复检测3批以上的不同样本。
6 采用流式细胞仪检测各组大鼠肺组织的细胞凋亡率 其步骤如下:称取10mg湿肺组织,剪碎该组织,采用胶原酶于37℃进行4h的消化,然后利用400目筛网过滤细胞,按照罗氏细胞凋亡试剂盒操作方法进行染色,并在BeckmanEpics-XL检测细胞凋亡。
7 Masson染色 Masson染色法选用福州迈新公司出厂的染色试剂盒进行。试剂A:Masson复合染色液,试剂B:分化液,试剂C:1%磷钼酸水溶液,试剂D:2%苯胺蓝染液,按说明书进行操作。
8 统计学处理 本组数据全部采用SPSS11.5软件做统计学处理,计量资料以均数±标准差(±s)表示,组间比较用配对样本t检验,多组均数间采用单因素方差分析,两两比较用LSD-t检验。以P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
1 各组大鼠体质量及肺组织Hyp含量的变化见图1。正常对照组大鼠体质量逐渐增加明显(301.3±14.1g),活动自如,毛发光亮,造模过程中无死亡,其肺组织内 Hyp的含量为1.69±0.19μg/mg。未治疗肺纤维化模型组大鼠体质量增加缓慢(179.7±15.8 g),活动较少,眼睛无神,毛发无光泽,于实验第3周时开始死亡,其肺组织内Hyp的含量显著升高为2.27±0.26μg/mg;ESC与川穹嗪联合治疗组模型组大鼠,随着时间的延长,其质量逐渐增加(298.7±16.2g),未出现死亡,其肺组织内Hyp的含量略有升高(1.74±0.14μg/mg)。而单治疗组其体质量增加缓慢,其肺组织内Hyp的含量的升高介于正常组和模型组之间。
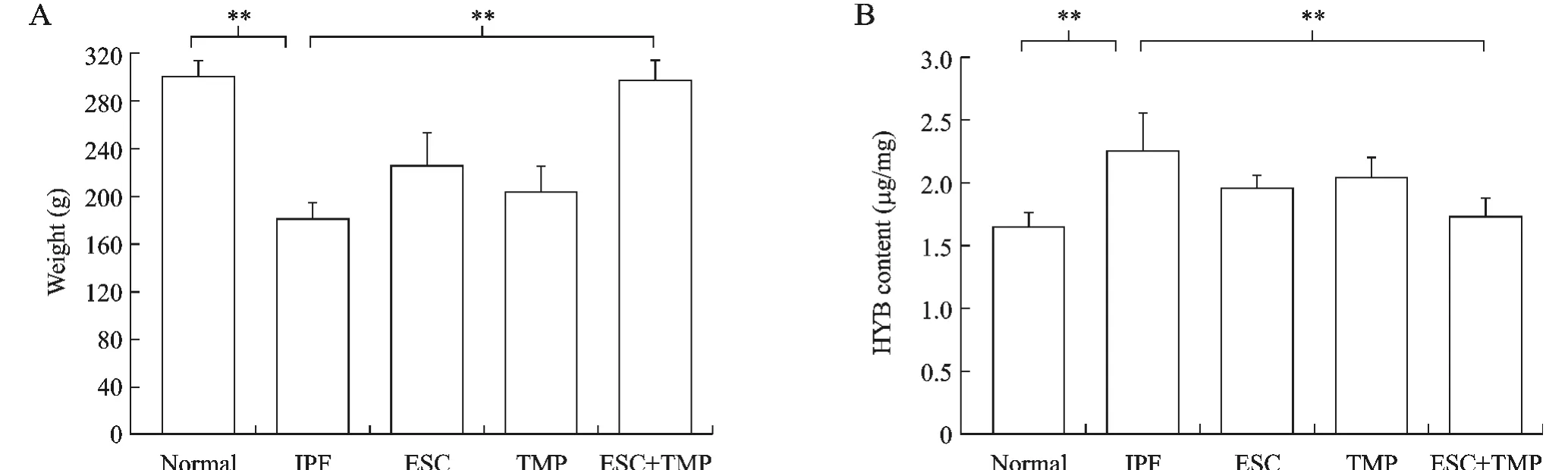
图1 肺纤维化大鼠体质量与肺组织Hyp含量的变化 A)大鼠体质量的测定;B)大鼠Hyb含量的测定;**P<0.05
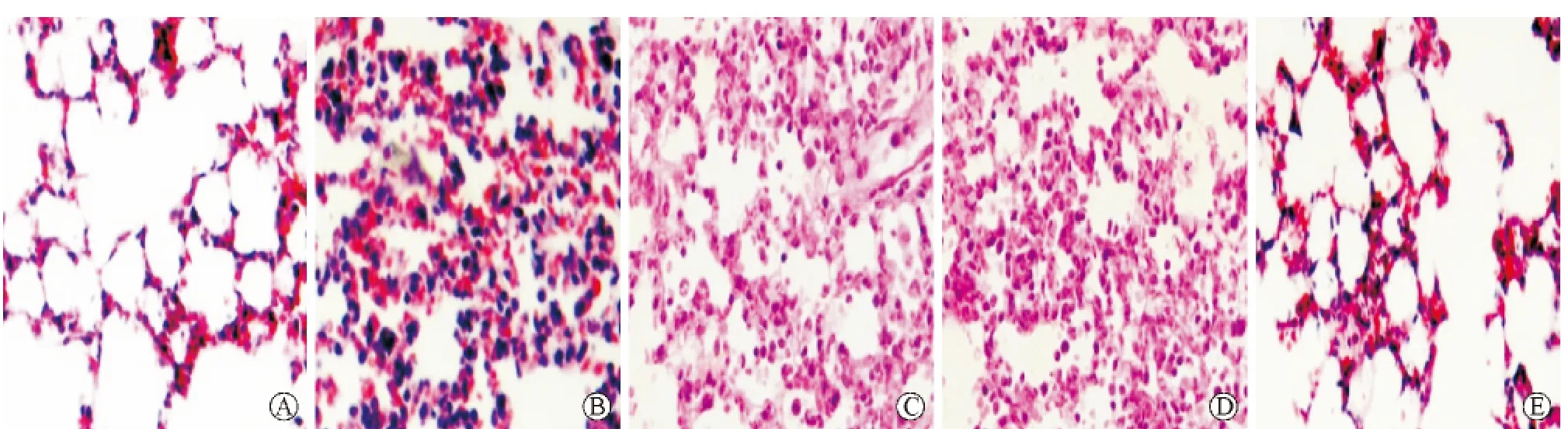
图2 肺纤维化形成过程中大鼠肺组织病理学的变化(HE染色×200)A正常组;B肺纤维化组;CESC组;DTMP组;E ESC与TMP治疗组

图3 肺纤维化治疗后大鼠肺组织细胞凋亡的变化 A正常组;B肺纤维化组;C ESC组;D TMP组;E ESC与TMP治疗组
2 大鼠肺组织的病理学变化 见图2。正常对照组大鼠肺组织肺泡结构正常。模型组大鼠处死后肺泡间隔增厚,肺泡壁与肺泡腔内均可见大量炎细胞,以粒细胞、淋巴细胞和单核细胞为主,其肺泡结构破坏,形成严重的肺纤维化。而ESC与TMP双治疗组,其形态结构基本正常,虽可见粒细胞、炎细胞等,但是其形态结构尚可,足以维持其正常的肺组织结构,根据此结果可以推断,ESC与TMP在体内有效的抑制了肺纤维化。
3 大鼠肺组织细胞凋亡的检测 取新鲜的肺组织,首先对组织进行剪碎,然后用胶原酶进行消化,按照试剂盒说明书进行细胞凋亡的检测,与正常对照组大鼠比较,肺纤维化化组的肺细胞凋亡明显增高,高达48.3%,而经ESC和TMP联合作用后,其细胞凋亡率明显下降至2.25%。而其他组的细胞均有一定的凋亡或死亡。
4 大鼠肺组织MMP-2、MMP-9蛋白表达的变化见图4。正常对照组大鼠肺组织中均能检测到有MMP-2与MMP-9蛋白的表达。而在处死肺纤维化组的肺组织中,明显检测到了MMP-2与MMP-9蛋白的表达量的增高,而单治疗组页检测到 MMP-2与MMP-9蛋白的提高。双治疗组,其MMP-2与MMP-9的表达水平与对照组基本抑制。
5 大鼠肺组织的Masson染色结果 在不同大鼠处理组中,切取肺组织,常规石蜡包埋,切片,行MASSON染色观察肺纤维化程度,从图5中可知:双治疗组中,其Masson染色的结果显示,其肺纤维化明显抑制,与对照组基本一致。

图4 各组大鼠肺组织中MMP-2与MMP-9蛋白表达的变化 1正常组;2肺纤维化组;3ESC组;4TMP组;5ESC与TMP双治疗组
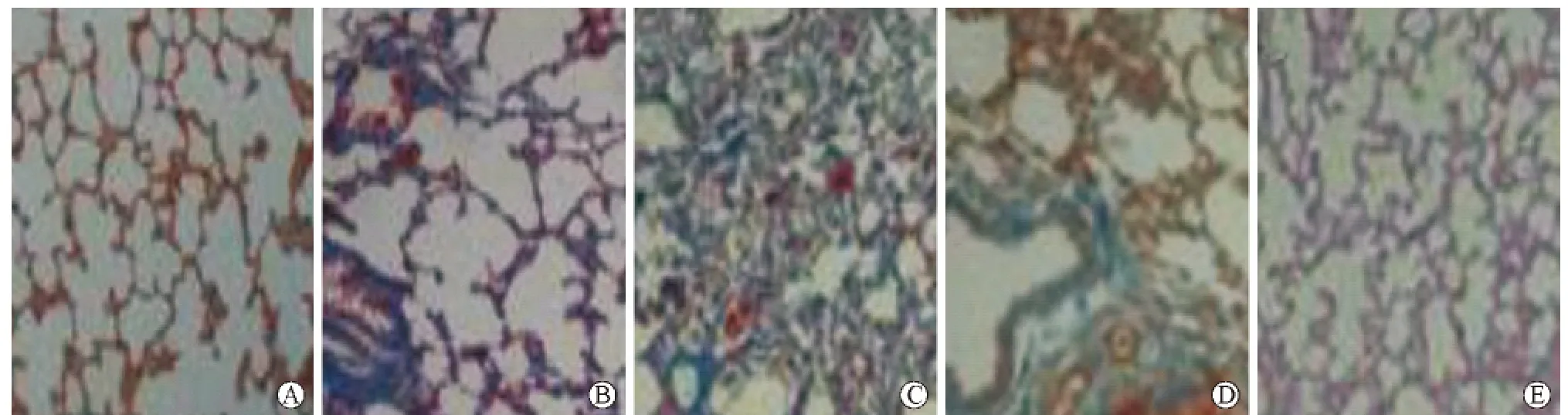
图5 各组大鼠肺组织中Masson染色结果 1正常组;2肺纤维化组;3ESC组;4TMP组;5ESC与TMP双治疗组
讨 论
肺纤维化是由多种病因引起的肺泡间质性炎症继以肺泡结构进行性损害、细胞外基质蛋白胶原沉积为特征的慢性炎症性疾病[6]。其基本病理变化是一个由肺泡炎、大量的胶原增生而发展为肺间质纤维化的过程,早期表现为脱屑性问质性肺炎和肺泡Ⅱ型细胞增生,晚期表现为肺间质纤维化和蜂窝肺[7]。目前肺纤维化的治疗以糖皮质激素或免疫抑制剂为主,但治疗反应差,且副作用较大,多数患者不能耐受长期用药[2,3],因此,深入研究其发病机制与防治措施具有重要的理论意义与临床价值。
本实验采用博来霉素气管内诱导大鼠肺纤维化形成,然后采用ESC和TMP分别(联合)治疗,结果发现,接受ESC与TMP联合治疗后,肺纤维化模型大鼠的体质量增加,状态良好;肺羟脯氨酸含量明显降低;肺脏病理检查显示肺组织炎症程度降低,结构破坏减轻。流式细胞结果显示细胞凋亡指数降低,其核心蛋白MMP-2和MMP-9的表达明显下调。
川穹嗪是从伞形科蒿木属植物根茎的川穹中提取出的主要有效成分,在临床上具有活血化瘀,抗血小板凝集,扩张小动脉,改善微循环,抗氧化,拮抗钙离子等作用[8~11]。此外川穹嗪能够防治药物所致肺纤维化,可减少内皮细胞通透性和细胞因子的分泌,抗自由基,抑制成纤维细胞的增殖和胶原的合成[12]。本研究通过HE染色检测到经川穹嗪治疗后,肺间质细胞内的炎症细胞明显减少,其形态结构趋于正常,进一步改善了大鼠的生存质量。
干细胞具有高度的分化潜能,在重建器官功能方面具有特殊的优势,这一点正在糖尿病、心脏、肝脏、肾脏、神经系统等疾病中受到越来越多的研究关注[13~17]。有学者研究干细胞对肺纤维化的治疗作用,结果发现小鼠接受博来霉素暴露后,静脉给予间充质干细胞,肺组织的羟脯氨酸含量减少[18,19]。提示干细胞治疗有利于减轻肺纤维化。胚胎干细胞从早期的胚泡中分离培养,可以增殖许多代而仍然保持未分化状态,从而能在实验室里大量生产。而且ESC取材方便且体外易于分离培养,对机体损伤小,免疫原性弱,组织相容性好,因此本试验选择胚胎干细胞作为治疗用干细胞的来源。有学者研究发现经博来霉素处理的肺纤维化小鼠,经静脉给予间充质干细胞,其肺组织的羟脯氨酸含量减少,其肺功能得到明显恢复[18,19]。该研究结果提示:采用干细胞治疗有利于减轻肺纤维化。另有学者研究发现,在损伤肺组织中,注射干细胞能明显抑制基质金属蛋白酶(MMP)的活性,减少组织中胶原的沉积,有利于减轻肺损伤[20]。本实验中ESC与TMP双治疗组中HYP含量较模型组明显减少,MMP-2与MMP-9明显抑制,表明组织中胶原沉积减少,从而明显改善肺纤维化。
较传统治疗方法而言,ESC具有不可比拟的优势,但对ESC的研究大多处于实验室阶段。我们的研究亦进一步证实了ESC联合TMP能够减轻博莱霉素诱导的大鼠肺纤维化,且通过尾静脉注射的方式可以达到该疗效,其可能与局部微环境互相影响,如影响MMP-2、MMP-9等重要的致纤维化的细胞因子的合成或释放、Hyb的合成等相关,其具体的信号转导机制有待我们进一步研究。随着对ESC及TMP生物学特性的深入了解和探索,该方法将会对人类疾病的治疗起到巨大的推进作用。
[1] Thannickal VJ,Toews GB,White ES,etal.Mechanisms of pulmonary fibrosis[J].Annu Rev Med,2004,55:395-417.
[2] Uruga H,Hanada S,Kishi K.Prednisone,azathioprine,and N-acetylcysteine for pulmonary fibrosis[J].N Engl J Med,2012,367(9):870-871.
[3] Izumi S,Iikura M,Hirano S.Prednisone,azathioprine,and N-acetylcysteine for pulmonary fibrosis[J].N Engl J Med,2012,367(9):870-871.
[4] Chua F,Gauldie J,Laurent GJ.Pulmonary fibrosis:searching for model answers[J].Am J Respir Cell Mol Biol,2005,33(1):9-13.
[5] Zeng Z,Zhu W,Zhou X,etal.Tetramethylpyrazine,a Chinese drug,blocks coronary vasoconstriction by endothelin-1 and decreases plasma endothelin-1levels in experimental animals[J].J Cardiovasc Pharmacol,1998,31(Suppl 1):S313-316.
[6] Cook DN,Brass DM,Schwartz DA.A matrix for new ideas in pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2002,27(2):122-124.
[7] Noble PW,Barkauskas CE,Jiang D.Pulmonary fibrosis:patterns and perpetrators[J].J Clin Invest 2012,122(8):2756-2762.
[8] Hsieh SC,Lin IH,Tseng WL,etal.Prescription profile of potentially aristolochic acid containing Chinese herbal products:an analysis of national health insurance data in Taiwan between 1997and 2003[J].Chin Med,2008,3(1):13-15.
[9] Wang SL,Lin Y,Tang ZY.Research progress on the protection of tetramethylpyrazine in different kinds of damage of nervous system and its mechanisms[J].Chinese Pharmacological Bulletin,2010,26(4):438-442.
[10] Hu JZ,Huang JH,Xiao ZM,etal.Tetramethylpyrazine accelerates the function recovery of traumatic spinal cord in rat model by attenuating inflammation[J].J Neurol Sci,2013,324(1-2):94-99.
[11] Tang Q,Han R,Xiao H,etal.Neuroprotective effects of tanshinone IIA and/or tetramethylpyrazine in cerebral ischemic injury in vivo and in vitro[J].Brain Res,2012,1488(1):81-91.
[12] Zhang JH,Tu ml,Lei HD,etal.The effect of N-acetylcysteine and tetramethylpyrazine on bleomycin-induced pulmonary fibrosis and TGF-β[J].Journal of Hubei Medical College,2006,25(5):71-72.
[13] Guo Z,Zhou X,Li J,etal.Mesenchymal stem cells reprogram host macrophages to attenuate obliterative bronchiolitis in murine orthotopic tracheal transplantation[J].Int Immunopharmacol,2013,15(4):726-734.
[14] Gupta K,Hergrueter A,Owen CA.Adipose-derived stem cells weigh in as novel therapeutics for acute lung injury[J].Stem Cell Res Ther,2013,4(1):19-21.
[15] Puri MC,Nagy A.Concise review:Embryonic stem cells versus induced pluripotent stem cells:the game is on[J].Stem Cell,2012,30(1):10-14.
[16] Williams LA,Davis-Dusenbery BN,Eggan KC.Snap-Shot:directed differentiation of pluripotent stem cells[J].Cell,2012,149(5):1171-1174.
[17] Stripp BR,Shapiro SD.Stem cells in lung disease,repair,and the potential for therapeutic interventions:State-of-the-art and future challenges[J].Am J Respir Cell Mol Biol,2006,34(5):517-518.
[18] Neuringer IP,Randell SH.Stem cells and repair of lung injuries[J].Respir Res,2004,5:6-14.
[19] Banerjee ER,Laflamme MA,Papayannopoulou T,et al.Human embryonic stem cells differentiated to lung lineage-specific cells ameliorate pulmonary fibrosis in a xenograft transplant mouse model[J].PLoS One,2012,7(3):33165.
[20] Ortiz LA,Gambelli F,McBride C,etal.Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects[J].Proc Natl Acad Sci USA,2003,100(14):8407-8411.
