BiFeO3/H2O2 体系催化氧化降解结晶紫染料废水
2014-12-24郭效军李雨甜武清艳
郭效军,李雨甜,武清艳
(西北师范大学化学化工学院,甘肃兰州 730070)
染料工业废水通常具有色度高、毒性大、可生化性差的特点,常规处理技术难以有效深度处理以达到安全排放或回用标准[1,2]。高级氧化技术是处理该类废水的有效技术,其中Fenton 试剂作为一种强氧化剂在难降解染料、有机废水处理中得到了广泛应用[3,4]。但存在H2O2利用率低、单一H2O2氧化处理成本较高、均相催化剂Fe2+难于回收造成二次污染、催化反应的pH 值条件较窄(一般在3.5 左右)等缺陷。而含非均相催化剂的类Fenton 体系,可在一定程度上克服上述Fenton 试剂在应用中的不足[5]。
结晶紫是多环芳烃有机化合物,属于氨基三苯甲烷类染料[6],具有高毒、高残留及三致(致畸、致癌、致突变)等毒副作用,会对水体的生态系统带来较大的破坏,并长期残留在动物体内,通过生物转化和还原代谢进入人体,严重危害人类健康[7]。
本实验以铁酸铋为催化剂,过氧化氢为氧化剂,研究了该类Fenton 体系催化氧化降解结晶紫的行为,考察了过氧化氢用量、反应时间、反应温度、催化剂用量、染料初始浓度以及pH 等因素对降解过程的影响,并进行了反应动力学的初步研究。
1 试验部分
1.1 试剂与仪器
试验试剂:结晶紫(化学纯);氢氧化钠(分析纯);30 %过氧化氢;盐酸(分析纯);催化剂BiFeO3由本实验室自制;实验所用结晶紫染料废水为模拟废水,结晶紫染料废水储备液质量浓度为1 000 mg/L,根据实验要求将储备液稀释至所需浓度。
试验仪器:PHS-3C 精密pH 计;TD4A 低速自动平衡离心机;BS124S 电子天平;79HW-1 恒温磁力搅拌器;T6 新世纪紫外分光光度计。
1.2 试验方法
先在250 mL 的玻璃反应容器中加入150 mL 一定浓度的结晶紫染料废水,用HCl 和NaOH 调至相应的pH,用恒温水浴控制反应温度,并加入一定量的BiFeO3催化剂,然后在磁力搅拌条件下加入一定量的H2O2,反应一段时间后取样,并用去离子水将所取溶液稀释成相应的倍数,将稀释后的溶液以3 000 r/min 的转速离心分离30 min,取上层清液在波长617 nm 下测其吸光度。试样的催化降解褪色率以下式计算:

式中:A0为反应前结晶紫染料废水吸光度值;Ai为反应后结晶紫染料废水吸光度值。
2 结果与讨论
2.1 溶液pH 值对结晶紫褪色率的影响
图1 为溶液pH 对结晶紫褪色率的影响。由图1 可见,随着pH 增加结晶紫染料废水的褪色率先增加后降低。当pH 为8.0 时,染料褪色率可达99 %以上;当pH 进一步升高时,染料褪色率开始下降。说明结晶紫染料在酸性条件下较为稳定,而在碱性条件下不稳定,这可能与以下两个原因有关:一方面,在碱性条件下溶液中形成·OH 自由基浓度较高[8],使其降解率较高;另一方面,由于溶液酸度的改变,染料分子中存在的共轭体系发生了变化,因而染料的显色或吸光性质也发生了变化。当pH>9 时,由于H2O2快速分解成H2O 和O2,染料的去除效果变差。因此,结晶紫降解的最佳pH 为8.0。

图1 pH 对结晶紫褪色率的影响Fig.1 Effect of solution pH on decolorization of CV
2.2 催化剂用量对结晶紫褪色率的影响
图2 为催化剂用量对结晶紫褪色率的影响。由图2 可知,当催化剂BiFeO3用量增加时,结晶紫染料废水褪色率变化的趋势是先增加后降低。当催化剂用量为0.6 g/L 时,染料褪色率在99 %以上;催化剂用量继续增加时,染料褪色率会降低。原因在于BiFeO3用量的增加可能有利于催化剂表面活性组分的增加,从而加快了H2O2的分解,导致了·OH 自由基和其他自由基发生了链终止反应[9,10],使氧化反应不能顺利进行。因此,该降解过程的最佳BiFeO3用量为0.6 g/L。
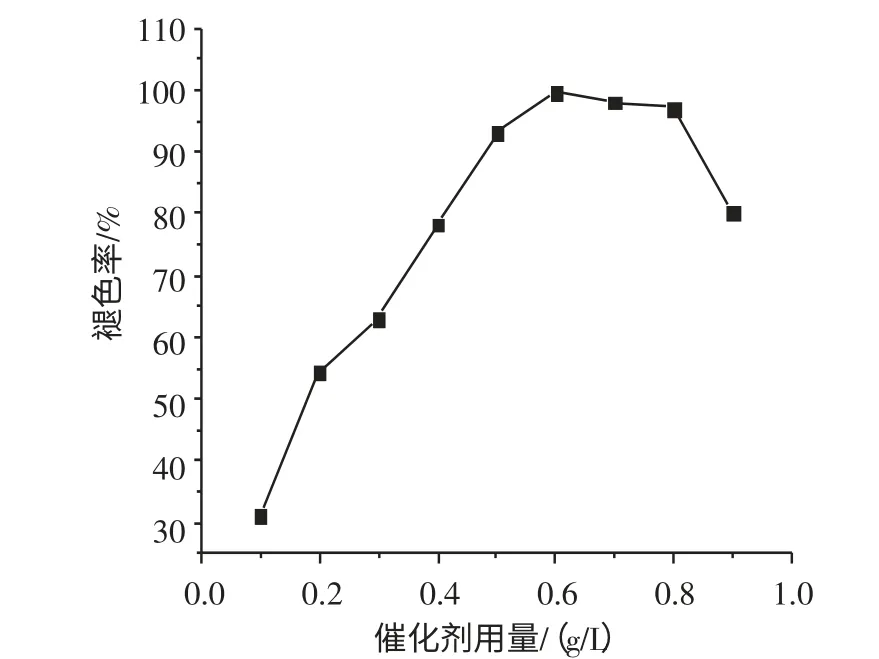
图2 催化剂用量对结晶紫褪色率的影响Fig.2 Effect of catalyst dosage on decolorization of CV
2.3 H2O2 用量对结晶紫褪色率的影响
图3 为H2O2用量对结晶紫褪色率的影响。根据图3,当H2O2体积百分数增加,结晶紫染料废水褪色率呈现先升高后降低的变化趋势。当H2O2体积百分数达到0.83 %时,褪色率在99 %以上;然后继续增加H2O2体积百分数,降解速率下降。这是因为H2O2体积百分数过大时,过量H2O2无效分解[11],也可能与溶液中的活性物种·OH 发生竞争,从而导致了染料废水降解率的下降[12,13]。

图3 H2O2 用量对结晶紫褪色率的影响Fig.3 Effect of H2O2 dosage on decolorization of CV
2.4 结晶紫初始浓度对其褪色率的影响
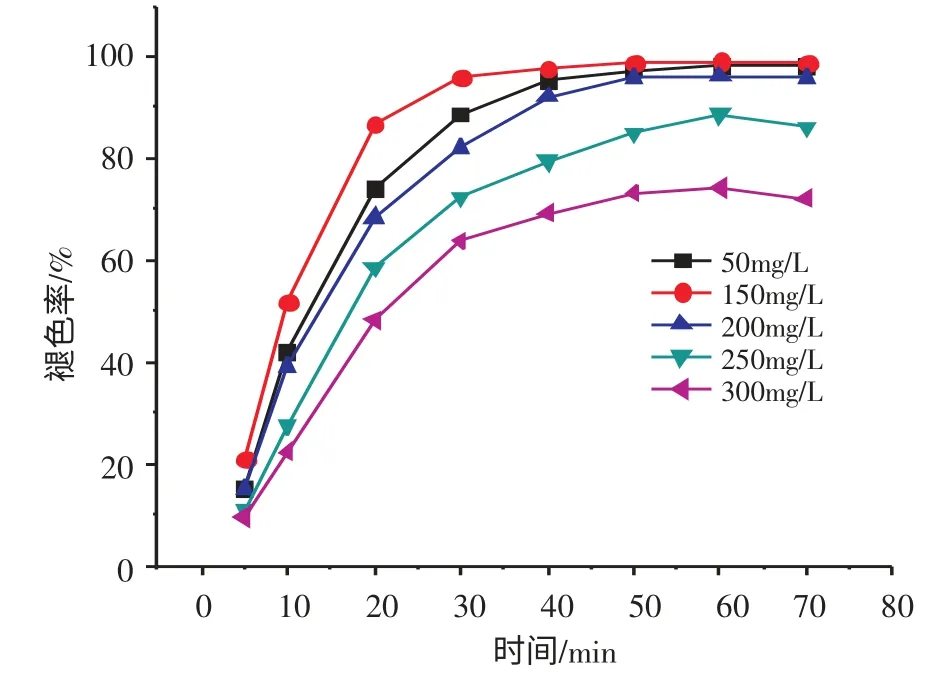
图4 初始浓度对结晶紫褪色率的影响Fig.4 Effect of initial concentration on decolorization of CV
图4 为初始浓度对结晶紫褪色率的影响。由图4可见,随着初始浓度逐渐增加,结晶紫褪色率呈现出先升高后下降的趋势。当结晶紫初始浓度为150 mg/L时,染料废水褪色率为99.9 %(几乎达到100 %)。随着染料浓度继续增大,结晶紫废水褪色率转而下降。原因是随着染料浓度的加大,反应物与·OH 自由基的接触增强,从而使反应加快;当浓度增大到一定值时,溶液中存在的·OH 自由基不足,减慢了反应速率,导致了结晶紫褪色率下降。
2.5 反应温度对结晶紫褪色率的影响
图5 为反应温度对结晶紫褪色率的影响。由图5可得,随着反应温度的升高,结晶紫褪色率表现出先增加后减少的趋势。当温度为308 K,且反应时间60 min时,结晶紫染料废水褪色率可达99 %以上。说明反应温度升高,H2O2产生的·OH 自由基增加,使染料废水的褪色率升高。但过高的温度也会加剧H2O2分解为H2O 和O2,不利于H2O2转化为·OH。
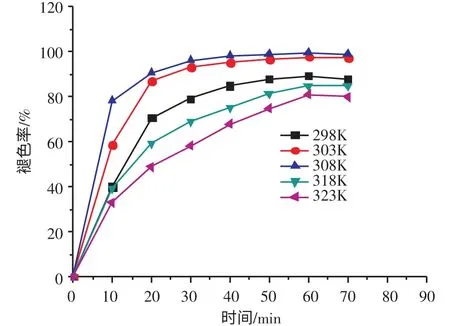
图5 反应温度对结晶紫褪色率的影响Fig.5 Effect of reaction temperature on decolorization of CV
2.6 降解反应动力学
假定结晶紫染料废水的降解反应为一级反应,以lnC 对时间t 作图,得到图6。由图6 可得到不同反应温度下结晶紫染料废水降解的表观速率常数,结果(见表1)。根据图6 和表1 可知,在不同反应温度下,lnC与t 均呈线性关系,故BiFeO3/H2O2体系催化降解结晶紫染料废水近似为一级反应。

图6 结晶紫降解表观速率常数的线性拟合Fig.6 Linear fitting of the apparent rate constant of CV degradation
将Arrhenius 方程k=Aexp(-Ea/RT)两边取对数可得lnK=lnA-Ea/RT,然后再以1/T 对lnK 作图,通过所得直线的斜率和截距可分别求得活化能Ea和指前因子A。因此由表1 数据,以1/T 对lnK 作线性拟合后可得指前因子A=2.953 9×102,活化能Ea=23.77 kJ/mol。
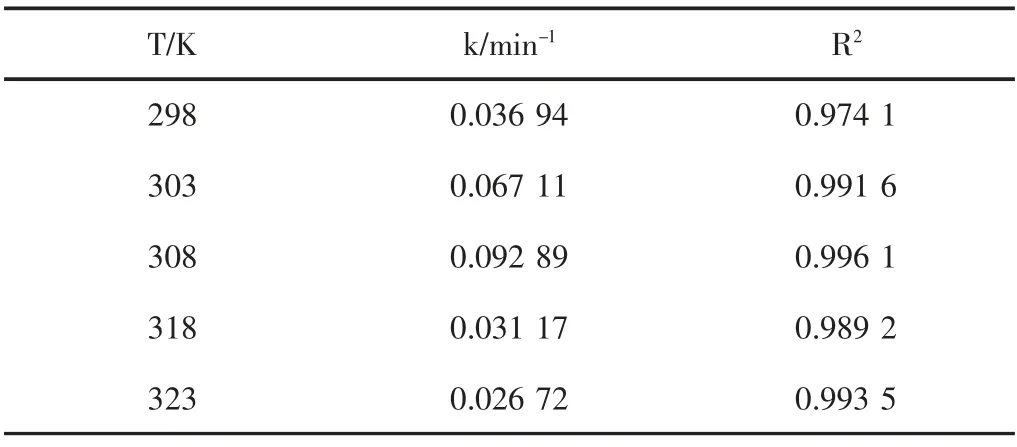
表1 降解结晶紫的表观速率常数Table 1 The apparent rate constant for the degradation of CV at different temperature
3 结论
以铁酸铋为催化剂,过氧化氢为氧化剂,研究了该类Fenton 体系催化氧化降解结晶紫的行为。结果表明当pH 为8.0,BiFeO3用量为0.6 g/L,H2O2体积百分数为0.83 %,染料废水初始浓度为150 mg/L,温度为308 K,反应时间为60 min 时,结晶紫褪色率能达到99 %以上。动力学研究表明BiFeO3和H2O2体系处理结晶紫染料废水近似为一级反应,在303 K 反应速率常数为0.092 89 min-1,表观活化能为23.77 kJ/mol。
[1] Robinson T,Mcmullan G, Marchant R,et al. Remediation of dyes in textile effluent: a critical review on current treatment technologies with a proposed alternative [J]. Bioresource Technology,2001,77(3):247-255.
[2] Georgiiou D,Melidis P,Aivasidis A,et al. Degradation of azo-reactive dyes by ultraviolet radiation in the presence of hydrogen peroxide[J].Dyes Pigments,2002,52(2):69-78.
[3] Apostolos V,Elli M,Sofia M,et al. Discoloration of azo dye acid red 18 by fenton reagent in the presence of iron powder[J]. Polish Journal of Environment Studies,2003,12(2):151-155.
[4] Rahman M M,Hasnat M A,Sawada K. Degradation of commercial textile dye by fenton's reagent under xenon beam irradiation in aqueous medium [J].Journal of Science Research,2009,1(1):108-120.

[5] Sun J,Sun S,Sun J,et al. Degradation of azo dye acid black1using low concentration iron of Fenton process facilitated by ultrasonic irradiation[J].Ultrasonics Sonochemistry,2007,14(6):761-766.
[6] Keenan C R,Sedlak D L. Factors affecting the yields of oxidants from the reaction of nanoparticulate zero-valent iron and oxygen [J].Environmental Science and Technology,2008,(42):1262-1267.
[7] Aldert A B,Peter S. Determination of residues of malachite green in aquatic animals[J]. Journal of Chromatography B,2003,788:351-359.
[8] Du Y K,Rabani J. Flocculation-induced homolysis of hydrogen peroxide in aqueous colloid solution of titanium dioxide nanoparticles [J]. Journal of Physical Chemistry B,2006,110:6123-6128.
[9] Xue X F,Hanna K,Deng N S. Fenton-like oxidation of Rhodamine B in the presence of two types of iron (II,III)oxide[J].Journal of Hazardous Materials,2009,166:407-414.
[10] 段冬,吴德礼,马鲁铭.新型类Fenton 试剂用于酸性红B染料废水处理的研究[J]. 环境工程学报,2010,4(11):2413-2418.
[11] Duan Dong,Wu De-li,Ma Lu-ming. Treatment of acid red B wastewater by a novel Fenton-like catalyst[J]. Chinese Journal of Environmental Engineering,2010,4(11):2413-2418.
[12] Feng J,Hu X,Yue P L. Novel bentonite clay-based Fenanocomposite as a heterogeneous catalyst for photo-Fenton discoloration and mineralization of orange II[J]. Environmental Science and Technology,2004,(38):269-275.
[13] Pham A L T,Lee C,Doyle F M,et al. A silica-supported iron activating hydrogen peroxide at neutral pH values[J].Environmental Science and Technology,2009,(43):8930-8935.
[14] Kwan W P,Voelker B M. Rates of hydroxyl radical generation and organic compound oxidation in mineral-catalyzed Fenton-like systems[J].Environmental Science and Technology,2003,(37):1150-1158.
