醌呼吸影响厌氧消化产CO2/CH4及转化有毒物质的研究
2014-12-23宋佳秀任南琪钱东旭陆一凡上海师范大学生命与环境科学学院环境科学与工程系上海0034哈尔滨工业大学市政与环境工程学院黑龙江哈尔滨50090
宋佳秀,任南琪,钱东旭,陆一凡,徐 怡 (.上海师范大学生命与环境科学学院,环境科学与工程系,上海0034;.哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 50090)
醌呼吸影响厌氧消化产CO2/CH4及转化有毒物质的研究
宋佳秀1*,任南琪2,钱东旭1,陆一凡1,徐 怡1(1.上海师范大学生命与环境科学学院,环境科学与工程系,上海200234;2.哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 150090)
利用蒽醌-2,6,-双磺酸(AQDS)为模式物在厌氧消化过程中富集醌呼吸微生物,考察了富集产物厌氧消化同步醌呼吸的产气特性和对有毒物质的转化.结果发现,富集产物具有较强的腐殖质还原能力,CO2:CH4为 1.7,高于未富集污泥;不同来源的腐殖质因其具有不同的分子结构和醌功能基团数量,对污泥的醌呼吸的促进作用有所差别,而可从还原性腐殖质接受电子的 Fe(III)可显著加强醌呼吸速率;醌呼吸微生物在pH4.5~6条件下获得较高活性,说明此时醌呼吸对厌氧消化贡献较大;富集产物以乙酸为电子供体时可快速转化苯和三氯乙烯, 27h的转化率分为 85.9%和 82.2%,并可以苯为电子供体以三氯乙烯为电子受体同时降解苯和还原三氯乙烯,30h内的转化率分别为 81.7%和68.8%.
腐殖质还原;蒽醌-2,6-双磺酸;醌呼吸
近年来,消除天然(土壤、水体等)和人工(污水厂、剩余污泥等)生态中环境有毒物质的研究受到人们的重视.其中腐殖质(HS)是一种具有羰基结构的高分子芳香族聚合物,普遍存在于环境中,在生物地球化学循环过程中担任重要角色.Lovley等[1]在 1996年最早发现Geobactermetallireducens和Shewanella alga在厌氧条件下能够以腐殖质模式物蒽醌-2,6-双磺酸(anthraquinone-2,6-disulfonate,AQDS)为唯一电子受体,参与细菌的呼吸代谢过程.随后,陆续在陆地有机物含量丰富的沉积物、污染的土壤以及废水处理厂的活性污泥中发现多种细菌可以进行这种呼吸作用.其原理为 HS在厌氧条件下作为电子受体接受来自菌体细胞膜电子传递链上的电子,HS接受电子被还原,而电子在细胞膜传递过程中,形成跨膜的质子浓度电势梯度,偶联能量的形成来支持菌体的生长,因 HS中的醌类基团是主要的电子接受位点[2],因此这种呼吸作用称为醌呼吸.在醌呼吸中,HS不仅可在厌氧环境中充当有机物矿化的电子受体,而且可在腐殖质还原菌和可还原态物质(硝酸盐、重金属、有机污染物、染料等)之间充当氧化还原介体(电子穿梭体),促进这些物质的还原[3-9],在环境修复中起到重要作用.因此这一新型代谢途径自发现以来,逐渐受到国内外学者的瞩目[10-13],是近期环境微生物领域研究的一个热点.
(11)以多分类变量newsubgroup为反应变量,对各协变量建立多分类Logistic回归模型,并计算该模型判对率。
其三,社会治理系统的协同共治。在社会科学中,协同是不同行动者之间,以一方为主的协调与合作,二者之间是和谐非均衡关系[6]。社会治理系统既是一个合作共治的系统,又是一个协同共治的系统。多元主体在社会治理中,既是一种合作关系,又是一种政府主导下的协同关系。这一关系可为创新社会治理的共建共治提供有力的理论支点,同时还可以为推进社会组织和公众参与协同社会治理的实践探索提供方法。
目前,醌呼吸微生物在环境中的作用研究基于自然生态环境,针对活性污泥的腐殖质还原作用的研究不多.已发现的进行醌呼吸的微生物包括地杆菌(Geobacter spp.)、希瓦氏菌(Shewanella spp.)、脱亚硫酸菌(Desulfitobacterium spp.)、嗜热菌(Thermophilic bacteria)等[17].Straub 等[14]的研究证实,活性污泥中普遍存在醌呼吸作用,Wu等[15]在污水厂污泥中分离到了多株腐殖质还原菌.Cervantes等[16]以 AQDS作为最终电子受体,对混合微生物进行加富培养,实现了醌呼吸微生物的富集,这些微生物在将 HS还原的同时偶联有毒有机物的降解.因此研究活性污泥中的醌呼吸作用具有重要的现实意义,本研究通过富集厌氧活性污泥中的醌呼吸微生物,考察了消化过程的醌呼吸作用及其影响因素,并对 2种有毒物质的醌呼吸转化进行了初探和分析,为探讨该类菌在厌氧消化过程中贡献及对有毒物质的降解提供理论基础.
1 材料与方法
1.1 污泥驯化
取自污水厂污泥浓缩池的活性污泥经 14d的密闭搁置后,移至 2个 500mL密闭的发酵瓶内,1#进行常规厌氧消化培养,以有机污水(来自某污水厂,BOD5为 181~232mg/L)为碳源,定期更换培养液;2#除添加相同碳源外,另添加腐殖质模式物AQDS(1mmol/L)以强化污泥的醌呼吸作用,置于30℃恒温培养箱内培养,测量发酵瓶顶部空间的 CH4和 CO2含量,直至 CH4含量超过 40%,AQDS的还原速率达到12h还原70%以上则驯化结束.
1.2 实验方法
实验中考察了pH4.5~7.5范围内驯化污泥的产气情况.结果如图 3所示,随 pH 值的升高,CO2:CH4逐渐降低,由1.8降低至1.3,可见在低pH值(pH4.5~5.5)时醌呼吸对消化过程的贡献较大.这一结果与 Jason等[20]对土壤消化作用的研究相符.Sachs等[21]在对腐殖质的氧化还原作用及对重金属的还原反应研究发现,pH值低至 3时,腐殖质对 Fe(III)的异化还原能力最高.这些研究似乎表明腐殖质呼吸作用倾向于在较低pH值下进行.理论上,随着 pH值的增加,HA的还原电位逐渐减小,这是由腐殖质中功能基团醌的氧化还原特性决定的[22].因此 pH值是影响腐殖质呼吸作用的重要因素,而环境中醌呼吸速率受很多因素影响,包括腐殖质类型以及氧化还原环境,不同来源的腐殖质醌基团数量及化学结构不同,氧化还原平衡存在差异,厌氧消化中亦同时存在多种氧化还原平衡,并与 pH值交互作用,因此有必要开展更深入的研究.
考察未驯化污泥(1#)和驯化污泥(2#)的消化特性,见图 1,其中 cAQDS代表还原的 AQDS.可见,经驯化后的污泥(2#)具有较强的 AQDS还原能力,20h可将90%的AQDS还原,而未经驯化的污泥(1#)经48h后达到60%,之后的还原则十分有限.厌氧消化过程中,污泥中的一部分有机物可缓慢演化成为腐殖质,因此未经驯化的污泥可能存在少量醌呼吸微生物并进行十分有限的腐殖质还原,大部分有机质被甲烷化,同时生成 CO2.醌呼吸微生物通常以有机物为电子供体,将电子传递给腐殖质,最终转化为CO2,这与有机物的甲烷化同时发生,其结果表现为CO2产量的提高.通常,厌氧消化产生的 CO2与甲烷的比例接近 1,本实验中,经驯化的污泥获得了较高的 CO2:CH4值,60d的 CO2:CH4值为 1.7左右,未经驯化的污泥60d获得的CO2:CH4值为1.3左右,这是由于醌呼吸微生物与产甲烷微生物争夺电子供体并将其转化为 CO2所致.对于未添加 AQDS的实验组,经驯化的污泥的 CO2:CH4值也高于未经驯化的污泥,但差距不大,因为未添加AQDS的实验组缺乏醌呼吸微生物的电子受体,因此醌呼吸的活性较低.
1.3 主要试剂
综上所述,在大面积烧伤之后,Th17细胞和Treg细胞都受到了显著抑制,动态平衡被破坏,机体防御感染的免疫功能明显减弱;但是早期使用右美托咪定能减轻大面积烧伤患者烧伤后引起的细胞免疫抑制,保持机体的免疫能力。
2 结果与讨论
2.1 醌呼吸微生物的富集及对厌氧消化的影响
采用 Cervantes等[19]描述的方法于 450nm波长处用采用UNICO 1200型分光光度计测定其还原态 AH2QDS的吸光度.利用无菌针头,氮气保护下抽取血清瓶顶部空间气体,采用 SRI 8610C型气相色谱、氢火焰离子化(FID)检测器以及SRI 310C、热导检测器TCD检测CO2、CH4含量;抽取液相样品经过滤后采用 HP5890Ⅱ型色谱仪,电子捕获检测器(ECD)检测三氯乙烯含量;采用Agilent 6890气相色谱仪,氢火焰离子化(FID)检测器检测苯含量.厌氧手套箱型号为14500COY型.
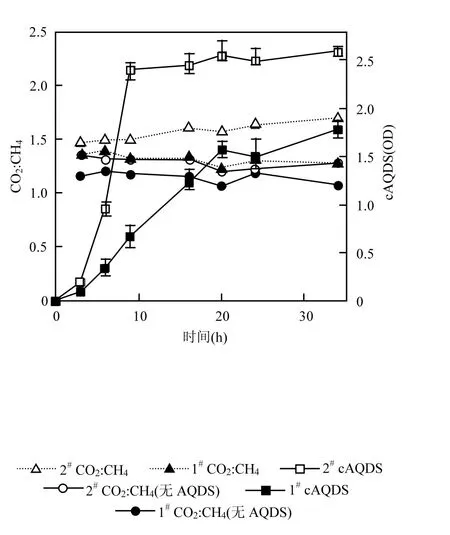
图1 未驯化污泥(1#)和驯化污泥(2#)的消化特性Fig.1 The digestion characteristics of sludge with acclimation (1#) and sludge without acclimation sludge (2#)
2.2 电子介导载体的影响
考察了电子介导载体的影响,包括不同来源的腐殖质以及金属离子,其中 S-HA、L-HA、P-HA分别提取自土壤、风化褐煤和沼泽,其碳系数分别为0.54、0.58、0.65.腐殖质和金属离子在这一生化反应中充当电子中间体,将电子传递给电子受体.如图 2所示,不同类型电子载体 7d的CO2:CH4呈现一定的差异,这在一定程度上反映了醌呼吸作用的差异.醌呼吸通过腐殖质内的醌基团的电子传递作用得以进行,不同类型的腐殖质接受电子能力存在差异是重要的原因之一,同时与腐殖质的结构特性有关.在醌呼吸过程中,腐殖质作为中间电子传递体,胞外接受醌呼吸微生物传递的电子,起到电子传递作用的是分子中的醌基团[10],醌基团接受 H 转化为氢醌.而天然腐殖质分子结构极为复杂,官能团的数量结构迥异,因此接受电子和转移电子的能力因受到数量、结构和生化活性等因素的影响而产生差别.尽管很难定量描述这种影响,此结果仍然具有一定的意义,可作为研究和应用的参考.同时,在有其他电子介导载体(FeCl3和 Fe2(SO4)3)存在的情况下,CO2/CH4的比率较单独添加AQDS(10mmol/L)分别增加了0.26和 0.34.Fe(III)对醌呼吸的促进作用在研究中多次得到证实[1,21],在 Fe(III)存在的情况下,被还原的腐殖质将被重新氧化并可继续接受电子,起到电子穿梭中间体的作用,在本实验中,Fe(III)的存在显著增强了醌呼吸速率.

图2 不同电子介导载体对CO2/CH4生成比的影响Fig.2 The effect of electron donor on the CO2:CH4 ratio
2.3 pH值的影响
在厌氧手套箱内,利用去离子水将污泥稀释,采用均质器将污泥均质化,测定污泥初始 pH值为 6.32.利用定量移液器将 10mL污泥混合物分装于 30mL血清瓶内,利用灰色聚乙烯胶塞加铝制金属圈利用卷缩器压紧密封.采用无菌针,氮气保护下分别进行各种物质的添加.实验分为3组,分别为电子介导载体影响实验、pH值影响实验和2种有毒有机物(苯和三氯乙烯,二者分别在醌呼吸中充当电子供体和电子受体)的影响实验.实验方法如下,第1组:添加不同类型电子介导载体,包括 AQDS(蒽醌-2,6,-双磺酸,1mmol/L、10mmol/L)、FeCl3(氯化铁,10mmol/L)和 AQDS(10mmol/L)、Fe2(SO4)3(硫酸铁,10mmol/L)和AQDS(10mmol/L)、Peat humic (泥炭腐殖质,10g/L)、Soil humic(土壤腐殖质,10g/L)和Leonardite humic (风化褐煤腐殖质,10g/L),对照样未添加以上物质.第 2组:利用 0.5mol/L Homopipes (pH4.5)、1mol/L MES(2-(N-吗啡啉)乙磺酸,pH4.5,5.6,6,6.5)及1mol/L CHES (2-(环己基氨基)乙磺酸,pH9.5,12.5)缓冲液调节pH值,每个血清瓶内的添加量为500µL,测得实际pH值分别为4.56,5.01,5.58,5.66,6.91,6.4,7.45,8.02.第3组:分别添加苯,AQDS+苯,三氯乙烯,三氯乙烯+AQDS,三氯乙烯+乙酸+AQDS,苯+三氯乙烯+AQDS,以未添加 AQDS的样品为对照,其中AQDS浓度为 1mmol/L,苯和三氯乙烯浓度均200µmol/L,乙酸浓度为1mmol/L.每个条件均为3组平行样,结果取平均值.所有血清瓶按上述方法添加后,置于恒温箱 30℃培养.氮气保护下,抽取顶部空间气体利用气相色谱检测,利用无菌注射器抽取液体样品,利用针头过滤器进行过滤,注入胶塞密封的无氧小瓶内,再利用色谱针抽取检测液相中的苯和三氯乙烯,加标回收率分别为97.8%和96.5%.

图3 pH值对CO2和CH4产量的影响Fig.3 The effect of pH on the yield of CO2 and CH4
2.4 有毒有机物的影响
厌氧环境中,在多种微生物的作用下,苯和三氯乙烯降解化学反应式如下:
AQDS(anthraquinone-2, 6-disulfonate) 为分析纯,购于Sigma公司.P-HA、L-HA、S-HA 来自 于 IHSS(International Humic Substance Society).FeCl3、Fe2(SO4)3为分析纯,购于 Promega Corporation,其余药品均为分析纯,分别购于Fisher Scientific和Promega Corporation.
考察了驯化污泥对苯和三氯乙烯(TCE)的降解特性(27h),结果如图 4.可见,无 AQDS时,苯和TCE的降解十分有限.在 AQDS存在的情况下,苯的降解得到大幅度强化,转化率为 85.9%,而TCE的降解十分有限.TCE在厌氧条件下应是通过还原脱氯而得到降解,所以当电子供体缺乏时,TCE无法降解.而当乙酸存在时,TCE的转化率为 82.2%,乙酸此时作为电子供体,通过醌呼吸微生物将电子传递给 AQDS,继而将电子传递给TCE实现还原脱氯进而转化,或经由其他脱氯细菌进行还原脱氯,本系统中起主导作用的应是醌呼吸微生物.当系统中仅存在苯和TCE时,27h转化率分别达到 81.7%和 68.8%,这说明醌呼吸微生物可以苯为电子供体以TCE为电子受体同时实现这2种有机物的降解.在土壤培养物中,苯的厌氧降解偶联AQDS的还原已经得到证实[16],而同时降解苯和三氯乙烯的实验研究不多,因此这一结果对于污泥或污水的脱毒具有重要意义.


图4 苯和三氯乙烯的降解Fig.4 The degradation of benzene and trichlorethylene

图5 厌氧消化同步醌呼吸电子流动分析Fig.5 Electron flow analysis in anaerobic digestion synchronization with quinone respiration Hydrolysis fermentation bacteria:水解发酵菌;Hydrogen production bacteria:产氢菌;Methanobacteriales:产甲烷菌;Geobacter:地杆菌;Dehalococcoides:脱氯球菌;TCE:三氯乙烯;cis-DCE:顺式二氯乙烯; C2H2:乙烯
式(2)是在一些脱氯菌(如Dehalococcoides)的作用下,TCE的还原脱氯,这一过程在本系统中应较难发生,因为实验污泥并未富集此类微生物.本研究中起主导作用的是醌呼吸微生物(如Geobacter),并存在 AQDS,因此三氯乙烯的降解反应应如式(3)所示.图5为厌氧消化同步醌呼吸过程的电子流动和微生物群分析,其中虚线代表醌呼吸的电子传递方向,醌呼吸微生物与产甲烷菌竞争电子供体,包括有毒有机物,将其转化为CO2,并藉电子的传递还原转化环境有毒物质.

当有AQDS和电子供体的情况下,三氯乙烯的降解反应式如下:
我院2016年12月至2017年12月42例急性肾炎急性期患儿均符合小儿急性肾炎急性期临床诊断标准,患者均出现肢体非凹陷性水肿,尿量减少,同时伴有腹水、胸腔积液等临床症状。排除标准:(1)排除合并心、肝、肾等重要脏器疾病患儿。(2)排除合并认知障碍患儿。(3)排除合并甲状腺疾病、糖尿病等全身系统疾病患儿。本次研究经医院伦理会以及患儿家属同意,所有患儿家属均表示自愿参与本次实验。
3 结论
3.1 驯化的剩余污泥富含醌呼吸微生物,具有还原腐殖质的能力,醌呼吸微生物与产甲烷微生物在厌氧消化过程中共同争夺氢供体,其结果表现为CO2:CH4值升高.
3.2 不同类型的腐殖质由于其分子结构及醌基团数量的差异,具有不同的还原能力,而 Fe(III)可以显著增强醌呼吸速率.
我国新修编的面板堆石坝设计规范(SL 228—2013)规定高坝、重要工程、地震设计烈度为8、9度的面板坝工程,应设置放空设施。从面板坝运行中的事故处理和经验总结看,高坝设置放空设施,可适当控制水库蓄水和有条件降低库水位,主要目的是用于大坝超标渗漏检查与修补,在非常情况(如地震等灾害)减少次生灾害影响。如2009年紫坪铺面板坝灾后恢复重建时,降低库水位以修复挤压破坏面板;2000年株树桥面板堆石坝放空检修时,利用发电引水洞将库水位降低,加高原上游围堰,并由发电引水洞导流,获得了在坝体较低部位进行修补的机会和时间。
3.3 在厌氧消化过程中,醌呼吸作用在 pH 值4.5~6范围内表现出优势,在消化过程中贡献较大.
3.4 驯化污泥可快速转化苯和三氯乙烯(乙酸为电子供体),27h的转化率分为85.9%和82.2%.醌呼吸微生物可以苯为电子供体以三氯乙烯为电子受体同时实现这两种有机物的转化,无其他电子供体时,27h的转化分别达到81.7%和68.8%.
[1] Lovley D R, Coates J, Blunt-Harris E L, et al. Humic substances as electron acceptors for microbial respiration [J]. Nature,1996,382:445-448.
[2] Lu X Q, Johnson W D, Hook J. Reaction of vanadate with aquatic humic substances: an ESR and 51V NMR study [J].Environmental Science and Technology, 1998,32(15):2257-2263.
[3] Cervantes F J, Vander Velde S, Lettinga G, et al. Competition between methanogenesis and quinone respiration for ecologically important substrates in anaerobic consortia [J]. FEMS Microbiology Ecology, 2000,34(2):161-167.
[4] Lovley D R, FragaH L, Coates J D, et al. Humics as an electron donor for anaerobic respiration [J]. Environmental Microbiology,1999,1(1):89-98.
[5] Scott D T, Mcknight D M, Bluntharris E L, et al. Quinone moieties act as electron acceptors in the reduction of humic substances by humics-reducing microorganisms [J]. Environ. Sci.Technol., 1998,32(19):2984-2989.
[6] 方连峰,王 竞,周集体,等.醌化合物强化偶氮染料的生物脱色[J]. 中国环境科学, 2007,27(2):174-78.
[7] Gu B H, Yan H, Zhou P, Watson D. Naturalhumics impacturanium bioreduction and oxidation [J]. Environmental Science & T echnology, 2005,39(14):5268-5275.
[8] Bradley P M, Chapelle F H, Lovely D R. Humic acids as electron acceptors for anaerobic microbial oxidation of vinylchloride and dichloroethene [J]. Applied and Environmental Microbiology,1998,64(8):3102-3105.
[9] Luijten M L, Weelink S A, Godschalk B, et al. Anaerobic reduction and oxidation of quinone moieties and the reduction of oxidized metals by halorespiring and related organisms [J].FEMSM icroiology Ecology, 2004,49(1):145-150.
[10] Jiang J, Kappler R. Kinetics of microbial and chemical reduction of humic substances: Implications for electron shuttling [J].Environmental Science and Technology, 2008,42(10):3563-3569.
[11] Jiang J, Iris B, Andrea P, et al. Arsenic redox changes by microbially and chemically formed semiquinone radicals and hydroquinones in a humic substance model Quinone [J].Environmental Science and Technology, 2009,43:3639-3645.
[12] Borch T, Kretzschmar R, Kappler A, et al. Biogeochemical redox processes and their impact on contaminant dynamics [J].Environmental Science and Technology, 2010,44:15-23.
[13] Ingelmo F, Molina M J, Soriano M D, et al. Influence of organic matter transformations on the bioavailability of heavy metals [J].Journal of Environmental Management, 2012,(95):S104-S109.
[14] Straub K L, Kappler A, Schink B. Enrichment and isolation of ferric-iron-and humic-acid-reducing bacteria [J]. Methods in Enzymology, 2005,397:58-77.
[15] Wu C Y, Li F B, Zhou S G. Humus respiration and its ecological significance [J]. Acta Ecologica Sinica, 2009,29(3):1535-1542.
[16] Cervantes F J, Mancilla A R, E. Toro E R, et al. Anaerobic degradation of benzene by enriched consortia with humic acids as terminal electron acceptors [J]. Journal of Hazardous Materials,2011,(195):201-207.
[17] 武春媛,李芳柏,周顺桂.腐殖质呼吸作用及其生态学意义 [J].生态学报, 2009,32(3):1538.
[18] Wu C Y, Li F B, Zhou S G. Humus respiration and its ecological significance [J]. Acta Ecological Science, 2009,29(3):1535-1542.
[19] Cervantes F J, Vandervelde S, Lettinga G, et al. Quinones as terminal electron acceptors for anaerobic microbial oxidation of phenolic compounds [J]. Biodegradation, 2000,11(5):313-321.
[20] Jason K, Keller, Pamela B, et al. Humic acids as electron acceptors in wetland decomposition [J]. Soil Biology and Biochemistry, 2009,(41):1518-1522.
[21] Sachs S, Bernhard G. Humic acid model substances with pronounced redox functionality for the study of environmentally relevant interaction processes of metal ions in the presence of humic acid [J]. Geoderma, 2011,162:132-140.
[22] Aeschbacher M, Sander M, Schwarzenbach R P. Novel electrochemical approach to assess the redox properties of humicsubstances [J]. Environmental Science and Technology,
2010,44:87-93.
The effect of quinone respiration on CO2/CH4production and transformation of toxic substances in anaerobic digestion.
SONG Jia-xiu1*, REN Nan-qi2, QAN Dong-xu1, LU Yi-fan1, XU Yi1
(1.College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China;2.School of Municipal and Environmental Engineering,Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2014(5):1236~1241
In this study, anthraquinone -2 ,6 , - disulfonic acid (AQDS) was employed as a model substance to enrich the quinone respiration bacteria in the process of anaerobic digestion. The characteristics of gas production were investigated as well as the toxic substance conversion in sludge by enriched quinone respiration bacteria . A high humus reducing capacity for enriched anaerobic sludge was verified with a high ratio of CO2: CH4= 1.7. The quinone respiration rate was found to vary while adding different sources of humus which can be attributed to different molecular structures and numbers for quinone functional groups. Fe (III), which is able to accept electron from a reductive humus, can significantly enhance quinone respiration rate. Quinone respiration in pH (4.5 ~ 6) showed the results of higher activity which indicated that at this pH, quinone respiration is likely to contribute more to anaerobic digestion. Enriched sludge can rapidly convert benzene and richlorethylene into CO2with acetate as an electron donor. For example, the conversion rates were up to 85.9% and 82.2% in 27h which can also oxidize benzene as an electron donor and deoxidize trichlorethylene as electron acceptor simultaneously, whose conversion rates were about 81.7% and 68.8% within 30h.
humus reduction;anthraquinone 2,6 - disulfonic acid;quinone respiration
X703.1
A
1000-6923(2014)05-1236-06
2013-10-08
国家自然科学基金青年基金项目(51208302);教育部博士点新教师基金(20123127120008);上海市教育委员会科研创新项目(12YZ083)
* 责任作者, 讲师, songjiaxiu @shun. edu. cn
宋佳秀(1979-),女,黑龙江哈尔滨人,讲师,博士,主要从事污水厌氧生物处理技术.发表论文20余篇.
