基于正交设计及均匀设计的茯苓多糖提取工艺及多糖特性研究
2014-12-16赵玉英吴志刚王二兵
赵玉英,吴志刚,王二兵
(太原科技大学化学与生物工程学院,山西太原030021)
茯苓(Poria Cocos)是我国的传统名贵、药食两用中药材。为多孔菌科真菌茯苓的干燥菌核,别称松茯苓、松柏芋、茯菟等,有宁心安神、抑菌杀菌、降血糖、抗病毒、调节免疫力、诱生与促干扰素和白细胞调节素等作用,对人体有较高的保健功能和药用价值[1-2]。作为茯苓最有效成分之一的茯苓多糖更见长于提高人体免疫机能、防治肿瘤、抗炎等生物学活性。但传统的茯苓多糖提取方法耗时长,而且提取率较低。目前,超声技术在植物多糖的提取中已越来越引起人们的重视,超声提取方法具有高回收率、加热快速、控温容易等优点[3]。本实验分别采用正交设计对茯苓多糖的索氏回流提取和均匀实验对茯苓多糖的超声波提取进行提取工艺优化,并对比最佳工艺提取的茯苓多糖的多糖含量、蛋白质及红外光谱进行比较研究,以期筛选出一种高效、经济的提取方法,为茯苓的实际生产提供理论参考。
1 仪器与材料
1.1 药材
茯苓(万生中药厂,批号:11120产地:安徽)。
1.2 仪器
SC202型电热恒温鼓风干燥箱:浙江嘉兴县新胜电热仪器制造厂;FW80微型高速万能试样粉碎机、HH-2型电热恒温水浴锅、101-1A型电热鼓风干燥箱、MH-250调温型电热套:北京中兴伟业仪器有限公司;SHZ-D循环水式真空泵:巩义市予华仪器公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;HairBCD-215KA DZ型电冰箱:青岛海尔股份有限公司;FA1204B型电子天平:上海精密科学仪器有限公司;60目标准筛:浙江上虞金鼎标准筛厂;WKY型微量移液器:上海求精生化试剂仪器有限公司;LD5-10型低速离心机:北京医用离心机厂;VIS-723G型可见-紫外分光光度计:北京瑞科分析仪器公司;THC-5B超声波提取机:济宁天华超声电子仪器有限公司;红外光谱仪:北京东讯天地医疗仪器有限公司。
1.3 试剂
95%乙醇、葡萄糖、三氯甲烷、苯酚、丙酮、正丁醇、浓硫酸、无水乙醇,以上试剂均为国产分析纯。
2 方法
2.1 茯苓多糖的提取
原料→烘干(48±2℃下恒温干燥48 h)→粉碎(过60目筛)→称样→配比→回流﹙脱单糖﹚→索氏提取﹙脱脂﹚→提取多糖→Sevag除蛋白→水层离心→取上清液→浓缩→放置冰箱→弃上清液→挥干→残渣恒温干燥→得茯苓水溶性多糖样品→测吸光度→记录数据→计算多糖含量
2.2 茯苓的预处理
将茯苓药材在(48±2)℃下恒温干燥48 h,趁热粉碎过60目筛。取上述粉末20 g,分别加入80%乙醇90 mL回流提取1 h,弃去上清液,残渣中加入80%乙醇90 mL,回流提取1 h,挥干,在残渣中加入80%乙醇90 mL,静置12 h,弃去上清液,在残渣中再加入80%乙醇90 mL,索氏提取2 h,将残渣干燥,得茯苓样品粉末,称重。
2.3 茯苓多糖的纯化
在提取的茯苓多糖液体中加入三氯甲烷:正丁醇(5 ∶1)60 mL,振摇 30 min,静置过夜,弃去有机层,水层以 3000 r/min离心10 min;取上清液浓缩至约15 mL左右,加入95%乙醇使溶液含醇量达85%,放置冰箱过夜,弃去上清液,挥去乙醇,残渣在60℃下恒温干燥,即得茯苓水溶性多糖样品。
2.4 多糖含量的测定
本实验采用苯酚-硫酸法进行多糖含量的计算。
2.4.1 对照品溶液的制备
精密称取经105℃干燥至恒重的无水葡萄糖15.3 mg,加适量水溶解,定量转移至25 mL容量瓶中,加水至刻度,摇匀,备用。
2.4.2 供试品溶液的制备
精密称取各样品粉末约0. 0125 g,取适量水溶解,定量转移至25 mL容量瓶中,摇匀备用。
2.4.3 标准曲线的制备
精密量取葡萄糖标准溶液 0、100、120、140、160、180 μL置于具塞试管中,依次加入蒸馏水2.00、1.90、1.88、1.86、1.84、1.82 mL,5%苯酚溶液 1.0 mL,浓硫酸7.0 mL,摇匀备用。将上述具塞试管于沸水浴中加热15 min,取出冷却5 min,再放入冷水浴中15 min,取出,于486 nm,在此波长下测定各标准溶液的吸光度(A)。以吸光度A为纵坐标,标准液浓度C(μg/mL)为横坐标,得到葡萄糖溶液的标准线方程:A=0.040C-0.034(r=0.999),结果表明葡萄糖在 6.0 μg/mL~10.8 μg/mL 范围内线性关系良好。
2.4.4 样品中多糖的测定。
取各样品溶液100 μL于具塞试管中,依次加入1.9 mL蒸馏水,1.0 mL苯酚,7.0 mL浓硫酸,摇匀。将上述具塞试管于沸水浴中加热15 min,取出冷却5 min,再放入冷水浴中15 min,取出,在486 nm处测定各样品溶液的吸光度值,计算多糖含量。
2.5 茯苓多糖的索氏回流提取法
选择固液比、提取时间和提取次数3个因素[4],以多糖含量为考察指标,选择L9(34)正交表进行实验,因素水平安排见表1。

表1 正交实验因素水平表Table 1 Orthogonal test table
2.6 茯苓多糖的超声波提取法
选择提取温度、提取时间、超声功率和固液比四个因素[5],以多糖含量为考察指标,选择均匀设计表中的U64进行实验,因素水平安排见表2。
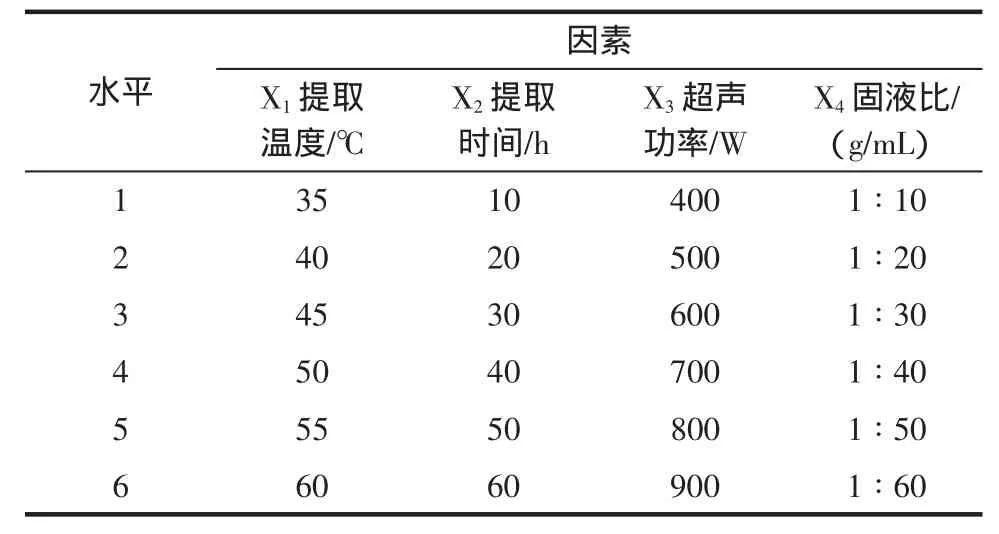
表2 均匀实验因素水平表Table 2 Uniform experiment test table
2.7 茯苓多糖的红外分析方法
精密称取样品1 mg,光谱纯、干燥的KBr粉末200 mg,在玛瑙乳钵中研细、混匀,压片制样品。测定条件为:光谱范围为 4000cm-1~400cm-1,分辨率为 4cm-1,扫描次数为16次。结果采用GRAMS/32AI软件进行分析。
2.8 茯苓多糖的紫外分析方法
取茯苓多糖加水溶解,配制成浓度为0.08 g/L的多糖水溶液,在200 nm~400 nm波长范围内,使用紫外分光光度计对多糖溶液进行紫外扫描,分析多糖溶液的吸收情况,以判断有无核酸和蛋白质的吸收峰。
3 结果
3.1 茯苓多糖含量的测定的方法学考察
3.1.1 精密度试验
精密量取对照品溶液0.8 mL于具塞试管中,测定A值,重复测定6次,结果A值的RSD为0.091%。
3.1.2 稳定性试验
精密量取供试品溶液100 μL于具塞试管中,测定A值,每隔30 min测定1次,结果A值的RSD为0.907%,表明供试品溶液在3 h内稳定。
3.1.3 重现性试验
制备供试品溶液,平行6份,各精密量取100 μL于具塞试管中,测定A值,计算其质量分数的RSD为1.636%。
3.1.4 加样回收率试验
精密量取样品溶液50μL,平行6份,均加入50μL的对照品溶液,测定A值,计算回收率,结果平均回收率为99.68%,RSD为1.893%。
3.2 茯苓多糖的索氏回流提取法实验结果
表3正交实验结果表明,固液比和提取次数对提取收率的影响显著,而提取时间影响较小。比较R值的大小可以看出,各因素的影响顺序为:固液比>提取次数>提取时间;比较K值可以看出,传统法对茯苓多糖的提取最佳条件为:固液比1∶60,提取次数4,提取时间5h,多糖提取率为1.247%。从表4得知A因素固液比在α=0.10水平具有显著性,其他因素无显著性。
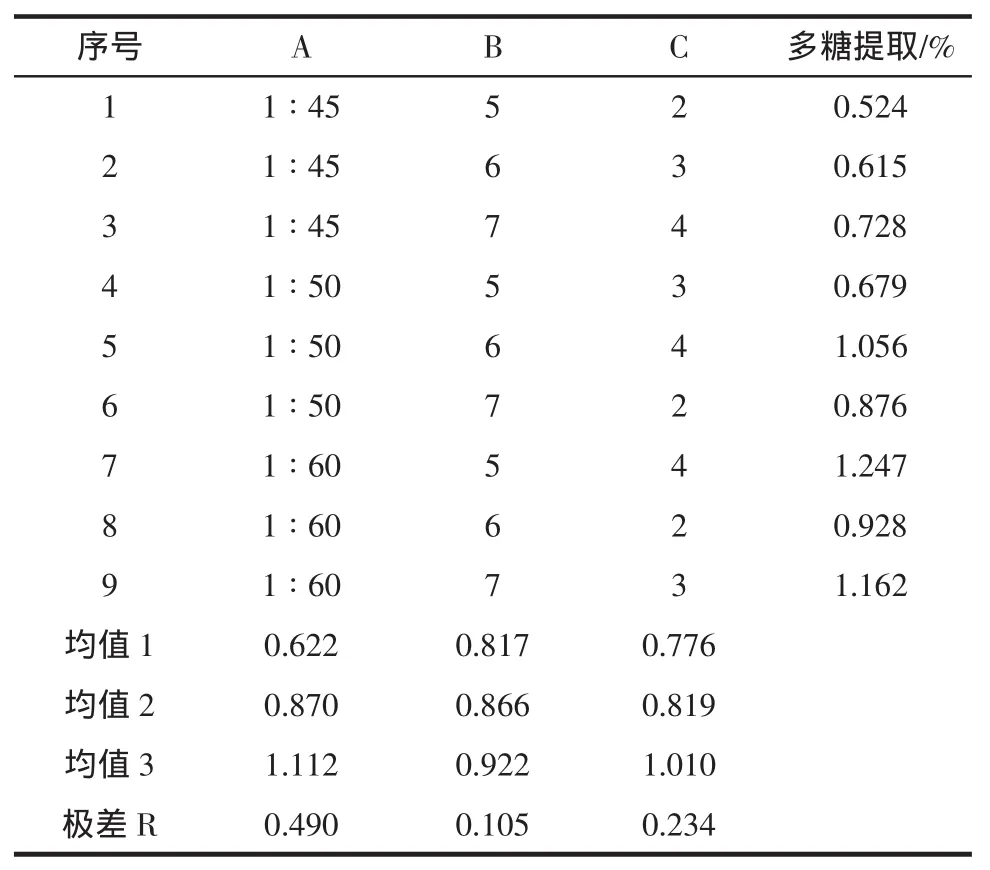
表3 正交实验直观分析表Table 3 Orthogonal test results and variance analysis

表4 方差分析表Table 4 The Variance analysis
3.3 茯苓多糖的超声波提取法实验结果
采用均匀设计所得超声波法提取茯苓多糖的实验结果如表5所示。直观分析表明3号多糖含量最高,故选取3号为多糖较适宜的提取条件,即超声波功率400W,提取时间60 min,固液比1∶40,提取温度为45℃。
3.4 两种提取法提取的茯苓多糖比较研究
1)两种提取法提取的茯苓多糖含量的比较。对两种提取方法的最佳提取工艺所得茯苓多糖含量进行对比,如图1-A,可知,无论是超声波提取,还是传统提取,多糖含量无显著性差异,这说明两种方法在提取多糖上差不多。但相比而言超声波提取迅速、方法简便。

表5 超声波提取茯苓多糖含量Table 5 Content of poria cocos polysaccharide by ultrasonic extraction
2)两种提取法提取的茯苓多糖中蛋白质分析。如图1-B,在200 nm~400 nm的波长范围内对茯苓多糖进行紫外扫描,光谱显示茯苓多糖具有多糖特征性的紫外吸收图谱。多糖在200 nm处均有强多糖吸收峰,大于250 nm无明显的紫外吸收。蛋白质特征吸收峰在280 nm,核酸在260 nm附近,多糖在260 nm及280 nm处无明显的特征吸收峰。结果表明,茯苓多糖中不含核酸、蛋白质。
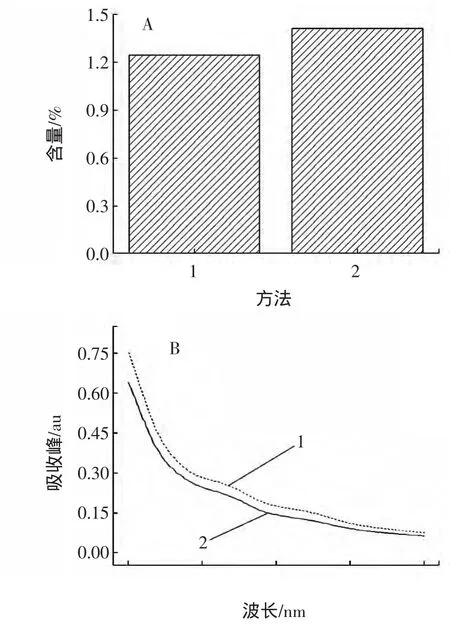
图1 两种提取法所得茯苓多糖比较Fig.1 Comparation of poria cocos polysaccharide by two extraction method
3)两种提取法提取的茯苓多糖的FTIR分析。
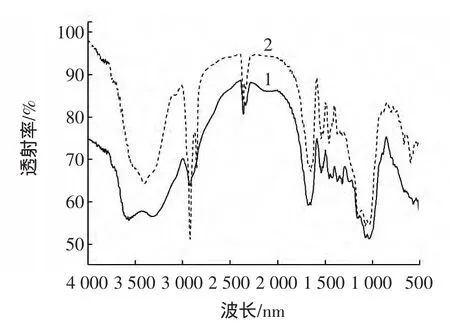
图2 两种提取法所得茯苓多糖的红外图谱Fig.2 The FTIR spectrums of poria cocos polysaccharide by two extraction method
从图2中可以看出,两种提取方法所得水溶性茯苓多糖的红外吸收谱型基本相同,在 3383.9 cm-1处出现了一个宽峰,是O-H的伸缩振动,是表示在多糖间存在分子内和分子间氢键;在 2800 cm-1~3000 cm-1范围的吸收峰是糖类的特征峰,茯苓多糖有在2934.2cm-1处的吸收峰,是由多糖分子的C-H伸缩振动引起的。 1429.1 cm-1是羧基的C-O伸缩振动引起的吸收峰,1368.3 cm-1处弱的吸收峰为C-H的变角运动引起的,762.74 cm-1处是D-葡萄吡喃糖环C-O-C的振动吸收峰,1044 cm-1~1079 cm-1附近出现的吸收峰是常见的吡喃糖环内酯和羟基的共振吸收峰,是由C-O-C醚键的不对称伸缩振动引起的,是糖类的特征吸收峰,也是葡萄糖的红外光谱信号。不同的是,二者确定吸收峰处的峰形(高度和宽度)略有差异,这可能是由于水溶性茯苓多糖超分子结构体系中的分子内和分子间氢键发生变化所导致。
4 结论
超声波提取法与索氏回流提取法所提取的茯苓多糖量相差无几,相比而言超声波处理能够破坏茯苓细胞结构,促使多糖更多更快地转移至提取溶剂中,从而提高提取效率,故超声波提取迅速、方法简便易行。
[1] 陈春霞.茯苓多糖体的药理药化研究及其临床应用的初探[J].中草药,1985,16(4):40-44
[2] 孙元琳,杨萍芳,吴海霞,等.水法提取当归多糖工艺条件优化[J].中国食品学报,2009,9(5):130-134
[3] 张颖.对茯苓多糖提取方法的比较研究[J].中国实用医药,2012,2(4):249-250
[4] 霍文,孙广利,刘鹏.正交试验法优选茯苓多糖提取工艺[J].西北药学杂志,2006,2(1):18-19
[5] 赵子剑,陈迪钊,连琰,等.均匀设计法优化超声波提取茯苓多糖工艺条件的研究[J].时珍国医国药,2009,20(2):325-326
