右美托咪啶在胃管置入术中的临床应用
2014-12-13王绍林刘小彬程庆余张晶晶
殷 骏,王绍林,刘小彬,俞 蕾,张 进,王 斌,陈 俊,程庆余,何 磊,张晶晶
(安徽省芜湖市第二人民医院麻醉科,安徽芜湖 241000)
留置胃管是消化系统手术前的一项重要准备工作。传统方法是于术晨在病房内,患者处于清醒状态时进行。其不仅让患者感到恐惧和痛苦,且胃管置入失败率也高。如在全麻后盲探置入胃管,因患者无主动吞咽,常需反复多次置管,可导致损伤。右美托咪啶是一种α2肾上腺素能受体激动剂,不仅有良好的镇静、镇痛作用,而且容易唤醒、无呼吸抑制[1]。为了消除患者恐惧心理,减轻患者痛苦,舒适便捷地完成胃管置入术,本研究拟于术前在手术室内,将右美托咪啶运用胃管置入术中,观察该方法的安全性与可行性。
1 资料与方法
1.1 一般资料 经医院伦理委员会同意,并和患者签署临床研究知情同意书,选择60例拟行消化系统择期手术的全麻患者,年龄40~65岁,体重45~65 kg,ASAⅠ~Ⅱ级。排除标准:控制不佳的高血压、肝肾脑血管疾病、糖尿病、哮喘、慢性阻塞性肺部疾病、认知功能障碍、长期服用镇静药、Mallampati分级Ⅲ~Ⅳ、窦性心动过缓、房室传导阻滞。采用随机数字表法将60例患者分成两组。A组为右美托咪啶组(n=30),B组为对照组(n=30)。
1.2 麻醉方法 术前常规肠道准备,禁饮、禁食8 h,无术前用药。患者入室后常规开放静脉,采用多功能监护仪(SL2700,Spacelab,美国)监测心率(HR)、心电图(ECG)、脉搏血氧饱和度(SpO2)。在局麻下,行左桡动脉穿刺置管监测有创动脉血压(IBP)。A组静脉泵注右美托咪啶1 μg·kg-1(生产批号:12011734,江苏恒瑞医药股份有限公司),稀释至10 mL,10 min泵完。B组静脉泵注生理盐水10 mL,10 min泵完。两组患者均使用微量输液泵(PILOTE,AstraZeneca,英国)。泵注结束后,开始留置胃管。
1.3 操作方法 A、B两组患者均由同一位不知情麻醉医师使用相同方法置入胃管。采用一次性PVC胃管(产品规格:16Fr),无菌液体石蜡油润滑胃管后,经一侧鼻腔轻柔插入,进入15~16 cm达咽喉部,抬高患者头部,使下颌贴近胸骨柄,嘱患者做吞咽动作,迅速插入食道至45~55 cm刻度处,抽吸胃管判断其位置正确后,固定胃管。
1.4 监测指标 在患者入室时(T0)、胃管置入前(T1)、胃管置入口腔时(T2)、胃管置入成功时(T3),记录收缩压(SBP)、舒张压(DBP)、心率(HR)。记录胃管置入操作用时,从胃管进入一侧鼻腔开始计时,至固定胃管时结束。记录胃管置入一次成功的例数,一次成功为置管顺利,中途无往返操作。观察患者留置胃管相关不良反应(恶心、呕吐、呛咳、流泪、黏膜损伤)。固定胃管后,采用舒适度评级判定患者在胃管置入过程中的舒适程度:Ⅰ级为舒适,Ⅱ级为轻度不适,Ⅲ级为中度不适,Ⅳ级为重度不适。
1.5 统计学分析 应用SPSS 11.5统计软件进行数据处理,计量资料以均数±标准差(±s)表示,采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料的比较 A、B两组患者例数、年龄、性别组成、体重、ASA分级比较差异无统计学意义(P>0.05)(表1)。
表1 两组患者一般资料的比较(±s)

表1 两组患者一般资料的比较(±s)
组别 例数/例年龄/岁男/女体重/kg ASA分级(级,Ⅰ/Ⅱ)A组30 55.2 ±11.1 18/12 48.8 ±4.4 7/23 B组30 54.9 ±10.5 16/14 49.2 ±4.8 9/21
2.2 两组患者血流动力学的比较 B组 T2、T3时 SBP、DBP、HR 显著高于 B 组 T0时 SBP、DBP、HR(P <0.05)。A组 T2、T3时 SBP、DBP、HR 均显著低于 B 组 T2、T3时 SBP、DBP、HR(P <0.05)。其他时点两组 SBP、DBP 和 HR 差异无统计学意义(P>0.05)(表2)。
表2 两组患者血流动力学的比较(±s)
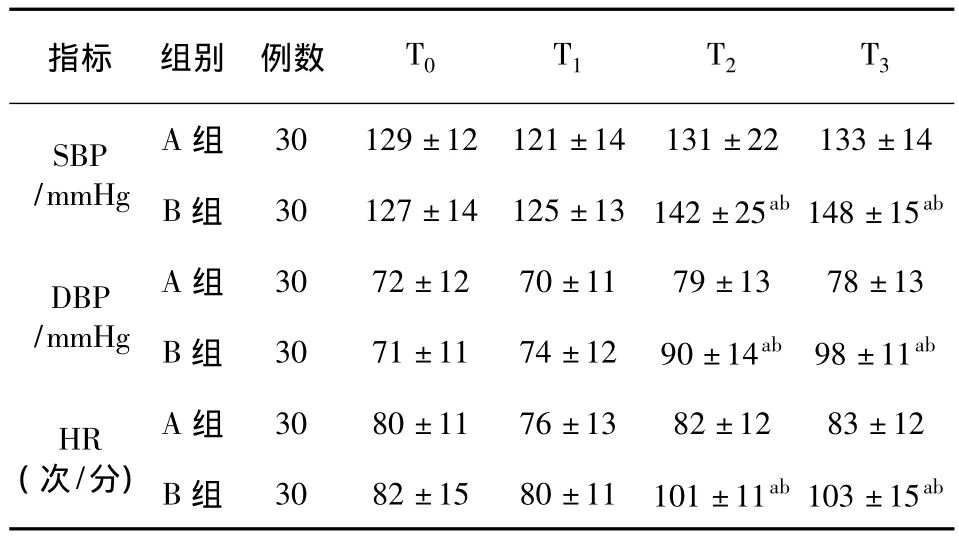
表2 两组患者血流动力学的比较(±s)
注:与 T0比较,aP <0.05;与 A 组比较,bP <0.05。
指标 组别 例数 T0 T1 T2 T3 SBP/mmHg A组 30 129±12 121±14 131±22 133±14 B组 30 127±14 125±13 142±25ab148±15ab A组 30 72±12 70±11 79±13 78±13 B组 30 71±11 74±12 90±14ab 98±11ab HR(次/分)DBP/mmHg A组 30 80±11 76±13 82±12 83±12 B组 30 82±15 80±11 101±11ab103±15ab
2.3 两组患者胃管置入操作用时的比较 A组患者胃管置入操作用时显著少于B组(P<0.05)(表3)。
表3 两组患者胃管置入操作用时的比较(±s)

表3 两组患者胃管置入操作用时的比较(±s)
注:与 A 组比较,aP <0.05。
组别 例数 胃管置入操作用/s A组30 122±18 B组 30 201±11a
2.4 两组患者胃管置入一次成功例数及不良反应的比较 A组患者胃管置入一次成功例数显著多于B组(P<0.05)。A组患者留置胃管发生相关不良反应(恶心、呕吐、呛咳、流泪、黏膜损伤)的例数显著少于B组(P<0.05)(表4)。
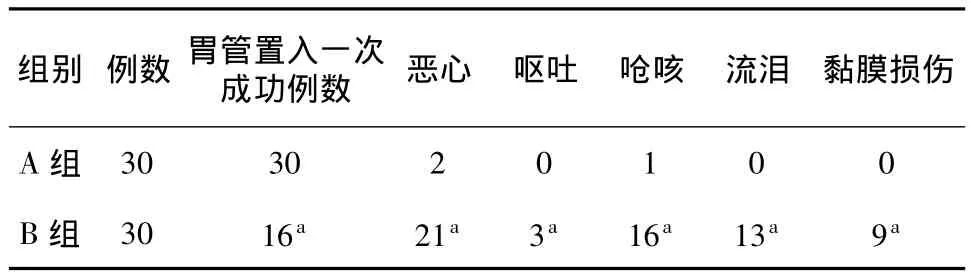
表4 两组患者胃管置入一次成功例数及不良反应比较(例)
2.5 两组患者舒适度评级的比较 A组患者舒适度评级为Ⅰ级的例数显著多于B组(P<0.05),而B组患者舒适度评级为Ⅱ级、Ⅲ级、Ⅳ级的例数显著多于A组(P<0.05)(表5)。
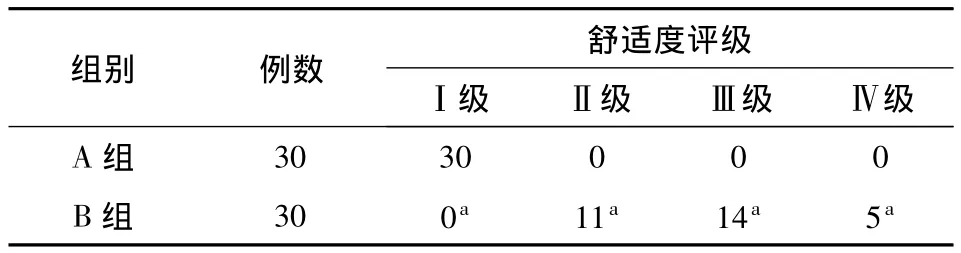
表5 两组患者舒适度评级的比较(例)
3 讨论
置入胃管是一项临床常规操作,广泛应用于消化系统疾病的防治中。传统方法是患者在清醒状态下,操作者持续插入胃管通过鼻孔、咽喉、食道到达胃内。由于大脑意识对于吞咽非食物(如胃管)有排斥,胃管通过咽喉进食道较困难,常发生胃管盘曲在口咽部,导致置管失败。此过程产生强烈的机械刺激,易导致患者呛咳、恶心、呕吐、疼痛以及鼻腔、咽喉黏膜损伤,甚至导致食道撕裂伤。术前禁食患者的咽部干燥,增加了胃管置入阻力。如果第一次置管失败,患者因组织损伤和恐惧心理将给再次置管造成更大困难。
舒适化医疗是顺应社会进步和时代发展的要求[2],本研究将右美托咪啶运用于留置胃管术中。
右美托咪啶是美托咪啶的右旋异构体,属于咪唑类衍生物,作用时间较短,静脉注射的分布半衰期约为6 min,消除半衰期约为2.0~2.5 h,蛋白结合率为94%,分布容积为1.33 L·kg-1。主要由肝脏代谢,肝功能受损导致消除率下降,变异度加大,肝功能损伤患者用量应减少。肾功能损害患者右美托咪啶的血浆蛋白结合率和药代动力学参数未改变,用量不需减少[3]。
右美托咪啶是一种新型高选择性α2肾上腺素受体激动剂,其与α2和α1受体亲和力比为1 620∶1。α2肾上腺素受体主要分布于中枢神经系统的肾上腺素神经元和交感神经末梢,激活后抑制去甲肾上腺素释放,降低血液中儿茶酚胺浓度。α2肾上腺素受体有 α2A,α2B,α2C三种亚型。α2A受体亚型介导了镇静、遗忘、镇痛、抗交感作用,α2B受体亚型可引起血压短暂升高反应,α2C受体亚型介导了抗焦虑作用[4]。右美托咪啶具有镇静、镇痛和抗焦虑等临床作用[5]。
研究认为,右美托咪啶产生镇痛作用的机制为,其结合脊髓后角一级神经元突触前膜及二级神经元突触后膜α2受体,激活细胞内第二信使,开放K+通道,使细胞膜超极化,降低细胞内Ca2+浓度,抑制一级神经元P物质释放,抑制二级神经元产生动作电位,于突触处阻止伤害性信息传递。研究发现[6],术前肌注右美托咪啶2.5 μg·kg-1,患者围术期循环波动小,氧耗和机体能耗降低,二氧化碳生成减少。本研究中,在胃管置入过程中,A组较B组血流动力学波动小,不良反应轻。舒适度评级A组优于B组。
右美托咪啶是无呼吸抑制且容易唤醒合作的镇静药物[7]。研究发现,1 μg·kg-1右美托咪啶与 0.08 mg·kg-1咪唑安定镇静及抗焦虑的效果相当。在清醒患者颈动脉内膜切除术中使用右美托咪啶,患者术中平稳安静配合[8]。右美托咪啶无呼吸抑制作用。一项健康志愿者的研究[9]发现,靶控输注右美托咪啶8 μg·L-1(静脉用量的5~10倍),患者呼吸动力未明显减弱。研究发现[10],右美托咪啶作用于第四脑室旁蓝斑核产生镇静,镇静可能机制是:(1)减弱中枢交感神经活性,抑制去甲肾上腺素释放,降低突触后膜兴奋性。(2)通过介导G蛋白产生3种效应:①抑制腺苷酸环化酶,降低细胞内cAMP聚集;②激活钾离子通道,促进钾离子外流,致细胞膜超极化,产生突触后抑制;③抑制神经末梢钙离子内流,递质释放减弱,导致突触前抑制。右美托咪啶产生的镇静催眠反应与其它镇静药物不同,为自然非动眼睡眠(NREM),存在唤醒功能[11]。通过磁共振检查,对健康志愿者的交叉研究发现,右美托咪啶麻醉后与自然睡眠状态中的血流信号相似[12]。而异丙酚、咪达唑仑等药物的镇静催眠作用是通过激动γ-GABA受体产生,其催眠反应为非自然睡眠。使用右美托咪啶镇静的患者易唤醒,可与医护人员沟通、合作[13-14]。本研究中,A组胃管置入操作用时明显少于B组,A组胃管置入一次成功例数明显多于B组。
右美托咪啶具有的镇静、镇痛、抗焦虑、抑制应激等作用,患者无呼吸抑制、易唤醒合作、依从性高。在胃管置入术中使用右美托咪啶是安全可行的,并缩短了置管时间,提高了置管的成功率,改善了患者的舒适度,减少了不良反应,相对于传统方法有明显的优越性。
[1] 赵德彩,邓雪峰.右美托咪定用于眼科手术病人术中镇静的临床观察[J].安徽医药,2012,16(7):1014 -1015.
[2] Morrow SP,Abramo TJ.Dexmedetomidine sedation:uses in pediatric procedural sedation outside the operating room[J].Pediatr Emerg Care,2012,28(3):292 -296.
[3] Su F,Hammer GB.Dexmedetomidine:pediatric pharmacolog,clinical uses and safety[J].Expert Opin Drug Saf,2011,10(1):55 -66.
[4] Kanda H,Kunisawa T,Kurosawa A,et al.Effect of dexmedetomidine on anesthetic requirements in cardiovascular surgery[J].Masui,2009,58(12):1496 -1500.
[5] Abdelmalak B,Gutenberg L,Lorenz RR,et al.Dexmedetomidine supplemented with local anesthesia for awake laryngoplasty[J].J Clin Anesth,2009,21(6):442 -443.
[6] Jakob SM,Ruokonen E,Grounds RM,et al.Dexmedetomidine vs midazolam or propofol for sedation during prolonged mechanical ventilation:two randomized controlled trials[J].JAMA,2012,307(11):1151-1160.
[7] 沈 勤,肖建军.右美托咪定用于辅助臂丛神经阻滞麻醉的效果观察[J].安徽医药,2012,16(2):230 -231.
[8] Afonso J,Reis F.Dexmedetomidine:current role in anesthesia and intensive care[J].Rev Bras Anestesiol,2012,62(1):118 -133.
[9] Bajwa SJ,Kaur J,Singh A,et al.Attenuation of pessor respose and dose sparing of opioids and anesthetics with preoperative dexmedetomidine[J].Indian J Anaesth,2012,56(2):123 -128.
[10] Gerlach AT,Murphy CV,Dasta JF.An updated focused review of dexmedetomidine in adults[J].Ann Pharmacother,2009,43(12):2064-2074.
[11] Ohtani N,Yasui Y,Watanabe D,et al.Perioperative infusion of dexmedetomidine at a high dose reduces postoperative analgesic requirements:a randomized control trial[J].J Anesth,2011,25(6):872-878.
[12] Chi OZ,Hunter C,Liu X,et al.The effects of dexmedetomidine on regional cerebral blood flow and oxygen consumption during severe hemorrhagic hypotension in rats[J].Anesth Analg,2011,113(2):349-355.
[13] Boyer J.Patient agitation and dexmedetomidine[J].Nurse Pract,2010,35(10):7 -11.
[14] Keane MJ.Dexmedetomidine and procedural sedation[J].Anaesth Intensive Care,2011,39(1):133 -134.
