血清铁蛋白与绝经早期骨质疏松症的相关性研究
2014-12-09王冀苏陈治卿
王冀苏 陈治卿
厦门大学附属中山医院老年科,福建厦门 361004
从2008年Weinberg[1]提出铁过载是骨质疏松的危险因素以来,铁超载在骨质疏松症的发生、发展中的作用一直是近年来热议的话题。Yang 等[2]研究发现,绝经后女性往往产生铁过载,铁过载可抑制成骨细胞分化,导致骨形成能力下降,甚至引起骨质疏松。我国王兵等人[3]也发现绝经后女性骨铁含量较对照组明显升高。绝经后女性骨铁含量与其BMD 值呈负相关。围绝经期女性已经存在雌激素水平的下降,发生骨质疏松症的危险因素增加,该研究对2012年8月—2013年12月期间该院收治的绝经早期骨质疏松症女性患者的血清铁蛋白水平及骨代谢指标进行研究,从临床角度进一步了解血清铁蛋白对骨代谢可能产生的影响,探讨老年女性骨质疏松症的预防措施。现报道如下。
1 资料与方法
1.1 一般资料
该研究纳入2012年8月—2013年12月该科收治的绝经早期女性136 例。纳入标准:①年龄在50~55 岁的绝经早期女性;②双能X 线骨密度检测,T 值≤-2.5SD 为骨质疏松症(WHO 骨质疏松症诊断标准),分为正常对照组、骨量减少组、骨质疏松组。排除标准:①外伤性骨折;②合并急性应激状态(如急性感染、甲亢危相等),慢性肝病、慢性肾病、心血管疾病、类风湿性关节炎、内分泌疾病、肿瘤疾病、血液系统疾病;③长期服用双膦酸盐、降钙素等影响骨代谢药物治疗。
1.2 骨密度检测
采用美国Lunar 公司DPX-NP 双能X 线骨密度仪。XR--NP 双能X 线骨密度仪是目前世界上技术最先进,临床应用最广泛的骨密度测量技术,它由机架、X 射线发生装置、探测器、控制装置等组成。性能:管电压分35 kV、75 kV 两档调节,管电流为0.8 mA,成像分辨率应≥0.4 mm,骨密度重复精度:CV≤1%。它可以满足多方面的临床和科研需求。可以按要求校准精确度、准确度;测定部位:股骨颈和腰椎(L1~L4),自动生成T 值;T 值≥-1.0SD 为正常,T 值在-1.0SD-2.5 SD 之间为骨量减低,根据T 值分为骨密度正常组、骨量减少组、骨质疏松组。
1.3 方法
三组均给于清晨抽空腹血,血样立即离心,血清存于4℃冰箱,6 h 内检测。测定血清Fer、ALP、β-CTX、BGP、PTH、25-OHD及生化指标。对骨质疏松组。患者进行为期6 个月的碳酸钙、骨化三醇、降钙素治疗,比较治疗前后血清Fer、ALP、β-CTX、BGP、PTH、25-OHD 的变化。
1.4 统计方法
采用SPSS17.0 统计软件对数据进行统计分析,计量资料以均数±标准差(±s)表示。3 组之间均数比较采取单因素方差分析。血清铁蛋白与骨代谢指标之间的相关性采用偏相关分析,治疗前后骨代谢指标的变化用配对资料采用t 检验。
2 结果
3 组观察对象的一般资料比较:该研究纳入对象136 例,经骨密度检测诊断骨量正常者45 例,骨量减少组35 例,骨质疏松组56 例,骨质疏松组的身高明显低于骨量正常者,差异有统计学意义。与骨量正常组比较,骨质疏松组的血清Fer、ALP、β-CTX、BGP明显升高,差异有统计学意义,见表1。
校正身高、体重、体重指数(BMI)、C 反应蛋白(CRP)因素后,对血清铁蛋白与骨代谢指标所做的偏相关性分析可见:血清铁蛋白与β-CTX、BGP 呈正相关,与骨密度呈负相关,差异有统计学意义,与25-OHD 有一定相关性,但差异无统计学意义,见表2。
表1 3 组对象一般情况(±s)

表1 3 组对象一般情况(±s)
注:与正常骨量组比较,*P<0.05;与低骨量组比较,#P<0.05。
变量骨量正常组(n=45)骨量减少组(n=35)骨质疏松组(n=56)身高(cm)体重(kg)BMI(kg/cm2)CRP(mg/L)Fer( ng/mL)ALP(U/L)PTH(pg/mL)β-CTX(ng/mL)BG(ng/mL)25-OHD(nmol/L)158.2±4.6 57.8±9.2 24.1±3.5 1.97±6.4 128.5±17.6 69.3±12.4 28.2±12.6 0.26±0.05 12.4±3.7 64.3±12.9 155.9±5.7 58.4±5.0 23.6±4.9 2.69±3.2(224.7±22.0)*(72.6±19.1)*32.2±10.9(0.42±0.08)*(19.2±2.9)*60.5±18.6(152.3±3.9)*54.6±7.5 22.7±4.9 2.82±2.6(352.2±137.7)*#(82.8±23.9)*34.7±9.5(0.54±0.16)*#(23.1±9.7)*50.8±30.6
对骨质疏松组患者给予为期6 个月的碳酸钙、骨化三醇、降钙素治疗,比较治疗前后血清Fer、ALP、β-CTX(β 胶原系列)、BGP(骨钙素)、PTH(甲状旁腺激素)、25-OHD(25 羟维生素D)的变化。其中β-CTX 治疗前后有明显变化,而血清Fer、BGP 水平较治疗前虽有下降,但差异无统计学意义,而ALP、PTH、25-OHD与治疗前比较差异无统计学意义。

表2 以Fer 为自变量,骨代谢指标为因变量的偏相关性分析
表3 对骨质疏松症患者进行为期6月治疗前后血清铁蛋白的变化(±s)
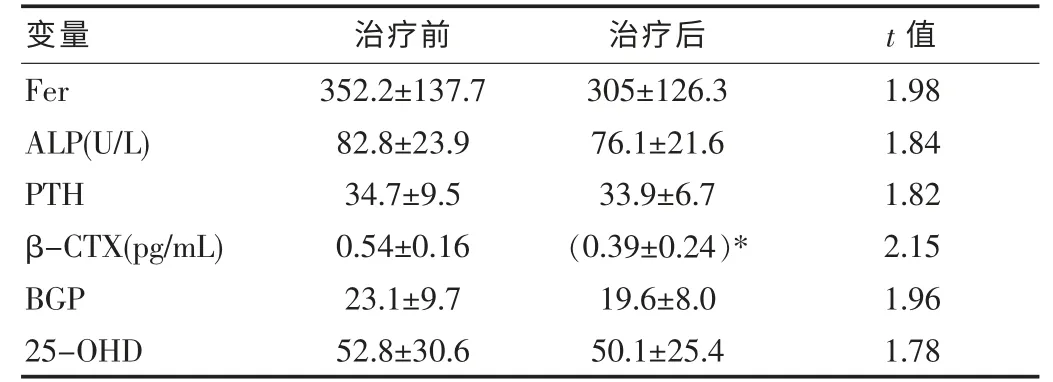
表3 对骨质疏松症患者进行为期6月治疗前后血清铁蛋白的变化(±s)
注:* 表示与治疗前相比差异有统计学意义,P<0.05。
变量治疗前治疗后t 值Fer ALP(U/L)PTH β-CTX(pg/mL)BGP 25-OHD 352.2±137.7 82.8±23.9 34.7±9.5 0.54±0.16 23.1±9.7 52.8±30.6 305±126.3 76.1±21.6 33.9±6.7(0.39±0.24)*19.6±8.0 50.1±25.4 1.98 1.84 1.82 2.15 1.96 1.78
3 讨论
由于对校正身高、体重、体重指数(BMI)、C 反应蛋白(CRP)因素后,对血清铁蛋白与骨代谢指标所做的偏相关性分析可见:血清铁蛋白与β-CTX、BGP 呈正相关,与骨密度呈负相关,差异有统计学意义。铁过载可引起骨微结构、骨成分改变及骨量下降[4],铁是脂质过氧化反应促进剂,通过产生氧自由基触发氧化应激反应。氧化应激激活破骨细胞、抑制成骨细胞及骨形成来影响骨代谢平衡,引起骨质疏松症。该研究纳入对象为绝经早期骨质疏松患者,在围绝经期随着雌激素水平的下降,继发甲状旁腺功能亢进症,降钙素分泌不足,从而导致骨吸收量大于骨形成量,触发随后的骨代谢异常。Yamasaki 等[5]研究发现,铁过载可抑制成骨样细胞代谢、分化,使骨形成能力降低。目前国内外均有学者证实绝经后的女性血清铁蛋白水平与年龄呈正相关[6-7],并且血清铁蛋白水平在50~70 岁间迅速升高[8]。这有可能是绝经后女性发生骨质疏松的重要原因之一。
对骨质疏松组患者给予为期六个月的碳酸钙、骨化三醇、降钙素治疗,比较治疗前后的变化。研究结果也证明在50~55 岁年龄段女性骨质疏松症组的血清铁蛋白水平有明显升高,并且和骨密度呈负相关,提示绝经后体内铁超载现象可能导致骨代谢异常。在骨质疏松发生的早期,骨转换率明显加速,结果导致大量的骨流失。该研究结果显示,骨质疏松组的骨代谢指标ALP、β-CTX、BGP 较骨量正常组均有明显升高。
β-CTX 是评价破骨细胞活性和骨吸收最有价值的方法[9],血清BGP 主要由成骨细胞产生和分泌,可直接反映骨形成的状况。在骨质疏松早期,刚合成BGP 不能正常沉积到骨矿导致其进入血液的量增加,导致血清BGP 值增高;而到骨质疏松后期,成骨细胞功能衰退,合成BGP 的量减少。
同时,该研究中发现骨质疏松组的血清β-CTX 和BGP 升高,反应了绝经早期成骨和破骨活动均表现活跃。该研究对血清铁蛋白与骨代谢指标所做的偏相关性分析可见:血清铁蛋白与β-CTX、BGP 呈正相关,与骨密度呈负相关,提示血清铁蛋白与骨转换过程增强存在相关性。对骨质疏松组患者给予为期3 个月的碳酸钙、骨化三醇、降钙素治疗后可见血清β-CTX 水平较治疗前下降,差异有统计学意义,这与降钙素降低破骨细胞活性的作用机制相符。而血清铁蛋白、ALP、BGP 虽有下降,但无统计学意义,考虑与观察时间较短、样本量受限有关。
综上所述,绝经早期骨质疏松症患者的血清铁蛋白有明显升高;绝经早期骨质疏松症患者血清铁蛋白与β-CTX、BGP 呈正相关,与骨密度呈负相关;给予补钙、促进钙吸收、抑制破骨细胞活性治疗后可以降低血清β-CTX 水平,血清铁蛋白水平可能有下降趋势。高血清铁内环境是诱发女性骨质疏松的独立危险因素,血清铁蛋白水平可能成为监测绝境后骨质疏松症发生的临床指标。
[1]Weinberg ED.Role of iron in osteoporosis[J].Pediatr Endocrinol Rev,2008(6):81-85.
[2]Yang Q,Jian J,Abramson SB,et al.Inhibitory effects of iron on bone morphogenetic protein 2-induced osteoblastogenesis[J].J Bone Miner Resea,2011,26(6):1188-1196.
[3]王兵,赵环,姜习凤.绝经后女性股骨头铁含量与骨密度的相关性[J].中华骨质疏松和骨矿盐疾病杂志,2013(6):9-13.
[4]Tsay J,Yang Z,Ross FP,et al.Bone loss caused by iron overload in a murine model:importance of oxidative stress[J].Blood,2010,116(14):2582-2589.
[5]Yamasaki K,Hagiwara H.Excess iron inhibits osteoblast metabolism[J].Toxicology letters,2009,191(2-3):211-215.
[6]Kato I,Dnistrian AM,Schwartz M,et al.Risk of iron o-verload among middle-aged women[J].Int J Vitam Nutr Res,2000(70):119-125.
[7]张林林,郑闽前,徐小卒.435 名女性体检者血清铁蛋白与骨密度的相关性[J].中华骨质疏松和骨矿盐疾病杂志,2014(7):9-14.
[8]Zacharski LR,Ornstein DL,Woloshin S,et al.Associa- tion of age,sex,and race with body iron stores in adults:analysis of NHANES III data[J].Am Heart J,2000(140):98-104.
[9]SRIVASTAVA A K,MACFARLANE G,SRIVASTAVA V P,et al. A new monoclonal antibody ELISA for detection and character-ization of C-telopeptide fragments of type Ⅰcollagen in urine[J].Calcif Tissue Int,2001,69(6):327-336.
