醋制降低京大戟细胞毒性部位对小鼠肝脏氧化损伤机制研究
2014-12-07曹雨诞陈海鹰丁安伟
曹雨诞,陈海鹰,张 丽,丁安伟
(南京中医药大学,江苏省方剂高技术研究重点实验室,江苏南京 210046)
京大戟为大戟科植物大戟(Euphorbia pekinensisRupr.)的干燥根[1],始载于《神农本草经》,列为下品,为中医临床常用的峻下逐水药。其性寒,味苦,有毒。由于其生品毒性较大,故采用醋制法降低京大戟的毒性,缓和其泻下作用[2]。本课题组前期实验已经证实京大戟的细胞毒性部位为石油醚、乙酸乙酯部位[3],但有关醋制降低京大戟毒性作用的物质基础和作用机制尚缺乏明确的揭示。因此,本实验拟采用整体动物模型,通过多次给予小鼠京大戟生品和醋品细胞毒性部位提取物,比较醋制前后对小鼠的肝组织形态和氧化损伤的影响,初步探讨醋制降低京大戟对小鼠肝毒性的作用机制,以期为进一步研究京大戟醋制减毒的物质基础及作用机制提供依据。
1 仪器与材料
1.1 动物 ICR小鼠70只,♀♂各半,体质量18~22 g,购自浙江省实验动物中心,合格证号:SCXK(浙)2008-0033。
1.2 药物 京大戟饮片购于安徽省亳州市药材总公司,经南京中医药大学乐巍副教授鉴定为大戟科植物大戟Euphor-bia pekinensisRupr.的块根。京大戟生品:取净京大戟饮片2 kg,打粉;京大戟醋品:取净京大戟饮片2 kg,用米醋600 g闷润,加水稀释至3 000 ml,继续闷润,文火煮沸至醋吸净,取出,室温晾干,40℃减压干燥,打粉。
将京大戟生品和醋品粗粉(过2号筛)以6倍量乙醇回流提取3次,回收乙醇提取液,得到京大戟生、醋品醇提浸膏(得率分别为13.65%和15.64%),醇提浸膏用水悬浮,悬浮物依次用石油醚、乙酸乙酯萃取,得到京大戟生、醋品石油醚部位和乙酸乙酯部位混合浸膏(得率分别为10.12%和9.01%)。临用前,用0.5%的CMC-Na溶液和食用油(9∶1)分别配成所需浓度的药液。
1.3 试剂 谷丙转氨酶(ALT)测定试剂盒、谷草转氨酶(AST)测定试剂盒、乳酸脱氢酶(LDH)测定试剂盒、BCA蛋白测定试剂盒、超氧化物歧化酶(SOD)测试盒、微量丙二醛(MDA)测定试剂盒、微量还原型谷胱甘肽(GSH)测定试剂盒,购自南京建成生物工程研究所。
1.4 仪器 TP1020自动脱水机、RM2135型石蜡切片机、DM1000光学显微镜(均为德国LEICA公司),CS-VI型摊片烤片机(湖北孝感宏业医用仪器有限公司),Tissue-Tek TEL组织包埋机(日本SAKURA公司),powerwave X340全波长酶标仪(美国Bio-Tek公司),AY220电子分析天平(日本岛津),TGL-16M高速台式冷冻离心机(长沙湘仪离心机仪器有限公司)。
2 方法
2.1 动物分组 小鼠按体重随机分为7组,即空白对照组,京大戟生品细胞毒性部位高、中、低剂量组,京大戟醋品细胞毒性部位高、中、低剂量组,每组10只。实验动物饲养于室温、通风的清洁级动物室中,自由摄食饮水,适应性饲养3 d。2.2 剂量设计 按照人临床用量的6、4、2倍,并结合本课题组前期预试结果,本实验京大戟生品和醋品高、中、低剂量组分别灌胃给予60、40、20 mg·g-1,空白对照组灌胃等体积的0.5%CMC-Na溶液和食用油(9∶1),每日两次,连续灌胃6 d。
2.3 肝功能指标测定 末次给药后,禁食16 h,不禁水,小鼠称重,摘眼球取血,待血清析出后,3 500 r·min-1,10 min,分离血清,按照试剂盒说明书,进行ALT、AST、LDH活性的测定。
2.4 肝脏氧化损伤指标测定 称取0.5 g肝组织,加入预冷的0.9%生理盐水,冰浴匀浆,制成10%肝组织匀浆,3 500 r·min-1,10 min,吸取上清,用 BCA 法测定蛋白含量,按照试剂盒说明书测定SOD活性、MDA含量、GSH含量。
2.5 统计学处理 实验数据采用SPSS 17.0软件进行统计分析,各组定量检测数据以±s表示,组间比较采用LSD检验。
Tab 1 Effects of Euphorbia Pekinensis before and after processed with vinegar on the activities of ALT,AST,LDH on liver function and the levels of SOD,GSH and MDA in liver tissue(±s,n=10)
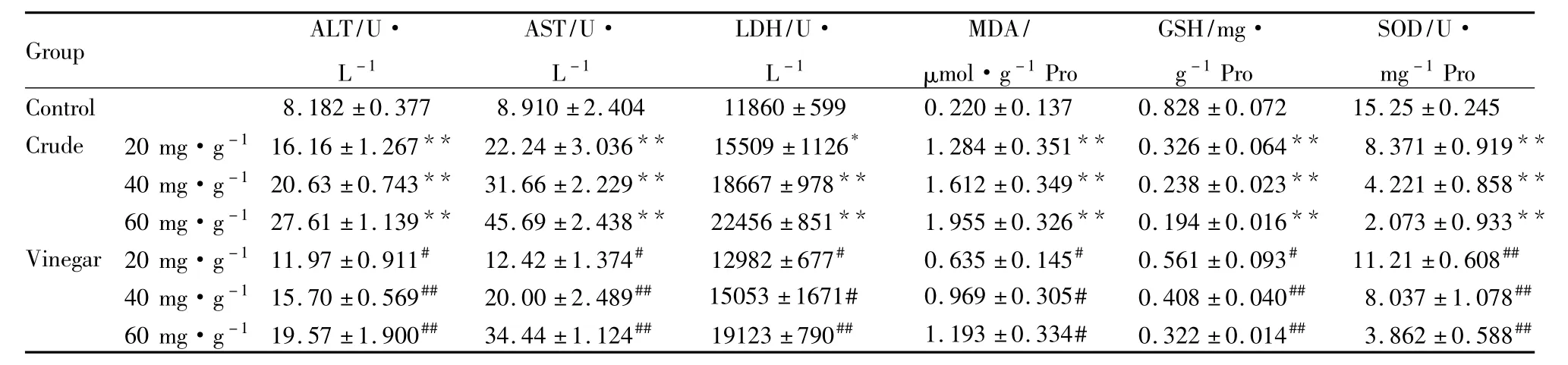
Tab 1 Effects of Euphorbia Pekinensis before and after processed with vinegar on the activities of ALT,AST,LDH on liver function and the levels of SOD,GSH and MDA in liver tissue(±s,n=10)
*P <0.05,**P <0.01 vs control;#P <0.05,##P <0.01 vs Crude
Group ALT/U·Pro Control 8.182 ±0.377 8.910 ±2.404 11860 ±599 0 L-1 AST/U·L-1 LDH/U·L-1 MDA/μmol·g-1Pro GSH/mg·g-1Pro SOD/U·mg-1.220 ±0.137 0.828 ±0.072 15.25 ±0.245 Crude 20 mg·g-116.16 ±1.267** 22.24 ±3.036** 15509 ±1126* 1.284 ±0.351** 0.326 ±0.064** 8.371 ±0.919**40 mg·g-120.63 ±0.743** 31.66 ±2.229** 18667 ±978** 1.612 ±0.349** 0.238 ±0.023** 4.221 ±0.858**60 mg·g-127.61 ±1.139** 45.69 ±2.438** 22456 ±851** 1.955 ±0.326** 0.194 ±0.016** 2.073 ±0.933**Vinegar 20 mg·g-111.97 ±0.911# 12.42 ±1.374# 12982 ±677# 0.635 ±0.145# 0.561 ±0.093# 11.21 ±0.608##40 mg·g-115.70 ±0.569## 20.00 ±2.489## 15053 ±1671# 0.969 ±0.305# 0.408 ±0.040## 8.037 ±1.078##60 mg·g-119.57 ±1.900## 34.44 ±1.124## 19123 ±790## 1.193 ±0.334# 0.322 ±0.014## 3.862 ±0.588##
3 结果
3.1 一般情况观察 空白对照组小鼠未见明显异常,京大戟生品和醋品给药组小鼠均表现出少食、少动、精神不佳、毛发无光泽、下腹肿胀、体重降低等症状,并随给药剂量增加而症状加重。
3.2 京大戟醋制前后对小鼠肝功能的影响 与空白对照组比较,60、40、20 mg·g-1京大戟生品均明显升高小鼠血清中ALT、AST、LDH活力(P<0.05),且呈一定的剂量相关性;与生品各剂量组比较,醋品各浓度组可明显降低小鼠血清中ALT、AST、LDH活力(P<0.05),呈一定的剂量相关性,见Tab 1。
3.3 京大戟醋制前后对小鼠肝脏氧化损伤指标的影响 与空白对照组比较,60、40、20 mg·g-1京大戟生品可明显降低小鼠肝脏中SOD活性和GSH含量(P<0.01),增加小鼠肝脏中MDA含量(P<0.05),且呈一定的剂量相关性;与生品各浓度组比较,醋品各剂量组可明显提高小鼠肝脏中SOD活性和GSH含量(P<0.01),降低小鼠肝脏中MDA含量(P<0.05),且呈一定的剂量相关性,见Tab 1。
4 讨论
中药致肝毒性损伤时,可使血中ALT、AST活性升高[4];LDH是一种糖酵解酶,广泛存在于人体各组织器官中,LDH的释放是细胞膜受损的敏感指标之一[5],因此ALT、AST和LDH可作为评价肝损伤程度的指标[6]。氧化损伤机制是引起肝损伤的主要机制[7],主要变化为丙二醛(MDA)含量升高,超氧化物歧化酶(SOD)、谷胱甘肽(GSH)含量下降[8],因此MDA、SOD和GSH可作为肝毒性氧化损伤程度的指标。
本实验研究结果显示,与空白对照组相比,连续6 d给予小鼠不同剂量的京大戟细胞毒性部位后,小鼠血清中ALT、AST和LDH活性明显增高,且随给药剂量增加而增高,呈现一定的“量-毒”关系。小鼠肝脏中SOD活性明显下降,GSH含量明显降低,MDA含量明显增加。该结果提示京大戟细胞毒性部位致小鼠肝损伤途径可能与氧化损伤有关。
与京大戟生品组相比,连续6 d给予小鼠不同剂量的京大戟醋品细胞毒性部位后,肝功能损伤指标明显降低,氧化损伤指标减轻,这个结果与前期的京大戟细胞毒性部位对人正常肝细胞LO2毒性研究的结果相符[3]。上述结果提示醋制可明显降低京大戟肝毒性,其可能机制为通过降低京大戟对肝细胞膜通透性的影响及减轻氧化损伤而实现,这为进一步阐明京大戟醋制减毒的物质基础及作用机制提供了的一定依据。
[1]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2010版,一部:208.
[1]Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China[S].Beijing:China Medical Science Press,2010,VolumeⅠ:208.
[2]邱韵萦,郁红礼,吴 皓,等.大戟科大戟属根类中药的毒性研究进展[J].中国实验方剂学,2011,17(23):259-64.
[2]Qiu Y Y,Yu H L,Wu H.Research progress on toxicity of medicinal plants of Euphorbia[J].Chin J Exp Tradit Med Formul,2011,17(23):259-64.
[3]陈海鹰,曹雨诞,颜晓静,等.醋制降低京大戟对人正常肝细胞LO2的毒性及机制研究[J].中国中药杂志,2013,38(6):866-70.
[3]Chen H Y,Cao Y D,Yan X J,et al.Study on detoxication and mechanism of vinegar-processed Euphorbia pekinensis on normal liver cells LO2[J].Chin J Chin Mat Med,2013,38(6):866 -70.
[4]孙 蓉,杨 倩,黄 伟,等.肝功能相关指标在中药肝毒性损伤中作用与毒性相关程度分析[J].中药药理与临床,2008,24(6):82.
[4]Sun R,Yang Q,Huang W,et al.Analysis of the related indexes of liver function in liver toxicity of traditional Chinese medicine in effect and toxicity of correlation degree[J].Pharmacol Clin Chin Mat Med,2008,24(6):82.
[5]金惠铭.病理生理学[M].上海:复旦大学出版社,2005:173.
[5]Jin H M.Pathophysiology[M].Shanghai:Fudan University Press,2005:173.
[6]俸家富,涂植光.肝功能相关的血清酶学研究进展[J].医学综述,2007,13(3):225-30.
[6]Feng J F,Tu Z G.Progress of serum enzymology related to liver function[J].Med Recap,2007,13(3):225 -30.
[7]杨惠玲.高级病理生理学[M].北京:科学出版社,1998:24-30.
[7]Yang H L.Advanced pathophysiology[M].Beijing:Science Press,1998:24-30.
[8]谢京儿,廖锡麟.药物性肝损伤机制与脂质过氧化[J].中国药理学通报,1990,6(1):7.
[8]Xie J E,Liao X L.Drug induced liver injury and lipid peroxidation[J].Chin Pharmacol Bull,1990,6(1):7.