根际微生物区系与蕹菜茎叶镉含量的关系
2014-12-06刘维明白海强吕保玉
刘维明,白海强,吕保玉
(广西壮族自治区环境监测中心站,南宁 530028)
近年来,城市周围菜田的重金属镉(Cd)污染日益严重,其在土壤中的活性较强,生物有效性高,易于被植物吸收进入食物链危害人体健康[1-2]。有研究发现,人体摄入的Cd的83%来源于蔬菜[3]。Wang 等[4]报道蕹菜吸收积累 Cd 的能力较强,因此其对人类的潜在Cd污染风险比较大。Wang研究了30种不同蕹菜品种积累Cd的差异,在Cd含量为0.593~1.824 mg/kg不同浓度的土壤中,筛选到了强坤柳叶白骨其地上可食部分的Cd含量仅是台湾308纯白柳叶可食部分Cd含量的1/2~1/3。Feng等[5]的研究表明,土壤微生物数量直接影响土壤的生物化学活性,土壤微生物的活动能减低金属的植物可利用性,减少植物体内的金属含量。本文通过根箱试验,研究了2种蕹菜Cd积累典型品种的根际微生物区系,探讨根际微生物区系与Cd吸收积累的关系,为筛选、培育和利用重金属低量积累农作物品种提供理论依据。
1 材料与方法
1.1 供试蕹菜品种与土壤
供试的2个蕹菜品种为强坤柳叶白骨(QK,Cd-PSC)和台湾 308纯白柳叶(T-308,non-Cd-PSC)。
供试土壤分别采用广东省鹤山市沙坪镇青菜地中东西横基村的污灌农业土壤(高镉土壤)和农科所娃娃菜地的非污灌农业土壤(低镉土壤)。土壤基本理化性质如下:高镉土壤pH值为7.08,有机质含量为2.31%,全 N为1.61 mg/kg,速效P为476.44 mg/kg,速K为98.54 mg/kg,全 Cd为0.726 mg/kg;低镉土壤pH 值为6.77,有机质含量为3.49%,全 N为1.58 g/kg,速效P为195.92 mg/kg,速效K为192.30 mg/kg,全 Cd为0.173 mg/kg。
1.2 试验设计
试验于2012年3月22日至5月22日在南宁市蔬菜研究所的温室大棚内进行。将供试的2种土壤分别装入长20 cm、宽15 cm、高15 cm的自制根箱中,每箱4.5 kg土。设置品种和土壤2个因素为试验处理,种植2茬,每个处理重复3次,共24个根箱。
1.3 取样方法
在种植后第40 d,取第1茬样品的茎叶和根,并收集根际土和非根际土,立即密封保存于4℃冰箱中。第100 d后第2次取样,方法同前。
土样采集时,取中央室紧贴尼龙网1 mm范围内的土壤作根际土,两边非根际室的土壤混合作非根际土。土壤取出后立即装入无菌纸袋,带回实验室内。将新鲜土样研磨过1 mm筛,置于土样瓶中,在0~4℃保存备用。
1.4 测定方法
1.4.1 植物重金属含量测定
称取烘干、粉碎的样品 0.2 g,用微波消解仪(MDS-2002A,上海新仪)进行消解,样品加入5 mL HNO3(65%,V/V,优级纯)和2 mL H2O2(30%,V/V,分析纯)[6]。用原子吸收光谱仪(AAS,Hitachi Z-5300,Japan)测定Cd的含量。测样过程中采用国家标准参比物质(植物GBW-07603)进行质量控制分析,参比物质Cd的标准含量为0.057 mg/kg,测定值为0.059 mg/kg,表明样品处理方法和仪器精度能够满足本研究的要求。
1.4.2 土壤微生物数量的测定
细菌培养基为牛肉膏蛋白胨(pH值为7.0~7.2)[7];放线菌培养基为高氏合成一号琼脂培养基(pH 值为7.2 ~7.4)[8];真菌培养基为马丁孟加拉红链霉素琼脂培养基(pH值为7.0)[9]。采用稀释平板计数法进行土壤微生物的分离。细菌、真菌、放线菌的稀释浓度分别设为-6,-5,-4;-5,-4,-3和-5,-4,-3这3组。细菌平板在30~32℃恒温箱中保湿培养,真菌、放线菌平板在26~28℃恒温箱中保湿培养。每个处理步骤重复3次。细菌培养2 d后开始统计菌落数,真菌和放线菌培养4~5 d后开始统计菌落数。
2 结果与分析
2.1 蕹菜Cd积累典型品种茎叶镉含量的差异
蕹菜Cd积累典型品种间茎叶Cd含量存在极显著差异(P<0.01),见表1。由表1可知:强坤柳叶白骨的茎叶含量远小于台湾308纯白柳叶。高低镉土壤上台湾308纯白柳叶第1茬茎叶Cd含量分别是强坤柳叶白骨的1.87倍和1.6倍;第2茬分别是1.52倍和1.67倍。说明蕹菜典型品种对Cd的吸收积累存在稳定的品种间差异,不随土壤中镉浓度及其理化性质的不同或种植时间的延长而变化。
试验结果再现了不同品种对Cd的吸收特性,说明Cd吸收能力是稳定的,属于受遗传控制的品种种性。

表1 蕹菜Cd积累典型品种茎叶镉Cd含量 mg/kg
2.2 根系微生物总数变化与蕹菜Cd积累典型品种茎叶镉含量的关系
由图1可见,在Cd污染土壤中,微生物总数与低积累品种QK茎叶Cd含量变化趋势相反,经统计检验,两者显著水平达到p=0.096,说明随着品种QK根系微生物总数的下降,其茎叶Cd含量显著上升。微生物总数与高积累品种T-308茎叶Cd含量变化趋势相同,经检验达到p=0.067的显著水平,说明随着品种T-308根系微生物总数的减少,茎叶Cd含量显著降低。由此可见,在污染土壤中,根系微生物总数对2个典型品种茎叶Cd含量有较显著的影响,对低积累品种QK起抑制作用,对高积累品种T-308起促进作用。富集系数或直线斜率均表明根系微生物对低积累品种QK的影响大于对高积累品种T-308的影响。
在对照土壤上,两个典型品种根系微生物总数与茎叶Cd含量变化趋势相反,经检验,对低积累品种QK的抑制作用达到极显著(P<0.01)水平,对高积累品种T-308的影响达到显著(P<0.05)水平。
无论在污染土壤中还是在对照土壤中,根系微生物对低积累品种QK茎叶Cd积累的作用均大于对高积累品种T-308Cd积累的作用。
2.3 3类微生物数量变化与蕹菜Cd积累典型品种茎叶镉含量的关系
由图2可见,在Cd污染土壤上,对低积累品种QK来说,从第1茬到第2茬细菌、真菌数量的变化与其茎叶Cd含量变化趋势相反,而放线菌数量与其茎叶Cd含量变化趋势相同,即当细菌下降31.22%、真菌下降6.03%、放线菌上升了15.77%时,茎叶镉含量上升了11%,说明随着品种QK根系细菌、真菌数量的下降及放线菌数量的上升,茎叶Cd含量显著上升,且3类微生物对茎叶镉含量的影响大小顺序为:真菌>放线菌>细菌。也有研究表明真菌通过改变重金属在植物体的分配改变重金属在植物体的富集,提高植物对重金属的耐性,将重金属固定在根部[10],促进重金属从根部向地上部的转运[11]。
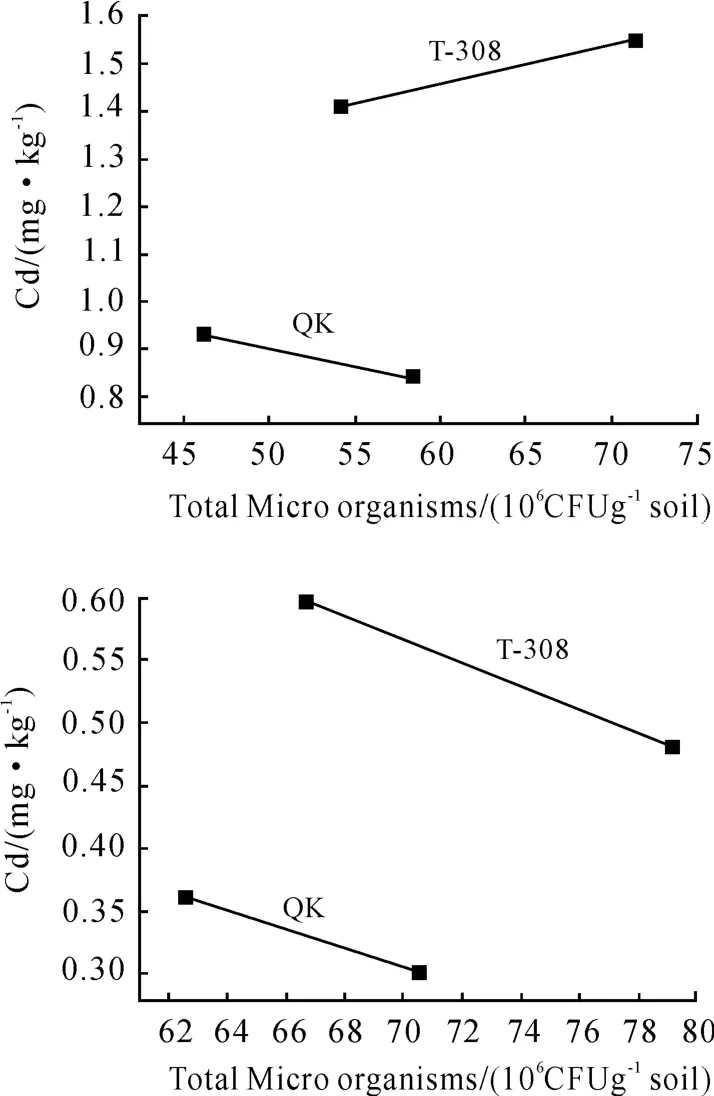
图1 根系微生物数量变化与蕹菜茎叶镉含量的关系
对于高积累品种T-308来说,细菌、放线菌数量的变化与其茎叶Cd含量变化趋势相同,真菌与其茎叶镉含量变化趋势相反,即当细菌下降26.56%,真菌上升53.11%,放线菌下降38.35%时,茎叶镉含量下降了9.9%,说明随着品种T-308根系细菌和放线菌数量的减少,真菌数量的增加,茎叶Cd含量显著降低,且3类微生物对茎叶镉含量的影响大小顺序为:细菌>放线菌>真菌。也有研究表明根际细菌的存在能够促进植物对重金属的吸收。细菌可产生一些化合物例如螯合物或络合物,促进根际土壤重金属的溶解。根际细菌刺激植物的离子转运系统,提高植物对重金属离子的转运[12],且对低积累品种影响大于对高积累品种的影响。
在对照土壤上,对低积累品种来说,随着细菌和真菌数量的减少及放线菌数量的增加,茎叶镉含量相应升高。而对于高积累品种来说,随着细菌、真菌、放线菌数量的减少,茎叶镉含量相应升高,且对低积累品种的影响大于对高积累品种的影响。
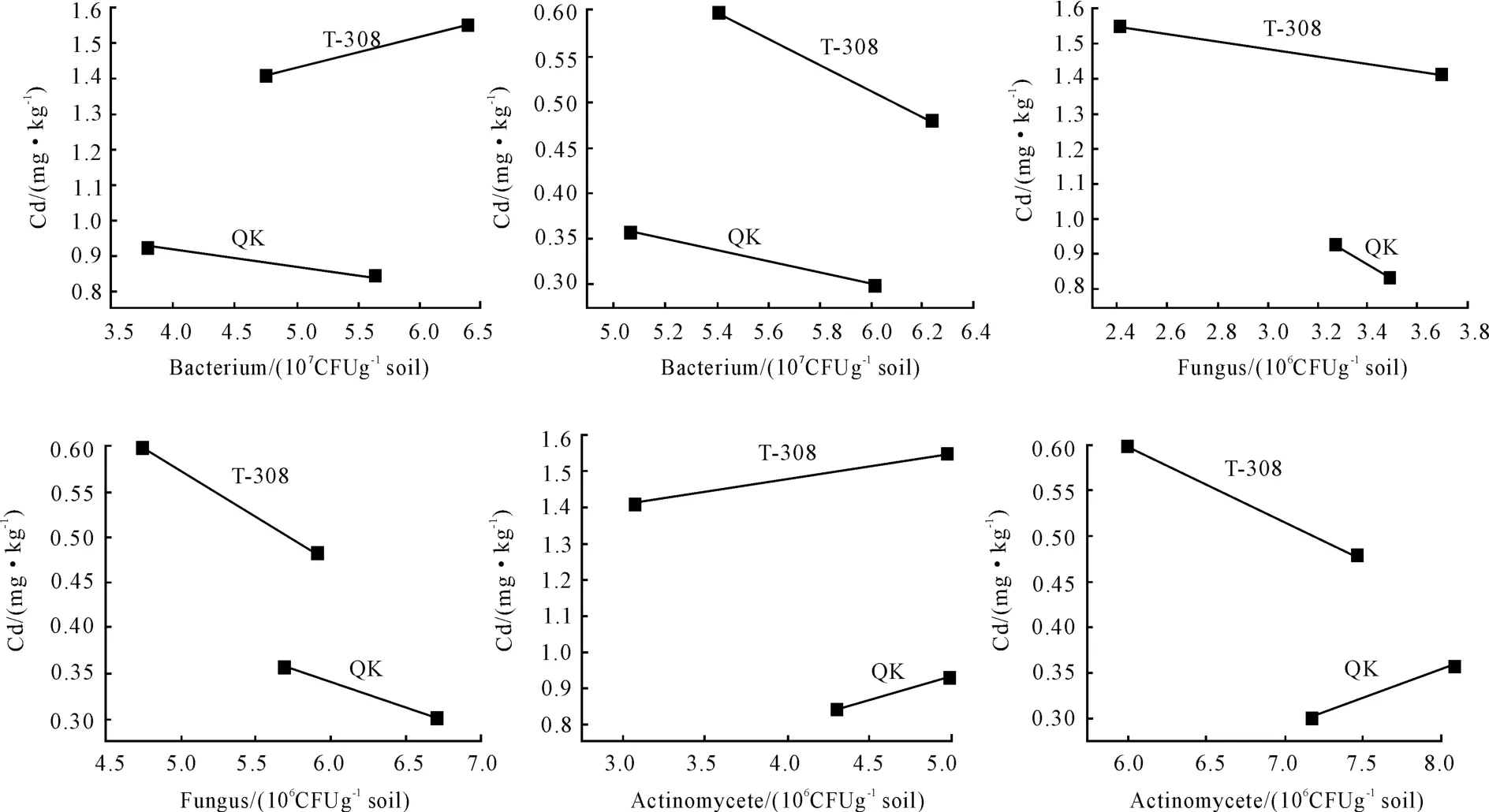
图2 根系3类微生物数量变化与蕹菜Cd积累典型品种的关系
3 结论
本研究发现蕹菜品种的Cd积累特性具有遗传稳定性。若从微生物总数来讲,在Cd污染土壤上,根系微生物对两个典型品种茎叶Cd含量影响具有较显著的差异,对低积累品种QK起抑制作用,而对高积累品种T-308起促进作用。若从微生物种类来讲,随着品种QK根系细菌、真菌数量的下降及放线菌数量的上升,茎叶Cd含量显著上升,且3类微生物对茎叶镉含量的影响大小顺序为:真菌>放线菌>细菌;随着品种T-308根系细菌和放线菌数量的减少,真菌数量的增加,茎叶Cd含量显著降低,且3类微生物对茎叶镉含量的影响大小顺序为:细菌>放线菌>真菌,且对低积累品种影响大于对高积累品种的影响。而在对照土壤上,根系微生物对2个品种的茎叶Cd含量均起抑制作用,影响大小顺序和污染土壤上相同,且对低积累品种的影响作用仍大于高积累品种的作用。这一研究结果为今后通过调整改变土壤微生物群落结构与功能,从而达到降低农作物可食部分Cd含量的目的提供技术支持和参考价值。
[1]杨慧,王富华,赵晓丽,等.叶菜类蔬菜中主要污染物调研分析研究[J].热带农业科学,2013,33(10):56-61.
[2]杨肖娥,杨明杰.镉从农业土壤向人类食物链的迁移[J].广州微量元素科学,1996,3(7):1-13.
[3]Oskarsson A,Widell A,Olsson I M,et al.Cadmium in food chain and health effects in sensitive population groups[J].Biometals,2004,17:531-534.
[4]Wang J L,Wei F,Yang Z Y,et al.Inter-and Intra-specific variations of Cd accumulation of 13 leafy vegetable species grown in Cd contaminated soils[J].Journal Agriculture Food Chemistry,2007,34:1154-1158.
[5]Feng M H,Shan X Q,Zhang SH ZH,et al.A comparison of the rhizosphere-based method with DTPA,EDTA,CaCl2,and NaNO3 extraction methods for prediction of bioavailability of metals in soils to barley[J].Environmental Pollution,2005,137:231-240.
[6]Kurz H,Schulz R.Selection of cultivars to reduce the concentration of cadmium and thallium in food and fodder plants[J].Journal plant nutrition soil science,1999,162:323-328.
[7]Janis C Kurtz,Diane F.Effects of light reduction on growth of the submerged macrophyte Vallisneria americana and the community of root-associated heterotrophic bacteria[J].Journal of Experimental Marine Biology and Ecology,2003,291(2):199-218.
[8]Shaheen Z,Farrukh A,Iqbal A.Metal tolerance and biosorption potential of filamentous fungi isolated from metal contaminated agricultural soil[J].Bioresource Technology,2007,98(13):2557-2561.
[9]Daniel D,Emilien P,Frederic C.The influence of temperature on bacterial assemblages during bioremediation of a diesel fuel contaminated subAntarctic soil[J].Cold Regions Science and Technology,2007,48(2):74-83.
[10]Joner B E J,Leyval C.Uptake of109Cd by Roots and Hyphae of a Glomus mosseae/Trifolium subterraneum Mycorrhiza from Soi1 Amended with High and Low Concentration of Cadmium[J].New Phytologist,1997,135:353-360.
[11]Liu Y,Zhu Y G,Chen B D,et al.Influence of the Arbuscular Mycorrhizal Fungus Glomus Mosseae on Uptake of Arsenate by the as Hyperaccumulator Fern Pteris vittat L[J].Mycorrhiza,2005,15:187-192.
[12]Souza M P,Chu D,Zhao M,et al.Rhizosphere Bacteria Enhance the Accumulation of Selenium and Mercury in Wetland Plants[J].Planta,1999,209:259-263.
