基于金属增强荧光的高通量碱基突变的筛查
2014-12-04徐瑶,郑直
徐 瑶,郑 直
(中国医学科学院 基础医学研究所 生物化学与分子生物学系, 北京 100005)
研究论文
基于金属增强荧光的高通量碱基突变的筛查
徐 瑶,郑 直*
(中国医学科学院 基础医学研究所 生物化学与分子生物学系, 北京 100005)
目的开发简单特异的金属增强荧光方法以区分含突变位点和完全互补配对的核酸序列。方法靶标能通过toehold调节的链置换反应将固定在96孔板表面的发卡结构核酸打开,再加入5′端修饰了羧基荧光素的信号探针,该探针能与另一段打开的捕捉探针杂交,通过检测荧光信号实现对靶标的分析。结果相对于一般方法,金属增强荧光(MEF)能明显区分互补配对靶标和含突变靶标,并具有显著的信号放大作用(对于100 nmol/L的靶标,信号放大~13倍),能检测出0.1 nmol/L级别的靶标(普通方法5 nmol/L)。结论为核酸突变检测提供了一种简便高通量的初筛手段。
链置换反应;金属增强荧光;碱基突变筛查
在高通量药物诊断、显微镜和其他生物技术中,荧光是一种非常常见的检测工具。但是由于荧光量子产率和荧光寿命的限制,导致荧光检测的灵敏度不高,因而限制了荧光检测的使用范围。金属增强荧光能增强荧光量子产率,同时减低荧光寿命,从而大大增加荧光检测的灵敏度[1- 2]。到目前为止,银表面作为基底已被用于很多实际检测中,例如蛋白质、DNA以及其他小分子[3]。
Toehold调节的链置换反应在DNA马达和其他基于DNA的纳米装置中均得到广泛运用[4- 5], 其中DNA单链b与a不完全互补(a与b杂交后伸出一段黏性末端称为toehold),a*能通过与toehold结合从而发生链置换反应将b完全置换下来。由于toehold调节的链置换反应严格受核酸序列控制,因此,链置换反应也为核酸中的碱基突变检测提供了另一种可能,具有很高的特异性[6- 7]。
本实验拟将金属增强荧光运用于toehold调节的核酸序列检测中,以建立在室温进行的具有简单快捷、高灵敏度和高通量等优点,并能对大规模样品进行初筛的检测方法。
1 材料与方法
1.1 仪器和试剂
核酸探针(Invitrogen公司)。探针序列如表1所示。硝酸银、Poly-(Phe, Lys)、BS3、96孔板、 Poly-D-Lysine 修饰的96孔板和二硫苏糖醇(DTT)(Sigma-Aldrich公司)。氢氧化铵(北京华腾化工有限公司)。葡萄糖、丁二酸酐、N-甲基吡咯烷酮、Hepes和Tris(上海生物工程有限公司)。Nanodrop 2000 Spectrophotometer (Thermo公司)。Synegy H4(BioTek公司)。
1.2 方法
1.2.1 96孔板表面镀银:在100 mL烧杯中加入硝酸银溶液(0.34 g溶于40 mL水中),不停搅拌,逐滴加入约6滴新制NaOH溶液(5% w/v),再缓慢加入氢氧化铵溶液直至深棕色沉淀完全溶解。上述溶液放置在4 ℃冰箱中冷却,随后加入新制的葡萄糖溶液(0.48 g溶于10 mL水中),混合均匀。用排枪将上述溶液加入96孔板中,每孔0.25 mL,直至溶液由无色变为黄棕色,可以观察到96孔板底部镀上了一层黄色的银[8]。弃去液体,并且用水洗3遍。
1.2.2 封闭镀银板表面的氨基反应位点:将0.8 g丁二酸酐溶解于25 mL硼酸缓冲液(0.1 mol/L硼酸,300 mmol/L NaCl,pH=8.0)中,再与等体积的N-甲基吡咯烷酮混合,迅速加入96孔板中,每孔0.25 mL,室温反应15 min后弃去,用水洗3遍。
1.2.3 在96孔板中固定巯基修饰的捕获探针:活化探针:把DTT加入探针中,将thiol-S-S还原为SH,再往上述溶液中加入100%冰乙醇至2 mL,在冰箱中冷冻10 min后取出,1 400×g离心10 min,使用70%乙醇洗3次,最后在真空干燥箱中干燥。活化后的捕获探针用Hepes缓冲液(10 mmol/L Hepes,200 mmol/L KCl,0.5 mmol/L EDTA,pH=7.5)稀释至1 μmol/L备用,1 μmol/L的上述溶液加入镀银96孔板中,每孔100 μL,封口,4 ℃过夜反应。用去离子水洗3遍,在干燥箱中干燥(2~3 h),封膜,4 ℃保存。
另外通过交联剂BS3将氨基修饰的核酸固定在表面修饰Poly-(Phe, Lys)的96孔板中作为对照组使用,干燥箱中晾干,封膜,4 ℃保存。
1.2.4 靶标检测:在修饰了核酸的96孔板中分别加入完全互补配对的靶标(target18)和有错配的靶标,室温反应2 h,洗液洗3遍后,再加入修饰FAM的信号探针,室温反应2 h,洗液洗3遍,使用多功能酶标仪测量荧光信号(图1)。

表1 实验中所使用的探针序列Table 1 Sequences of oligonucleotides used in this study*
*In the capture probes, the toeholds are underlined and the loops are italicized; in the target and mutant sequences, the bases at the mutational position are highlighted in red; the mutant type is the change of the relative base.

图1 基于toehold调节的链置换反应和金属增强荧光的SNP检测示意图
2 结果
2.1 温度对荧光信号的影响
在不同温度下进行反应,加入的靶标浓度和信号探针浓度分别为100 nmol/L和1 μmol/L,缓冲液选用Tris-HCL缓冲液(10 mmol/L Tris, 500 mmol/L Na+, 5 mmol/L Mg2+, 10 mmol/L EDTA)。温度升高至30 ℃后,荧光信号发生显著下降(图2)。在保证灵敏度的基础上为了进一步达到简化实验过程的目的,本实验选择在室温反应(23 ℃)。

*Plt;0.05 compared with 30 ℃图2 温度对荧光信号的影响Fig 2 Effect of temperature on fluorescence intensity
2.2荧光团与银表面之间的距离对荧光信号的影响
为了确定最佳的荧光团距银表面的距离,分别选用了3T、5T、7T 作为间隔序列(spacer),并与不加间隔序列的捕获探针进行对比,其中加入3T得到的荧光信号最高(图3)。

in the Y-axis label, F/F(blank) represents the ratio of signal to blank; control was the capture probe with no spacer, 3N, 5N and 7N was added with 3T, 5T and 7T spacer;*Plt;0.05 compared with control and 5N图3 间隔序列长度对荧光信号的影响Fig 3 Effects of length of spacer on the fluorescence intensity
2.3 聚乙二醇2000(PEG 2000)对实验的影响
分析了不同浓度的PEG 2000对实验结果的影响,其中3% PEG 2000效果最佳(图4)。

*Plt;0.05 compared with 0% PEG图4 溶液中PEG 2000对链置换反应的影响Fig 4 Effects of PEG 2000 on the fluorescence intensity
2.4 金属增强荧光的放大效果
相对于普通的修饰捕获探针的96孔板,镀银板的信号有显著的放大效果(图5)。
2.5 灵敏度
在对照组中,方法的检出限为5 nmol/L,线性范围为10~100 nmol/L(图6A)。而在实验组中,检测限为0.2 nmol/L,线性范围为2~150 nmol/L(图6B),其检测曲线的斜率显著大于对照组,也即灵敏度显著高于对照组,并且靶标的检测线性范围相对于对照组也有一定延伸。
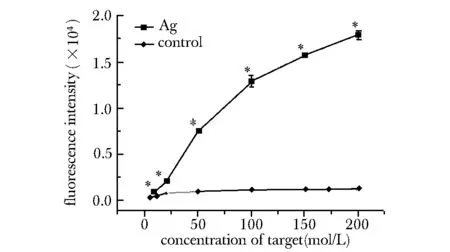
*Plt;0.05 compared with control group图5 不同浓度的靶标分别在普通96孔板和镀银96孔板中的信号响应Fig 5 Concentration response of the target strand in both normal 96-well plate and silver- coated 96-well plate
2.6 特异性
将错配位点设计在toehold区域,分别为M1、M2、M3、M4、M5和M6(顺序为3′- 5′),分别在对照组和实验组进行实验,两组结果都显示出了明显的区分错配靶标的能力。但在对照组中,不同错配位点的荧光强度区别不大,而实验组不但能区分错配靶标,而且显示出区分不同错配位点的能力(图7)。
3 讨论
当有入射光入射时,荧光团被激发,产生振荡偶极子,诱导金属中的自由电子发生振动,由此产生的电磁场能进一步与激发态的荧光团作用,从而增强荧光团的发射。在镀银板中,线性范围的扩展原因可能是由于镀银96孔板中固定的靶标浓度高于普通96孔板。在96孔板的修饰过程中,镀银板是通过Ag与SH的直接反应所实现,而对照组使用了BS3作为交联剂,通过多部反应实现修饰目的。
当荧光团与金属表面的距离大约为10 nm时,将呈现出最大的放大效果[9]。且由于将靶标固定在基底表面时,会增加反应的空间位阻,因而表面固定的单链DNA相对于溶液中游离的单链DNA杂交效率低[10]。而加入spacer能提高固定靶标的灵活度从而有效的降低表面的空间位阻,提高反应效率,从而使toehold调节的链置换反应更容易进行。
另外,该方法能区分完全配对和含突变位点的靶标,可能由于:1) 从动力学角度考虑,toehold调节的链置换反应是逐步进行,因而出现错配位点时,将阻止链置换反应进一步往下发生,从而阻断反应或者降低反应效率;2) 发卡结构的捕获探针含有12bp的互补双链,稳定性较高,只有完全配对的靶标能将双链打开,形成更稳定的结构。

A.normal 96-well plate; B.silver-coated plate图6 线性范围内不同浓度靶标的荧光信号Fig 6 Concentration of response of target strand in the dynamic range of the calibration curve
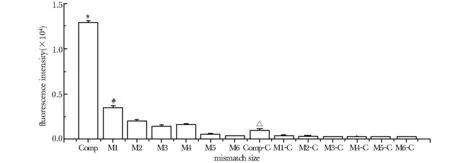
In the X-axis label, Comp represents the complementary target strand, M1~M6 represent strands with single-base mismatch position starting from 3′-end in the toehold region, C represents the control group;*Plt;0.05 compared with M1~M6 and Comp-C;#Plt;0.05 compared with M5 and M6;ΔPlt;0.05 compared with M1-C~M6-C
图7在toehold不同位点发生错配的靶标对应的荧光信号
Fig7Theoutputsignalcomparisonoftargetwithdifferentmismatchonthetoeholddomain
综上,本研究建立了一种金属增强荧光的突变筛查方法,相对于对照组信号有10倍左右的增强;并且能通过toehold调节的链置换反应区分完全互补配对和含错配的靶标,当错配发生在toehold区域时,信号相对于完全互补靶标有显著的下降,并且当错配发生在toehold里端(M1)时,信号降低最显著,因此可以通过这个结果设计序列中要检测的错配位点。该方法显示出较好的灵敏度和特异性并且能直接在室温进行,非常方便快捷。鉴于上述优点,该方法能为大批量核酸序列的快速筛查提供可能的检测方法。
[1] Lakowicz JR, Geddes CD, Gryczynski I,etal. Advances in surface-enhanced fluorescence[J]. J Fluorescence, 2004, 14: 425- 441.
[2] Li J, Zhong X, Zhang H,etal. Binding-induced fluorescence turn-on assay using aptamer-functionalized silver nanocluster DNA probes[J]. Anal Chem, 2012, 84: 5170- 5174.
[3] Dragan AI, Albrecht MT, Pavlovic R,etal. Ultra-fast pg/ml anthrax toxin (protective antigen) detection assay based on microwave-accelerated metal-enhanced fluorescence[J]. Anal Biochem, 2012, 425: 54- 61.
[4] Khodakov DA, Khodakova AS, Linacre A,etal. Toehold-mediated nonenzymatic DNA strand displacement as a platform for DNA genotyping[J]. J Am Chem Soc, 2013, 135: 5612- 5619.
[5] Endo M, Miyazaki R, Emura T,etal. Transcription regulation system mediated by mechanical operation of a DNA nanostructure[J]. J Am Chem Soc, 2012, 134: 2852- 2855.
[6] Wang D, Tang W, Wu X,etal. Highly selective detection of single-nucleotide polymorphisms using a quartz crystal microbalance biosensor based on the toehold-mediated strand displacement reaction[J]. Anal Chem, 2012, 84: 7008- 7014.
[7] Zhu J, Zhang L, Li T,etal. Enzyme-free unlabeled DNA logic circuits based on toehold-mediated strand displacement and split g-quadruplex enhanced fluorescence[J]. Adv Materials, 2013, 25: 2440- 2444.
[8] Malicka J, Gryczynski I, Lakowicz JR. DNA hybridization assays using metal-enhanced fluorescence[J]. Biochem Biophys Res Commun, 2003, 306: 213- 218.
[9] Ray K, Badugu R, Lakowicz JR. Sulforhodamine adsorbed Langmuir-Blodgett layers on silver island films: Effect of probe distance on the metal-enhanced fluorescence[J]. J Phys Chem C, 2007, 111: 7091- 7097.
[10] Sabanayagam CR, Lakowicz JR. Increasing the sensitivity of DNA microarrays by metal-enhanced fluorescence using surface-bound silver nanoparticles[J]. Nucleic Acids Res, 2007, 35: 1- 9.
High throughput mutation screening based on metal-enhanced fluorescence
XU Yao, ZHENG Zhi*
(Institute of Basic Medical Sciences, CAMS amp; PUMC, Beijing 100005, China)
ObjectiveTo develop a highly sensitive and selective method for mutation detection utilizing metal enhanced fluorescence (MEF).MethodsStrand-displacement was initiated by introducing the target ssDNA and resulting in the unfolding of the capture probe. A signal probe coupled with carboxy fluorescein(FAM) was further hybridizing with the unfolding capture probe and generating fluorescent signal.ResultsComparing to normal method, the MEF design could discriminate complementary target from targets with mismatch, and holds noticeable specificity and highly sensitivity (~13 fold signal amplification with 100 nmol/L target) with the detection limit of 0.1 nmol/L in silver-coated 96-well plate (control group is 5 nmol/L).ConclusionsThe MEF assay provides an alternative screening method for mutation detection.
strand-displacement reaction; metal-enhanced fluorescence; mismatch screening
2014- 03- 10
2014- 04- 16
国家自然科学基金(81271926)
*通信作者(correspondingauthor):zhizheng10@yahoo.com
1001-6325(2014)06-0797-05
R 446.1
A
