无创正压通气对急性加重期COPD患者痰液及血液炎性因子水平的影响
2014-12-02沈洋,肖莉
沈 洋,肖 莉
(中国医科大学附属盛京医院,沈阳110004)
慢性阻塞性肺疾病(COPD)是一种以不完全可逆性气流受限并伴显著肺外效应为特征的呼吸道疾病[1,2]。目前研究表明,COPD发病伴随气道和全身的炎症反应。近年来,无创正压通气(NPPV)治疗急性加重期COPD(AECOPD)患者的疗效已得到肯定[3~5],但确切机制尚不完全清楚。本实验采用随机对照试验方法,观察了NPPV对AECOPD患者痰液及血液中炎性因子水平的影响,旨在进一步探讨NPPV治疗AECOPD的可能机制。
1 资料与方法
1.1 临床资料 研究对象为2012年1月~2013年12月于我院重症监护室治疗的AECOPD患者,男11例,女 19例;年龄(65.61±8.22)岁,病程(11.18±2.83)a。均符合2013年中华医学会呼吸病学分会制定的慢性阻塞性肺疾病诊治指南。纳入标准:神志清醒;自主呼吸能与呼吸机配合;具有排痰能力;无机械通气禁忌证。排除标准:拒绝接受NPPV治疗;无力排痰;多脏器功能衰竭;严重心律失常;感染性休克;有近期面部及上气道手术、创伤或畸形。将30例患者根据入院顺序随机分为NPPV组和对照组各15例,两组年龄、性别及病情等一般资料具有可比性。本研究经患者(或家属)同意并签署知情同意书,并获得中国医科大学附属盛京医院医学科研与新技术伦理委员会批准。
1.2 NPPV应用方法 两组均接受支气管舒张剂、茶碱、糖皮质激素和抗生素等常规治疗,持续低流量吸氧维持动脉血氧饱和度在90%以上。在此基础上,NPPV组采用双水平呼吸机(BiPAP)行NPPV治疗:呼吸机参数设置压力支持(PSV)+呼气末气道内正压(PEEP)通气模式,调节吸入氧浓度使动脉血氧饱和度保持在90%以上,每日通气时间4~8 h;经NPPV治疗2~4 h通气功能无明显改善者尽早进行有创通气治疗。
1.3 医学研究会呼吸困难量表(MRC)评分及动脉血气指标测定 分别于治疗前和治疗72 h后检测两组下述指标。①医学研究会呼吸困难量表(MRC)评分:0分为无呼吸困难;1分为平地急走或步行上山坡(或一层楼)时出现气短;2分为与其他同龄人同速行走时出现气短;3分为按既往常速平地行走时出现气短;4分为穿、脱衣时出现气短。②动脉血气指标:主要包括酸碱度(pH值)、二氧化碳分压(PaCO2)、氧分压(PaO2)。
1.4 痰液及血液中IL-6、IL-8、TNF-α 的检测 在医生指导下将患者漱口后深咳的第一口痰置入无菌瓶中,无痰者采用3%氯化钠溶液雾化10 min诱导。痰液用盐水洗涤后在低倍视野下白细胞数﹥25个、上皮细胞<10个为合格标本。将合格痰标本加入痰前处理液,在4℃下2 000 r/min离心20 min,取浮在表面的液体于-70℃保存;空腹条件下自肘静脉采血3 mL,注入含有EDTA的干燥试管中,混匀,同上离心贮存。按照ELISA试剂盒(购自北京达科为生物技术有限公司)说明书检测痰液及血液中IL-6 、IL-8、TNF-α 水平。
1.5 统计学方法 采用SPSS13.0对所得数据进行统计学分析。计量资料以±s表示,组间和组内比较分别用成组t检验和配对t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 MRC评分与动脉血气指标 两组治疗后呼吸困难均缓解、动脉血气指标均改善,尤以NPPV组为著。详见表1。
表1 两组治疗前后MRC评分与动脉血气指标比较(±s)

表1 两组治疗前后MRC评分与动脉血气指标比较(±s)
注:与同组治疗前比较,*P <0.05;与对照组比较,ΔP <0.05
组别 MRC评分(分)动脉血气指标pH PaO2(mmHg)PaCO2(mmHg)NPPV 组治疗前 3.20 ±0.48 7.254 ±0.039 48.23 ±4.16 61.33 ±4.96治疗72 h 1.27±0.45* Δ 7.354±0.031*Δ70.37±4.39* Δ 38.80±3.51*对照组治疗前 3.17 ±0.53 7.264 ±0.034 47.33 ±3.96 58.67 ±5.33治疗72 h 1.70 ±0.54* 7.326 ±0.255* 62.57 ±5.12* 41.97 ±5.76*
2.2 痰液中 IL-6、IL-8、TNF-α 水平 两组治疗后痰液中IL-6、IL-8、TNF-α水平均较治疗前下降,尤以NPPV组为著。详见表2。
表2 两组治疗前后痰液中IL-6、IL-8、TNF-α 水平比较(pg/mL,±s)

表2 两组治疗前后痰液中IL-6、IL-8、TNF-α 水平比较(pg/mL,±s)
注:与同组治疗前比较,*P <0.05;与对照组比较,ΔP <0.05
组别 IL-6 IL-8 TNF-α组NPPV治疗前 307.80 ±38.88 291.23 ±50.12 466.80 ±87.71治疗72 h 154.57 ±29.79*Δ134.37 ±29.82*Δ210.70 ±20.49*Δ对照组治疗前 319.90 ±33.80 265.23 ±45.65 442.93 ±87.78治疗72 h 208.80 ±50.94* 171.83 ±31.94* 262.07 ±25.32*
2.3 血液中 IL-6、IL-8、TNF-α 水平 两组治疗后血液中IL-6、IL-8、TNF-α水平均较治疗前下降,尤以NPPV组为著。详见表3。
表3 两组治疗前后血液中IL-6、IL-8、TNF-α 水平比较(pg/mL,±s)
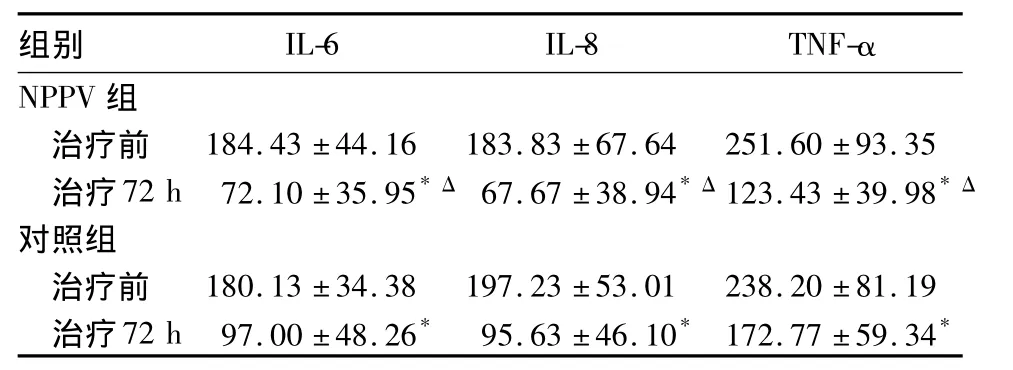
表3 两组治疗前后血液中IL-6、IL-8、TNF-α 水平比较(pg/mL,±s)
注:与同组治疗前比较,*P <0.05;与对照组比较,ΔP <0.05
组别 IL-6 IL-8 TNF-α NPPV 组治疗前 184.43 ±44.16 183.83 ±67.64 251.60 ±93.35治疗72 h 72.10 ±35.95*Δ 67.67 ±38.94*Δ123.43 ±39.98*Δ对照组治疗前 180.13 ±34.38 197.23 ±53.01 238.20 ±81.19治疗72 h 97.00 ±48.26* 95.63 ±46.10* 172.77 ±59.34*
3 讨论
COPD患者出现运动耐力下降、发热和(或)胸部影像异常时可能为病情加重的征兆,至少具有“气促加重、痰量增加、痰变脓性”中的2项即可诊断AECOPD。AECOPD治疗应符合患者的长期需求,以达到延缓疾病进展、缓解症状、改善运动耐受性及健康状况、防治并发症和降低病死率的目标。COPD患者常有较高的内源性PEEP存在,在肺实质受到破坏、气道黏膜水肿和气道痉挛等情况下,小气道的功能下降,可在呼气时发生陷闭、气体不能完全排除,使肺顺应性增加、所需呼气时间延长。NPPV是指通过鼻(面)罩等方法连接患者和呼吸机的辅助通气方式,无需插管或气管切开,可避免相应并发症发生。迄今为止,全世界进行了多项有关无创通气(NIV)治疗AECOPD的前瞻性随机对照研究。Plant等[6]发现,NPPV 可使 AECOPD 患者更早地脱离气管插管,并缩短ICU住院时间。Brochard等[7]应用NPPV治疗13例AECOPD患者,其中仅1例需改行气管插管,而对照组13例中有11例需行气管插管。因此,NPPV可减少AECOPD患者的插管率、降低病死率,且能节省医疗费用。本研究显示,两组治疗后呼吸困难均缓解、动脉血气指标均改善,尤以NPPV组为著。可能机制:①NPPV可在患者吸气时通过呼吸机同步送出吸气正压,帮助患者克服呼吸阻力、减少呼吸肌作功,提高肺泡通气量,同时也可改善肺内气体分布的不均状态(使通气与血流比值更趋合理)、促进气体的交换和弥散、减少生理无效腔容积、提高PaO2,有利于改善通气功能;还可在呼气时提供较低的呼气正压,抵消和减少呼吸肌克服内源性呼气末正压(PEEPi)的做功、增加功能残气量(防止肺萎缩)、改善氧合和气体交换,从而提高PaO2、降低 PaCO2[8]。②BiPAP可分别对吸气相和呼气相提供不同水平的辅助正压,从而防止上气道软组织塌陷、缓解内生负压对气道的关闭作用[9];吸气压能适当增加潮气量、减少呼吸动能和氧耗量,呼气末正压则能防止气道闭陷、改善气体分布和通气血流比、提高动脉血氧分压、降低动脉血PaCO2、纠正Ⅱ型呼吸衰竭失代偿。
COPD的发病机制复杂,其中多种细胞因子、炎症介质等相互作用所产生的慢性炎症被认为是主要发病机制之一[10,11],除具有气道、肺实质和肺血管的慢性炎症等特征外,可伴随全身炎症反应,主要表现为全身氧化负荷异常增高、血液中炎性因子浓度异常增高及炎性细胞异常活化[12~15]。目前研究[16]表明,COPD伴随的炎性反应以Ⅰ型T辅助淋巴细胞炎性反应占优势。IL-6是一种主要由活化单核细胞、巨噬细胞、T和B淋巴细胞、内皮细胞及成纤维细胞等分泌的具有多种生物学功能的细胞因子,直接参与炎症和损伤。
有研究[17]发现,AECOPD患者痰液中IL-6水平较稳定期明显增高。高浓度的IL-6可损伤血管内皮细胞、促进免疫黏附、微血栓形成,并可抑制内皮修复、使血管受损及高通透状态延迟,造成肺损伤,引起肺功能恶化[18];还能促进中性粒细胞的氧化反应,使中性粒细胞在炎性反应部位聚集、超氧阴离子释放增多,从而使炎性反应持续及加重,最终引起小气道和肺泡组织结构和功能改变[19]。IL-6可诱导肝脏产生大量急性反应物质CRP,在免疫损伤时可通过直接或间接作用造成组织和血管损伤[20]。IL-8是由活化的支气管上皮细胞、巨噬细胞和中性粒细胞分泌的细胞因子,对中性粒细胞和单核细胞有强大趋化作用,主要表现为与细胞表面特异性受体结合,诱导中性粒细胞形态改变、趋化,引起细胞内游离钙浓度一过性升高、颗粒内含物释放、生物活性物质形成及呼吸爆发产生大量氧自由基,促进炎症反应[21]。IL-8被认为是参与COPD气道炎症最重要的细胞因子,在AECOPD患者诱导痰中浓度显著增加,且其水平与患者气流阻塞程度呈正比,可反映气道炎症的严重程度[22]。TNF-α是强效的炎症介质,通过直接和间接机制发挥促炎作用,参与IL-8和中性粒细胞等炎症介质和炎症细胞对AECOPD患者气道的损伤过程[23];其受体激活后诱导白细胞和内皮细胞释放炎症介质,进而上调其他致炎细胞因子表达,产生更多的炎症反应[24];还可刺激呼吸道上皮细胞表达IL-8,最终反复引起呼吸道慢性炎症和肺部损伤[25];还具有巨噬细胞和中性粒细胞趋化作用,对炎症反应起级联放大作用,为COPD气道炎症的重要炎性介质。本研究显示,两组治疗后痰液及血液中 IL-6、IL-8、TNF-α水平均较治疗前下降,尤以NPPV组为著。提示下调气道及全身炎性因子水平可能为NPPV治疗AECOPD的机制之一。
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病组.慢性阻塞性肺疾病诊治指南(2013年修订版[J].中华结核和呼吸杂志,2013,36(4):255-264.
[2]Fabbri LM,Luppi F,Beghé B,et al.Update in chronic obstructivepulmonary disease2005[J].Am J Respir Crit Care Med,2006,173(10):1056-1065.
[3]Dunn Galvin A.Sex and gender differences in COPD:challenging the stereotypes[J].Prim Care Respir J,2011,20(4):378-379.
[4]Organizedjointly by the American Thoracic Society,the European Respiratory Society,the European Society of Intensive Care Medicine,et al.International Consensus Conferences in Intensive Care Medicine:noninvasive positive pressure ventilation in acute respiratory failure[J].Am J Respir Crit Care Med,2001,163(1):283-291.
[5]British Thoracic Society Standards of Care Committee.Non-invasive ventilation in acute respiratory failure[J].Thorax,2002,57(3):192-211.
[6]Plant PK,Owen JL,Elliott MW.Early use of non-invasive ventilation for acute exacerbations of chronic obstructive pulmonary disease on general respiratory wards:a multicentrerandom controlled trial[J].Lancet,2000,355(9219):1931-1935.
[7]Brochard C,Mancebo J,Wysochi M,et al.Noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease[J].N Engl J Med,1995,333(13):817-822.
[8]朱蕾,钮善福,张椒平,等.经面罩机械通气治疗慢性阻塞性肺疾病呼吸衰竭患者的回顾性分析[J].中华结核和呼吸杂志,2003,26(7):407-410.
[9]慢性阻塞性肺疾病无创机械通气治疗研究协作组.早期应用无创正压通气治疗慢性阻塞性肺疾病急性加重期患者的多中心随机对照研究[J].中华结核和呼吸杂志,2005,28(10):680-684.
[10]何志义,欧莉梅,张健全,等.小剂量红霉素对慢性阻塞性肺病患者诱导痰炎症细胞及急性加重的影响[J].中华结核和呼吸杂志,2012,35(6):422-423.
[11]Buler M,Aatsinki SM,Skoumal R,et al.Energy-sensing factors coactivator peroxisome proliferator-activated receptor γ coactivator 1-α(PGC-1α)and AMP-activated protein kinase control expression of inflammatory mediators in liver:induction of interleukin 1 receptor antagonist[J].J Biol Chem,2012,287(3):1847-1860.
[12]周海英,胡志雄.慢性肺炎衣原体感染是慢性阻塞性肺病(COPD)的危险因子[J].中国人兽共患病学报,2011,23(8):167-168.
[13]Hamidi A,von Bulow V,Hamidi R,et al.Polyubiquitination of transforming growth factor β(TGF-β)-associated kinase 1 mediates nuclear factor-κB activation in response to different inflammatory stimuli[J].J Biol Chem,2010,287(1):123-133.
[14]张艺,胡克.COPD合并T2DM患者血清visfatin与CRP的关系[J].临床肺科杂志,2011,16(9):1347-1349.
[15] Meunier I,Embury-Hyatt C,Stebner S,et al.Virulence differences of closely related pandemic 2009 H1N1 isolates correlate with increased inflammatory responses in ferrets[J].Virology,2012,422(1):125-131.
[16]Kim V,Rogers TJ,Criner GJ.New concepts in the path biology of chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2008,5(4):478-485.
[17]Langen RC,Schols AM.Inflammation:friend or foe of muscle remodeling in COPD [J].Eur Respir J,2007,30(4):605-607.
[18]蒋延文,庞莉,马迎民,等.血清炎症因子水平与慢性阻塞性肺疾病继发肺动脉高压相关性研究[J].中华结核和呼吸杂志,2011,12(34):904-907.
[19]Wannamethee SG,Papacosta O,Lawlor DA ,et al.Do women exhibit greater differences in established and novel risk factors between diabetes and non-diabetes than men?The British Regional Heart Study and British Women's Heart Health Study[J].Diabetologia,2012,55(1):80-87.
[20]徐浩,蒋静涵.NICO在慢性阻塞性肺病机械通气患者中的应用研究[J].当代医学,2011,13(23):1654-1658.
[21] Toshimasa T,Junga F,Chikara E,et al.Interleukin 6 receptor antibody inhibits muscle atrophy and modulates systems in interleukin 6 transgenic mice[J].J Clin Invest,1996,97(1):244-249.
[22]Oehmcke S,Morgelin M,Malmstrõm J,et al.Stimulation of blood mononuclear cells with bacterial virulence factors leads to the release of pro-coagulant and pro-inflammatory microparticles[J].Cell Microbiol,2012,14(1):107-119.
[23]Turner MD,Chaudhry A,Nedjai B.Tumour necrosis factor receptor trafficking dysfunction opens the TRAPS door to pro-inflammatory cytokine secretion[J].Biosci Rep,2012,32(2):105-112.
[24]Churg A,Wang RD,Tai H,et al.Tumor necrosis factor-alpha drives 70%of cigarette smoke-induced emphysema in the mouse[J].Am J Respir Crit Care Med,2004,170(5):492-498.
[25]Sarir H,Mortaz E,Janse WT,et al.IL-8 production by macrophages is synergistically enhanced when cigarette smoke is combined with TNF-alpha[J].Biochem Pharmacol,2010,79(5):698-705.
