不同剂量川芎嗪注射液治疗新生儿缺氧缺血性脑病疗效观察
2014-11-30蒋金财
蒋金财
(吉林省柳河县妇幼保健院,吉林柳河135300)
新生儿缺氧缺血性脑病(HIE)主要由新生儿在围产期发生宫内窘迫、窒息缺氧等因素所引起,也包括其他原因引起的脑损害,一旦发病即可造成不同程度的神经系统损伤,且病死率及后遗症遗留率均较高,尤其是脑性瘫痪、智力低下、脑积水、癫痫等永久性神经损伤,对小儿的正常发育带来极大障碍[1]。HIE的病因病机较为复杂,目前临床上对于该病的治疗主要为积极供氧、维持血压稳定、纠正酸碱代谢紊乱、控制惊厥及脑水肿等,且预防重于治疗。川芎嗪是从中药川芎的根茎中提取出的一种吡嗪生物碱,具有活血化瘀、理气的功效,西医理论认为该药可抗血小板聚集,扩张小动脉,改善微循环,且不良反应较少,因此在缺血性脑血管疾病的临床应用中十分广泛[2-3]。但是,新生儿的组织器官发育尚未完善,用药剂量更应严谨考虑。2011年2月—2013年2月,笔者观察了不同剂量川芎嗪注射液治疗新生儿HIE的疗效,并初步验证药物作用机制,现将结果报道如下。
1 临床资料
1.1 一般资料 选择上述时期本院儿科收治的HIE新生儿78例,均经脑CT扫描证实为HIE,诊断标准依据文献[4]。男42例,女36例;体质量1 500 ~4 000(2 830.51 ±84.93)g;胎龄38~42(40.21±1.6)周;日龄1~3(1.52±0.44)d;HIE分度:轻度23例,中度42例,重度13例;母体状况:宫内窘迫53例,脐带绕颈16例,胎盘因素9例;分娩方式:自然分娩23例,剖宫产55例。将上述78例患儿按照入院顺序随机分为A组及B组,每组39例,2组患儿的性别构成、体质量、胎龄、日龄、HIE病情程度、母体状况及分娩方式等具有可比性。另选择同期在我院分娩的正常足月新生儿30例作为正常对照组,男17例,女13例;日龄1 ~3(1.58±0.42)d;出生时 Apgar评分在8~10分。正常对照组新生儿的性别比例、日龄与A、B 2组比较无显著性差异。
1.2 治疗方法 A、B 2组患儿入住儿科确诊后,立即给予吸氧、保暖、甘露醇降颅压、苯巴比妥控制惊厥、纳洛酮消除脑干症状、纠正水电解质及酸碱平衡紊乱等常规综合治疗。在此基础上,A组给予川芎嗪注射液4 mg/kg+生理盐水50 mL静脉滴注,B组给予川芎嗪注射液8 mg/kg+生理盐水50 mL静脉滴注,2组均1次/d,轻度患儿治疗10 d,中度患儿治疗14 d,重度患儿治疗21~28 d。
1.3 主观及客观观察指标 ①统计患儿接受治疗后意识恢复、惊厥停止、前囟张力恢复、原始反射恢复、肌张力恢复及脑水肿消失时间。②采用新生儿20项神经行为评分方法(NBNA)评价患儿接受治疗前及治疗3,7,14 d时神经系统发育情况。NBNA包括5个方面内容,即行为能力、被动肌张力、主动肌张力、原始反射和一般评估共20项,满分40分。③分别采集3组新生儿清晨空腹静脉血3 mL,进行血清肌酸激酶脑型同工酶(CK-BB)、血浆神经元特异性烯醇化酶(NSE)、红细胞总钙量(EryCaT)、一氧化氮(NO)、超氧化物歧化酶(SOD)及丙二醛(MDA)检测。④治疗期间详细记录患儿出现的药物不良反应。疗程结束后对患儿进行6个月~1 a的随访。
1.4 统计学处理 数据采用SPSS 16.0统计学软件进行分析,计量数据以均数±标准差表示,采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 A、B 2组患儿症状恢复时间 B组意识恢复、惊厥停止、前囟张力恢复、原始反射恢复、肌张力恢复及脑水肿消失的时间较A组显著缩短(P均<0.01),见表1。
表1 A、B 2组患儿症状恢复时间(±s,d)
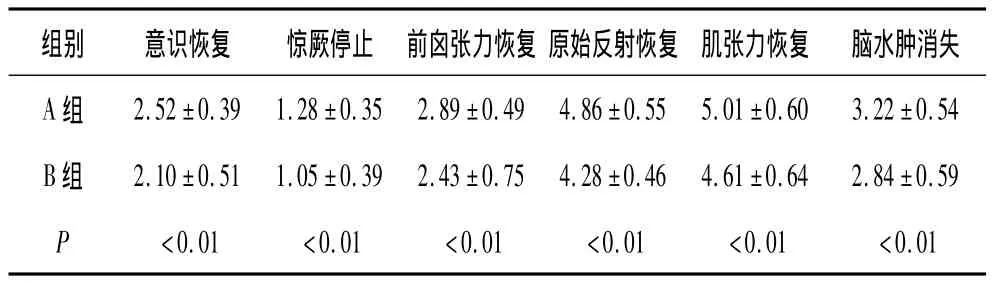
表1 A、B 2组患儿症状恢复时间(±s,d)
组别 意识恢复 惊厥停止 前囟张力恢复 原始反射恢复 肌张力恢复 脑水肿消失A 组 2.52±0.39 1.28±0.35 2.89±0.49 4.86±0.55 5.01±0.60 3.22±0.54 B 组 2.10±0.51 1.05±0.39 2.43±0.75 4.28±0.46 4.61±0.64 2.84±0.59 P <0.01 <0.01 <0.01 <0.01 <0.01 <0.01
2.2 A、B 2组NBNA评分比较 A、B 2组NBNA评分治疗前比较无显著性差异,治疗3 d、7 d、14 d后均较治疗前有不同程度的提高。治疗3 d时2组比较无显著性差异,治疗7 d、14 d时B组显著高于A组(P均<0.05)。见表2。
表2 A、B 2组NBNA评分比较(±s,分)
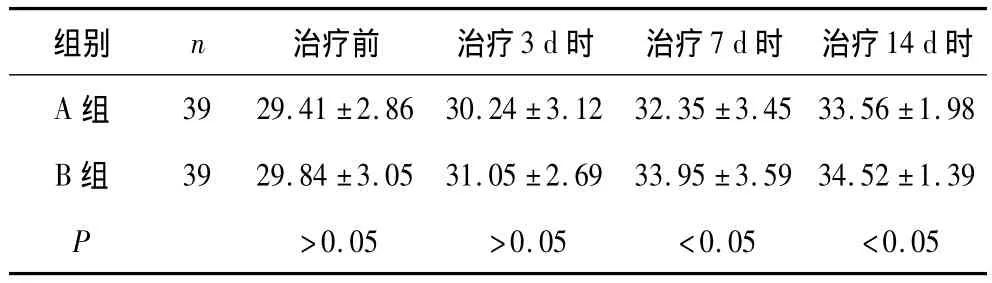
表2 A、B 2组NBNA评分比较(±s,分)
组别 n 治疗前 治疗3 d时 治疗7 d时 治疗14 d时A 组 39 29.41 ±2.86 30.24 ±3.12 32.35 ±3.45 33.56 ±1.98 B 组 39 29.84 ±3.05 31.05 ±2.69 33.95 ±3.59 34.52 ±1.39 P >0.05 >0.05 <0.05 <0.05
2.3 3组实验室指标检查结果比较 A、B 2组患儿各实验室指标检查结果与正常对照组比较均有显著性差异(P均<0.01)。经过治疗后,A、B 2组均较治疗前有不同程度的改善,且B组的改善幅度显著大于A组。见表3。
表3 3组实验室指标检查结果比较(±s)
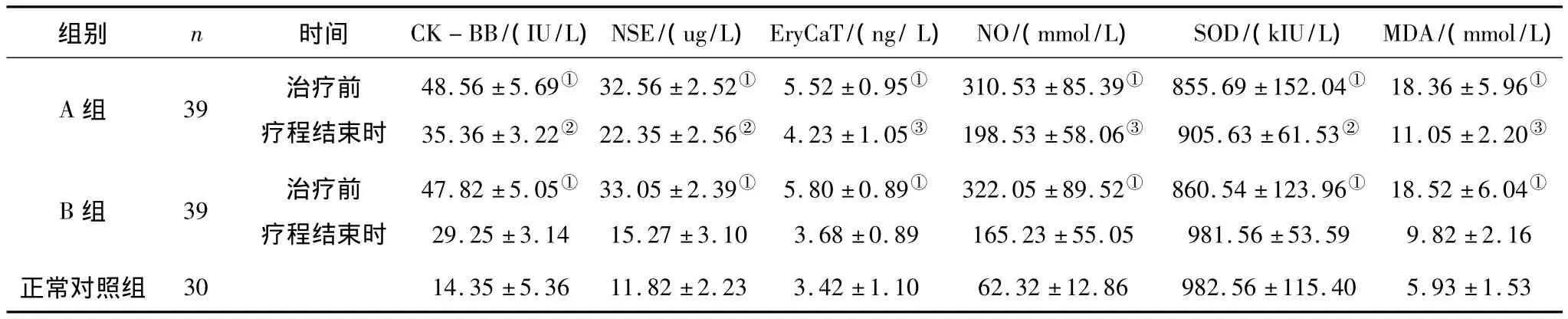
表3 3组实验室指标检查结果比较(±s)
注:①与正常对照组比较,P<0.01;②与 B 组比较,P <0.01;③与 B 组比较,P <0.05。
组别 n 时间 CK-BB/(IU/L)NSE/(ug/L)EryCaT/(ng/L)NO/(mmol/L) SOD/(kIU/L) MDA/(mmol/L)A组 39 治疗前疗程结束时48.56 ±5.69①35.36 ±3.22②32.56 ±2.52①22.35 ±2.56②5.52 ±0.95①4.23 ±1.05③310.53 ±85.39①198.53 ±58.06③855.69 ±152.04①905.63 ±61.53②18.36 ±5.96①11.05 ±2.20③B组 39 治疗前疗程结束时47.82 ±5.05①29.25 ±3.14 33.05 ±2.39①15.27 ±3.10 5.80 ±0.89①3.68 ±0.89 322.05 ±89.52①165.23 ±55.05 860.54 ±123.96①981.56 ±53.59 18.52 ±6.04①9.82 ±2.16正常对照组 30 14.35 ±5.36 11.82 ±2.23 3.42 ±1.10 62.32 ±12.86 982.56 ±115.40 5.93 ±1.53
2.4 药物不良反应及随访 2组患儿在治疗期间均未发现明显不良反应,肝肾功能、血常规检查均未发现明显异常,最终A组死亡2例(5%),B组死亡1例(3%)。78例患儿中有1例失访(B组),其余77例均获得6个月以上的随访。A组出现脑瘫1例,癫痫2例,智力低下1例,后遗症发生率为10%;B组出现脑瘫1例,癫痫2例,未发现智力低下者,后遗症发生率为8%。2组患儿病死率、后遗症发生率比较均无显著性差异。
3 讨 论
HIE的疾病本质为缺血再灌注损伤,而脑水肿、神经系统损伤是其重要的病理变化。新生儿发生HIE时,由于脑组织缺氧缺血较为严重,可能激发β-内啡肽等大量阿片类物质的释放,介导脑组织损伤,进一步激发内皮素的释放,而大量内皮素的释放可迅速增强血管收缩力,导致脑组织供血及供氧的严重不足[5]。另外,HIE发病早期,微动脉内脑组织缺血区的白细胞附壁数量显著提高,从而显著减弱微动脉的断裂应力,增加其黏附性,这也可能导致脑组织缺血区的微循环障碍进一步恶化。但是对于HIE复杂的发病机制,至今还未得到确切的阐述。
发生脑损伤时,神经细胞病理性水肿、坏死,NSE通过破损的细胞膜漏出,因此血液中NSE的含量显著升高可作为脑损伤的判断标准之一[6]。CK-BB的灵敏度较高,在脑组织损伤时可迅速从脑部神经细胞和星形胶质细胞中释放入血,也可作为脑损伤的评估标准。本研究发现HIE患儿NSE及CK-BB显著升高。另外,钙离子平衡的紊乱也是导致脑组织缺氧缺血的重要因素之一,本研究中HIE患儿的EryCaT水平亦显著高于正常新生儿,并且与NSE及CK-BB相似,其水平随着治疗的进行逐渐恢复。
血浆及脑组织中氧自由基及NO在HIE患儿的发病和进展过程中起着重要作用,NO参与神经毒作用,扰乱人体正常的细胞代谢,从而激发炎性物质的释放;同时,HIE患儿体内酶合成障碍,氧自由基大量合成,使得体内防御物质SOD被大量消耗,导致对氧自由基的清除能力减弱,氧自由基则可以肆意破坏神经细胞结构,损伤血脑屏障,引发脑水肿、脑组织坏死,从而进一步加重脑损伤。本研究结果显示,HIE患儿血液中NO及MDA的水平均较正常新生儿显著升高,而SOD水平显著下降,提示HIE的发病和进展过程中自由基损伤的作用。
川芎嗪是从川芎中提取的有效单体成分,它在人体内的吸收较为完全,容易通过血脑屏障,并能在脑组织内维持稳定而持久的治疗作用。对于川芎嗪治疗HIE新生儿的作用机制,国内许多专家已进行了临床及实验研究,总结分析主要有以下几种途径:首先为抑制钙超载。该药为钙通道阻滞剂,可使HIE患儿体内钙离子内流减少,阻断其导致神经元死亡的重要通道。其次为清除自由基。该药可抑制过氧化物形成,使自由基清除障碍得以遏制,进而促进有效因子对受损神经组织的修复[7]。另外,该药还对脑组织缺血区血管内皮细胞黏附分子表达具有强烈的抑制作用,可有效改善微循环,增加脑血流,减轻脑水肿[8]。
本研究结果提示,8 mg/kg剂量的川芎嗪组患儿神经症状恢复时间显著短于4 mg/kg剂量组,治疗7 d、14 d时神经系统发育情况也优于后者,说明川芎嗪治疗HIE患儿存在一定的量效关系,即较大剂量的疗效优于较小剂量。在实验室指标方面,较大剂量组的改善幅度显著大于较小剂量组,进一步验证了川芎嗪在改善微循环、扩张脑血管、修复神经损伤中的作用,且这种修复作用随着剂量的上升而增强。2组用药安全性分析提示,大小剂量组均未发现明显不良反应,说明用药剂量的增大似乎并未增加不良反应。
综上所述,8 mg/kg的川芎嗪注射液在治疗新生儿HIE时对临床症状及神经系统发育的改善作用更优,且安全性较好。这一作用可能是通过抑制钙离子内流、改善微循环、清除自由基等而实现的。对于大剂量用药的不良反应今后还应进行长期而全面的随访才可得出更为客观的结论。
[1]吴华超,吴耀初,张杨桂,等.重度新生儿缺血缺氧性脑病CT诊断及后遗症评估[J].中国医师杂志,2009,11(5):683-685
[2]易慧娟,李琼,罗娟.高压氧联合川芎嗪对重度缺氧缺血性脑病NSE和MBP水平变化的调节[J].中西医结合心脑血管病杂志,2008,6(6):661 -663
[3]刘一丁,王自媛.川芎嗪注射液联合尼莫地平治疗新生儿缺氧缺血性脑病疗效观察[J].现代中西医结合杂志,2009,18(7):747-748
[4]中华医学会儿科学分会新生儿学组.新生儿缺氧缺血性脑病诊断标准[J].中华儿科杂志,2005,43(8):584
[5]陈淑香.新生儿缺氧缺血性脑病120例临床特点分析[J].中国中西医结合儿科学,2012,4(5):452-453
[6]吴丛山,郑黎枫.新生儿缺血缺氧性脑病血清hs-CRP和NSE检测的临床意义[J].浙江临床医学,2012,14(9):1055-1057
[7]孙威,张隽,解鸿君,等.川芎嗪对脑挫伤大鼠脑组织MDA、SOD、NO及含水量影响的研究[J].中华神经医学杂志,2007,6(7):679-681
[8]胡跃强,胡国恒,肖波,等.川芎嗪干预局灶性脑缺血再灌注大鼠脑内细胞间黏附分子1表达的动态变化[J].中国临床康复,2005,9(25):149 -151
