再生水用于循环冷却水中铁细菌对碳钢腐蚀的影响
2014-11-28李亚男田一梅
吴 卿,李 云,李亚男,田一梅,彭 森
(1.天津大学环境科学与工程学院,天津 300072;2.太原理工大学环境科学与工程学院,太原 030024)
随着国内城市中水深度处理技术的不断进步,再生水的应用领域变得更加广泛.将城市污水再生水作为工业冷却补充水的水源是目前世界各国解决缺水问题的首选方案,而其带来的微生物腐蚀问题是目前各工业企业关注的焦点.金属腐蚀是由金属表面、无机腐蚀产物、微生物细胞及其代谢产物协同作用产生的.铁细菌又称为铁氧化细菌(iron-oxidizing bacteria, IOB),是造成金属腐蚀的主要微生物之一.IOB能将二价铁氧化成三价铁然后转化为FeOH3沉淀,并从中获取能量[1].这些氢氧化铁在管壁表面形成沉淀,在管道表面形成小阳极点,与水体中氧气存在的大范围阴极区域形成原电池,发生局部腐蚀[2-3].在微生物腐蚀方面,现有研究主要集中在铁细菌与其他细菌共同作用产生腐蚀方面[4-6],而有关铁细菌的生长特性及其引起的腐蚀机理方面的研究较少.为了研究铁细菌的腐蚀作用,本文通过相应的电化学实验以及静态挂片腐蚀实验来研究铁细菌对碳钢的腐蚀行为.
1 实验部分
1.1 材料与设备
所用材料包括:菌种,由冷却塔下的储水池中所取循环冷却水中获取;尿素培养基[7]、Winogradsky培养基[8]、Stokes培养基[7]、CGY培养基[7]、碳源利用鉴定培养基[7]、生长特性基础培养基[9],自制;葡萄糖、蔗糖、甘油、可溶性淀粉,天津市北方天医化学试剂厂生产;乳糖、柠檬酸钠、草酸钠、半乳糖,天津市光复精细化工研究所生产;NH4NO3、(NH4)2SO4,天津市天大化工实验厂生产;尿素,天津市江天化工技术有限公司生产;KNO3、NaNO3,天津市津科精细化工研究所生产.
所用设备包括:WKMZ-Ⅱ型智能动态模拟装置,高邮市新邮仪器厂生产,设定浓缩倍数3.0,进口温度25℃,pH控制在8.5以下,以天津市某再生水厂出水为补充水,不投加杀生剂;CS2350电化学工作站,武汉科斯特公司生产,Q235碳钢工作电极内径为8 mm、有效截面积为0.502 4 cm2;Q235标准腐蚀挂片,高邮市新邮仪器厂生产,长×宽×厚为50 mm×25 mm×2 mm,本研究所采用的Q235碳钢成分为C(≤0.22%)、Mn(≤1.4%)、Si(≤0.35%)、S(≤0.050%)、P(≤0.045%),余量为Fe;XL-30TMP型环境扫描电子显微镜(EMES),荷兰Philips公司产品.
1.2 较为纯净的菌种培养
取水样接种到尿素培养基、Stokes培养基富集得到鞘细菌,在28℃下培养24~48 h,观察取出培养基中的半透明絮体,接种到Winogradsky培养基上,在28℃下进行培养,富集得到具有氧化铁能力的鞘细菌[7-8].对氧化铁鞘细菌进行分离,可在Stokes培养基的基础上添加1.5%~2.0%的琼脂,制成固体培养基,采用划线分离的方法分离得到单个菌落.将分离得到的菌落接种到CGY培养基上,等形成大量的单菌体后,用无菌水制备形成适当浓度的菌悬浊液.得到的菌种再重复进行分离、纯化2~3次[7,10-11],从而得到较为纯净的菌种,并用蒸馏水法保存.
1.3 IOB最佳碳源和最佳氮源的确定
将得到的IOB接种到装有不同碳源和氮源鉴定培养基的试管中进行筛选实验[7].参照《工业循环冷却水中菌藻的测定方法第6部分:铁细菌的测定MPN法》[12],测定铁细菌的数量来反映其生长情况.
(1)最佳碳源的确定:将生长特性基础培养基[9]中的柠檬酸铁铵按1%的质量分数添加,在此基础上分别以碳含量相同的不同碳源代替柠檬酸铁铵,测定铁细菌数量.
(2)最佳氮源的确定方法:将生长特性培养基中的NaNO3按0.2%的质量分数进行添加,在此基础上分别以氮含量相同的不同氮源代替NaNO3,测定铁细菌数量.
1.4 开路电位和极化电阻的测定
采用CS2350电化学工作站,在30℃±1℃条件下进行测试.采用传统三电极体系,Q235碳钢为工作电极,饱和甘汞电极作参比电极,大面积铂电极作辅助电极.电位基本稳定后对自腐蚀电位进行测试.极化电阻的测定采用电动扫描法,扫描速率为1 mV/s(电流-60~-150 μA),利用仪器自带CView软件采用线性区域进行计算.
1.5 腐蚀挂片试验
将2块经过除油、紫外线灭菌的Q235标准腐蚀挂片分别悬挂于2个250 mL具塞三角瓶中,瓶中均装满经过121℃灭菌的液体培养基,并用40 nm无菌滤膜密封,在30℃下培养5 d,将其中1瓶按5%接种量接种铁细菌液、另1瓶不做任何处理后,仍密封置于30℃培养;30 d后取出挂片,清洗、干燥后用XL-30TMP型环境扫描电子显微镜(EMES)对碳钢挂片腐蚀的表面形貌及能谱进行分析.
2 结果与讨论
2.1 最佳碳源的确定
以葡萄糖、蔗糖、甘油、乳糖、柠檬酸钠、草酸钠、半乳糖及可溶性淀粉为碳源,对IOB进行培养,经实验分析确定铁细菌能够利用的碳源包括:葡萄糖、蔗糖、甘油、乳糖、柠檬酸钠.选择其中较为常用的碳源,并通过测定铁细菌数来确定各种碳源利用的程度,确定最佳碳源.图1所示为不同碳源下IOB的数量变化情况.
由图1可以看出,当添加碳源为柠檬酸铁铵时,铁细菌数量最大;碳源为甘油、葡萄糖时次之;碳源为蔗糖、柠檬酸钠、乳糖时,铁细菌生长较为缓慢.将碳源为柠檬酸铁铵的铁细菌数量计为100%,计算其他各种碳源下铁细菌数量的相对百分数,结果表明:甘油、葡萄糖的相对百分数较高,分别为94.1%和88.2%;而蔗糖的相对百分数为58.8%,乳糖、柠檬酸钠的均不足50%.由此可见,铁细菌对不同碳源利用能力的顺序为:柠檬酸铁铵>甘油>葡萄糖>蔗糖>柠檬酸钠>乳糖.因此,铁细菌最适宜碳源为柠檬酸铁铵.这是由于铁细菌一般生活在含氧量少但溶有较多铁质及二氧化碳的弱酸性水体中,柠檬酸铁铵更能促进微生物生长的原因可能是柠檬酸铁铵能够分解出铁离子,从而促进铁细菌的生长,增加对碳源的利用.

图1 不同碳源下IOB的生长情况Fig.1 Growth state of IOB cultured by different carbon sources
2.2 最佳氮源的确定
图2所示为不同氮源下IOB的数量变化情况.

图2 不同氮源下IOB的生长情况Fig.2 Growth state of IOB cultured by different nitrogen sources
由图2可以看出,氮源为NaNO3时铁细菌数量最大;氮源为NH4NO3、(NH4)2SO4、尿素时次之;氮源为KNO3时,铁细菌数量最少.将氮源为NaNO3的铁细菌数量计为100%,计算其他氮源下铁细菌数量的相对百分数.结果表明:氮源为NH4NO3、(NH4)2SO4时,相对百分数均为77.8%;氮源为尿素时,相对百分数为66.7%;当氮源为KNO3时,只有24.4%.因此,铁细菌对不同氮源的利用能力顺序为:NaNO3>NH4NO3≈(NH4)2SO4>尿素>KNO3,最适宜的氮源为NaNO3.这主要是因为NaNo3为氮源时IOB的产酶量较高,此时IOB的微生物活性相对更强[9].
2.3 pH值对IOB生长的影响
在30℃利用生长特性基础培养基进行培养,只改变pH值的情况下,铁细菌生长数量随着pH值变化的情况如图3所示.

图3 pH值对IOB生长的影响Fig.3 Effect of pH value on growth of IOB
由图3可以看出,在pH值为6.5~7.5的范围内,铁细菌能保持较高的数量;在pH值为7.0时,铁细菌数量最大,达到7.0×106个/mL.pH会影响铁细菌的生物活性.铁细菌好气,嗜中性和弱酸性环境,且在碱性条件下不易生长.实验结果的最佳pH值范围支持了这一理论.
2.4 IOB生长过程中碳钢的电化学指标
利用电化学工作站对30℃时碳钢电极在接种有铁细菌的液体培养基中的开路电位、极化电阻、腐蚀率随时间的变化趋势进行测定,结果如图4所示.
由图4可以看出,在无菌溶液中碳钢电极的开路电位保持在-0.65 V左右,其极化电阻和腐蚀率也分别保持在1 230 Ω/cm2和0.25 mm/a不变.在有菌溶液中,开路电位和极化电阻都是在接种铁细菌后先变大再变小,最终分别保持在-0.72 V和950 Ω/cm2不变;其腐蚀率先变小后变大最终保持在0.32 mm/a左右,最终有菌溶液的腐蚀速率保持在无菌溶液的1.28倍左右.由此可知:在接种铁细菌后碳钢的腐蚀先降低,这是因为培养基本身对碳钢的腐蚀较小,金属表面形成一层有机覆盖层,刚接种时铁细菌少,细菌处于增长期,代谢产物生成速率慢,此时电极表面覆盖的生物膜致密,对电极产生一定的保护作用[13].但是随着时间的进一步推进,碳钢的腐蚀速率逐渐增加,最终超过无菌电解池碳钢的腐蚀速率,并保持不变.这主要是因为铁细菌达到一定数量后,可以比较稳定地进行新陈代谢活动,增大了反应动力,促进了碳钢的腐蚀.
2.5 IOB对挂片形貌影响的ESEM分析
通过观察发现,在无菌培养液中的挂片表面平整;而有菌培养液中的挂片表面颜色变化很大,部分区域接近铁锈的颜色,且该区域内有一些点状凹陷的腐蚀坑,为铁细菌促进碳钢点蚀所致.有菌培养液中的挂片发生点蚀主要与碳钢表面生物膜覆盖不均匀和代谢产物有关[14].进一步应用ESEM对无菌和接种有铁细菌的培养液中的挂片进行形貌分析.挂片在培养液中放置30 d后的ESEM图片如图5所示.
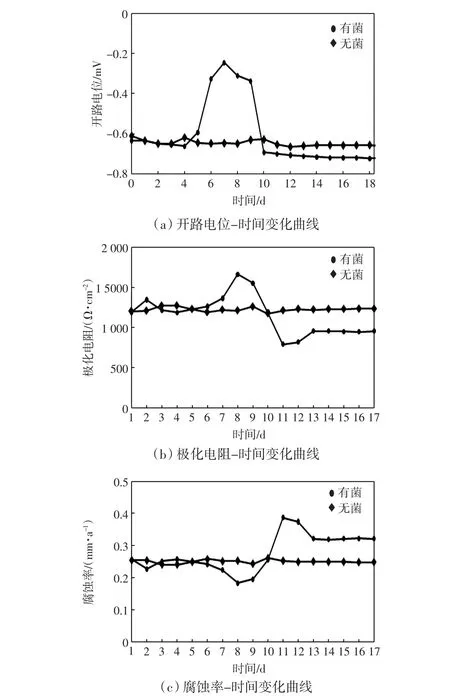
图4 IOB对相应电化学指标的影响Fig.4 Influence of IOB on electrochemical index

图5 Q235碳钢在培养基中30d后的腐蚀表面微观形态Fig.5 Micrographs of corrosion product formed by carbon steel immersed 30 d in medium
由图5可以看出,无菌培养液中的挂片表面存在一些分布比较均匀、形状以圆形居多的平滑凸起,并没有复杂的结构;而有菌培养液中的挂片表面存在2种形态显著不同的结构,一种是表面粗糙的球状结构,另一种则是片层结构.Duan等[15]在研究海水自然水体的微生物膜引起的碳钢腐蚀时也发现了这2种结构,认为此种片状结构是一种铁氧化物,可能包含FeCO3成分.
2.6 IOB对碳钢腐蚀的元素分析
针对图5电镜扫描图,对无菌、接种有铁细菌的培养基中的碳钢挂片采用能谱进行元素成分及含量分析,所获得的能谱图如图6所示,表1所示为腐蚀产物环境扫描电镜的能谱测试结果.

图6 培养液中挂片能谱图Fig.6 EDS spectra of carbon steel coupons in medium
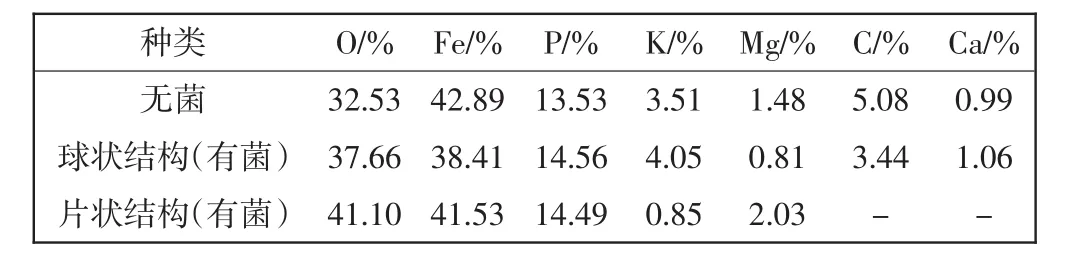
表1 腐蚀产物环境扫描电镜能谱测试结果(质量分数)Tab.1 Result of EDS spectra of carbon steel corrosion product(percentage of quality)
由图6和表1可以看出,无论有菌还是无菌培养液中的碳钢挂片,其表面主要物质均为铁氧化物,但各挂片表面的元素含量有所不同.与无菌培养液中的挂片相比,有菌培养液中的挂片球状和片状结构中O、P含量均有所增加,Fe含量均有所下降.这是由于O、P等元素是微生物细胞、代谢产物的主要组成元素,由于微生物细胞及代谢产物的附着而导致O、P等元素含量的增加.铁细菌会使Fe元素被氧化成Fe2+、Fe3+离子并从金属表面游离出来,因此导致挂片表面Fe的含量减少.对于有菌培养液中的挂片表面两种腐蚀结构元素组分的差异,可能是由挂片表面生物膜分布不均匀造成的.
综上所述,IOB的参与可明显影响碳钢挂片的元素成分及含量,使金属的腐蚀加重.
3 结论
(1)IOB对不同碳源的利用能力顺序为:柠檬酸铁铵>甘油>葡萄糖>蔗糖>柠檬酸钠>乳糖,铁细菌的最适宜碳源为柠檬酸铁铵.
(2)IOB对不同氮源的利用能力顺序为:NaNO3> NH4NO3≈(NH4)2SO4>尿素>KNO3,最适宜的氮源为NaNO3.
(3)IOB最适宜的pH值范围为6.5~7.5,最佳pH值为7.0.
(4)铁细菌促进了碳钢微生物腐蚀的发生,并且使挂片发生点蚀,这主要与生物膜分布不均匀和代谢产物有关.
(5)IOB能使挂片腐蚀表面产生球状(可能包含腐蚀产物FeCO3)和片状两种不同的结构,并且两种结构的元素成分有所差异,可能与生物膜在电极表面覆盖不均匀和代谢产物有关.
[1]STAROSVETSKY J,STAROSVETSKY D,ARMON R.Identification of microbiologically influenced corrosion(MIC)in industrial equipment failures[J].Engineering Failure Analysis,2007,14(8):1500-1511.
[2] DAVID S,ROBERT A,JOSEF Y,et al.Pitting corrosion of carbon steelcaused by iron bacteria[J].International Biodeterioration and Biodegradation,2001,47:79-87.
[3] 尹宝俊,赵文轸.金属微生物腐蚀的研究[J].四川化工,2004,7(1):30-33.
[4]RAO T S,SAIRAM T N,VISWANATHAN B,et al.Carbon steel corrosion by ironoxidising and sulphate reducing bacteria in a freshwater cooling system[J].Corrosion Science,2000,42(8):1417-1431.
[5]XU Congmin,ZHANG Yaoheng,CHENG Guangxu,et al.Localized corrosion behavior of 316L stainless steel in the presence of sulfate-reducing andiron-oxidizing bacteria[J].Materials Science and Engineering,2007,443(1):235-241.
[6] 段冶,李松梅,杜娟,等.Q235钢在假单胞菌和铁细菌混合作用下的腐蚀行为[J].物理化学学报,2010,26(12):3203-3211.
[7] 许旭萍,佘晨兴,林跃鑫,等.水体中氧化铁鞘细菌的分离鉴定及保藏[J].应用与环境生物学报,2003,9(3):313-317. [8]佘晨兴,许旭萍,李惠珍.污水中氧化铁鞘细菌的分离及其酶学特性研究[J].福建师范大学学报:自然科学版,2005,21(1):81-84.
[9] 林跃鑫,佘晨兴,许旭萍,等.氧化铁鞘细菌铁氧化酶最适产酶条件及其酶学特性的研究[J].水生生物学报,2004,28(4):385-389.
[10]翁稣颖,柯嘉康,戚蓓静,等.球衣细菌的纯种分离、鉴定和保存[J].微生物学报,1980,20(4):351-355.
[11]陈绍铭.水生微生物学实验方法[M].北京:海洋出版社,1985:102-104.
[12]中国国家标准化委员会.GB/T14643.6-2009,工业循环冷却水中菌藻的测定方法第6部分:铁细菌的测定MPN法[S].北京:中国标准出版社,2009.
[13]李相波,王佳,王伟.海洋环境微生物附着的电化学检测技术[J].中国腐蚀与防护学报,2005,25(2):84-87.
[14]刘宏芳,刘涛.嗜热硫酸盐还原菌生长特性及其对碳钢腐蚀的影响[J].中国腐蚀与防护学报,2009,29(2):93-98.
[15]DUAN Jizhou,WU Suru,ZHANG Xiaojun,et al.Corrosion of carbon steel influenced by anaerobic biofilm in natural seawater[J].Electrochimica Acta,2008,54(1):22-28.
