烟草过氧化氢酶基因CAT1的克隆及表达特征分析
2014-11-27王升平杨金广战徊旭申莉莉钱玉梅武侠王凤龙李锡宏陈晓明宋玉川
王升平,杨金广,战徊旭,申莉莉,钱玉梅,武侠,王凤龙,李锡宏,陈晓明,宋玉川
1 青岛农业大学农学与植物保护学院 山东省植物病虫害综合防控重点实验室,山东 青岛 266109;
2 中国农业科学院烟草研究所 烟草行业烟草病虫害监测与综合治理重点开放实验室,山东 青岛 266101;
3 湖北省烟草科研所,湖北 武汉 430032;
4 贵州省烟草公司遵义市公司,贵州 遵义 563000;
5 云南烟草保山香料烟有限责任公司,云南 保山 678000
生物技术
烟草过氧化氢酶基因CAT1的克隆及表达特征分析
王升平1,2,杨金广2,战徊旭2,申莉莉2,钱玉梅2,武侠1,王凤龙2,李锡宏3,陈晓明4,宋玉川5
1 青岛农业大学农学与植物保护学院 山东省植物病虫害综合防控重点实验室,山东 青岛 266109;
2 中国农业科学院烟草研究所 烟草行业烟草病虫害监测与综合治理重点开放实验室,山东 青岛 266101;
3 湖北省烟草科研所,湖北 武汉 430032;
4 贵州省烟草公司遵义市公司,贵州 遵义 563000;
5 云南烟草保山香料烟有限责任公司,云南 保山 678000
基于GeneBank中已有的植物Catalase1(CAT1)基因序列设计烟草CAT1的特异性引物,通过RT-PCR扩增克隆获得Nicotiana tabacum var.NC89 CAT1全长mRNA序列,编码492个氨基酸残基。遗传进化分析显示烟草CAT1与N .benthamiana CAT1基因亲缘关系最近。利用real-time RT-PCR技术分析了CAT1基因在烟草中的组织表达特异性和烟草NC89应对生物和非生物胁迫的表达差异。结果表明CAT1基因在烟草NC89的根、茎、叶、花瓣、花萼、种子中均有表达,其中在根部表达量最低,在叶中相对表达量最高。生物和非生物胁迫处理烟株,其CAT1诱导表达分析显示,机械损伤、渗透压、低温和高温、干旱、和感染TMVCAT1表达量上调,紫外胁迫下表达量下调。上述研究表明烟草CAT1基因可能参与了植物的生长发育、应对非生物和生物胁迫的过程。
过氧化氢酶;烟草;表达分析;生物胁迫;非生物胁迫
过氧化氢酶(Catalase,CAT)是第一个被发现的抗氧化酶,Loew将其命名为Catalase[1],CAT普遍存在于能呼吸的生物体内,在植物体内主要存在于叶绿体、线粒体、内质网中,而在动物体主要存在肝和红细胞中[2]。过氧化氢酶主要功能是催化H2O2分解为H2O与O2,减少H2O2与O2在铁螯合物作用下反应生成对植物有害的·OH,研究表明过氧化氢酶在环境变化产生的活性氧毒害过程中起重要作用[3-4],其酶促活性为机体提供了抗氧化防御机制。通过提高植物体内抗氧化酶活性和增强抗氧化代谢的水平可以提高植物本身的抗逆性[5]。
物理损伤[6]、臭氧[7]、二氧化硫[7]、紫外线[8]和冷害[9]等环境因素对CATs家族表达影响显著。研究发现CAT与植物的抗病反应密切相关,CAT基因缺失的烟草中H2O2含量升高,并产生类似于凋亡的细胞死亡[10];在植物受到病原微生物浸染的氧化迸发初期阶段,CAT分解H2O2生成氧分子,触发了苯甲酸生成SA,导致系统性防卫反应(SAR)发生;转玉米CAT基因的烟草引起更为严重的超敏反应(HR),从而有效地控制细菌感染[11]。现已确定CATs活性的高低与植物对逆境的适应呈正相关,CATs在植物防御、衰老、胁迫应答及控制氧化还原平衡等方面具有重要作用[12]。
为揭示烟草CAT1基因在植物应对生物胁迫和非生物胁迫中的功能,深入研究植物抗病和抗逆机制。本研究基于已经报道的CAT1基因的序列,克隆了烟草NC89(Nicotiana tabacumvar.NC89)CAT1基因并对其进行了表达分析。
1 材料和方法
1.1 材料
烟草材料及毒源:NC89、烟草花叶病毒(Tobacco mosaic virus,TMV)毒源为中国农业科学院烟草研究所保存。除特别注明,烟草材料在25℃,14 h光照/10 h黑暗条件下培养。
试剂:LB固体和液体培养基、RNA提取试剂盒,cDNA反转录试剂盒,pEASY-T1载体,大肠杆菌DH5α购自青岛群昌科贸有限公司(TRANS);dNTP Mixture,Taq酶,Loading buffer,DNA marker、DNA凝胶回收试剂盒等购自宝生物工程(大连)有限公司(TaKaRa);氨苄青霉素钠盐购自上海生工生物工程技术服务有限公司;引物:CAT1F:AGAAAGGCAACTAATGGA;CAT1R:ATTGACATCACCTCCTCC由宝生物工程(大连)有限公司(TaKaRa)合成。
1.2 总RNA提取、反转录
烟草样品采集后放入液氮中速冻,并转入-80℃超低温冰箱保存。总RNA提取及反转录cDNA参照试剂盒说明书,引物为通用引物OligdT18。
1.3 克隆、鉴定及测序
PCR扩增体系总体积为50 μL,包括cDNA 1 μL、引物各 2 μL、10×TransTaqHiFi BufferⅡ 5 μL、2.5 Mm dNTPs 4 μL、TransTaqTMHiFi DNA Polymerase 1 μL、ddH2O 35 μL。扩增条件为:94℃预变性4 min;94℃变性30 s,50℃退火30 s,72℃延伸1 min,重复35个循环;72℃后延伸10 min。扩增产物经1%琼脂糖凝胶电泳回收获得目的DNA片段,并连接到载体pEASY-T1,转化大肠杆菌DH5α,挑取阳性克隆送上海英潍捷基贸易有限公司测序。
1.4 样品器官处理
分别取正常生长条件下成熟烟草NC89的根、茎、叶、花瓣、花萼和种子。
1.5 胁迫处理
1.5.1 机械损伤:对NC89上数第2片叶进行针刺处理,每片叶针刺50次,分别于刺后的4、8、12、16 h 后取样,以相同培养条件下的正常生长叶片为对照。
1.5.2 渗透压:采用250 mmol·L-1NaCl喷施叶面处理2、4、6、8、10 h取上部第2片叶,以清水处理为对照。
1.5.3 温度处理:在4℃环境下培养NC89幼苗分别于4、8、12、16 h取上部第2片叶,40℃环境下培养NC89幼苗分别于4、8、12、16 h取上部第2片叶,以相同温度的清水浇灌,以25℃培养条件为对照。
1.5.4 干旱处理:消除浇水1、3、5、7 d处理烟苗采集上部第2片叶,以正常浇水为对照。
1.5.5 紫外处理:紫外照射分别于2、4、6、8、10 h采集上部第2片叶片,以正常条件下叶片作对照。
1.5.6 TMV侵染:对NC89接种TMV病毒后,分别24 h、 48 h和72 h后取上部第2片叶,以清水处理为对照。每个处理三次生物重复,处理后取样,液氮中研磨成粉末,分装保存,置于-80℃条件下保存备用。
1.6 real-time RT-PCR对表达差异的分析
提取各处理样品总RNA并进行反转录成cDNA,根据克隆获得的烟草CAT基因序列,通过PerPrimer软件进行real-time PCR特异性引物设计[13],C1F:TACCGCTCATTCACACCA;C1R:TCACCTCCTCCGAAACCA;18sF:A G G AT T G A C A G A C T G A G A G C;1 8 s R:CACAGACCTGTTATTGCCTC,18s rRNA为内参基因。利用Oligo 6.0软件和在线数据库Oligo Calc(http://www.basic.northwestern.edu/biotools/oligocalc.html)对所设计的引物进行评价,并通过在线BLSAT程序(http://www.ncbi.nlm.nih.gov/blast/)进行验证,PCR反应在AB7500 Real-time PCR 仪进行,反应体系按TaKaRa SYBR® Premix Ex TaqTM试剂盒说明书。CAT1反应程序:95℃ 10 s,95℃ 10 s,95℃ 5 s,54℃ 37 s;18sActin反应程序:95℃ 10 s,95℃ 10 s,95℃ 5 s,53℃ 37 s。测定值用平均值加标准差表示,采用CT值来比较各样品中CAT1基因的相对表达量,CAT1基因相对表达量用CAT1基因 mRNA水平比18srRNA(内参基因)mRNA水平的相对倍数来表示。
2 结果与分析
2.1 CAT1基因克隆及序列分析
根据Gene Bank中已有的植物CAT1基因序列设计一对烟草CAT1的特异性引物(CAT1F、CAT1R),通过烟草叶片的总RNA提取,RT-PCR扩增和测序。获得片段为1532 bp(Genbank登录号:HF564631),其中包含CAT1 1479 bp完整的读码框(ORF)。

图1 NC89CAT1基因序列扩增Fig.1 PCR amplification of NC89 CAT1 gene sequence
通过DNAMAN 6.0软件分析CAT1 ORF序列编码一条492个Aa氨基酸残基的多肽序列,这与已有报道相符[14]。经ExPASy网站ProtParam在线工具分析(http://www.expasy.org/proteomics)预测分子量为56.85 kDa,等电点(pI)为6.86。利用MEGA 4.0软件的Neighbor-Joiniing(N-J邻近法)对已知不同物种的CAT1序列与NC89的CAT1序列进行序列比对构建系统进化树(图2)。在选取的15个物种中,按CAT1序列划分为三大类,水稻和小麦各单独分为一簇; 玉米、大豆、拟南芥和茄科作物分至另一大簇,在这一大簇中又被划分为5个组,其中拟南芥、玉米与大豆单独各成一组。普通烟草Petit Havana、N.sylvestris、番茄和马铃薯划分为一个组,在该组中普通烟草Petit Havana和N.sylvestris单独划分为一小组,番茄和马铃薯被划分为另一小组。其它烟属植物划分至另一个组,该组中三生烟、心叶烟和灰叶烟草划为一小组,普通烟NC89和本氏烟单独成另一小组。值得注意的是三生烟、心叶烟和灰叶烟草这一小组中,枯三生和心叶烟均对TMV侵染产生免疫反应,灰叶烟草对TMV的反应未知,但普通烟草NC89和本氏烟均对TMV表现为系统侵染症状。
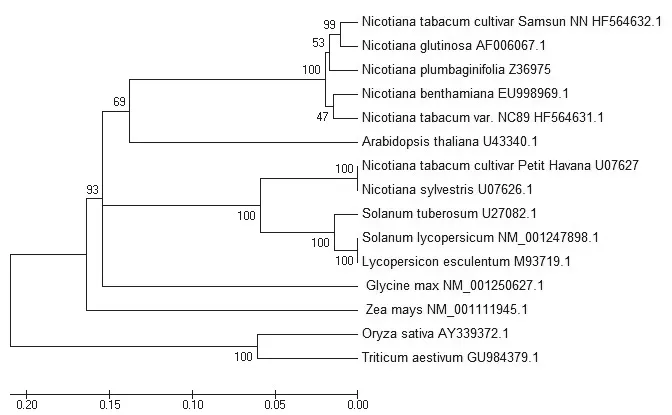
图2 植物CAT1系统发育树Fig.2 Phylogenetic trees of plant’s CAT1 gene
2.2 CAT1不同器官表达特异性分析

图3 烟草NC89不同器官CAT1基因RT-PCR表达量Fig.3 Relative expression levels of CAT1 genes in Nicotiana tabacum organs
烟草NC89不同器官中CAT1基因Real-time RTPCR表达量分析显示:CAT1基因在烟草NC89的根、茎、叶、花瓣、花萼、种子中都有表达,且器官间CAT1基因表达显著差异。CAT1基因在根表达量最低,叶中表达量最高,是根的5700倍,花萼次之,是根的1400倍,花瓣和茎中表达量分别是根的270倍、24倍,种子表达量是根的1.5倍(图3)。
2.3 CAT1胁迫表达分析
机械损伤处理显示:CAT1基因对机械损伤响应较慢。机械损伤4 h后,CAT1基因表达量较对照几乎未增长,机械损伤8 h和12 h,CAT1基因表达量轻微增加,为对照的3~4倍,处理16 h后CAT1表达量显著增加达到最大值是对照的43倍。
渗透压处理也能提高CAT1基因的相对表达量,表达量为先升后降的过程。NaCl处理2 h后出现轻微增加,在处理4 h后达到最高峰是对照的6倍,处理6 h后CAT1基因相对表达量则明显的下降,处理8 h后CAT1基因的相对表达量与对照基本持平。
低温处理能够提高CAT1基因的相对表达量,在处理4 h达到最高值是对照的8倍,处理8 h后开始有轻微的降低是对照的6倍,处理12 h后出现明显下降是对照的4倍,在处理16 h后达到最低值与对照基本持平。
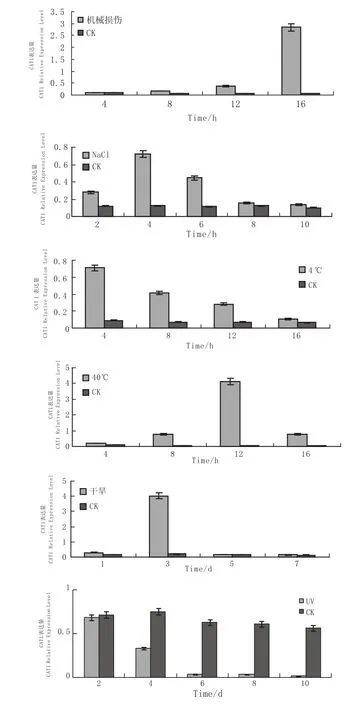
图4 非生物诱导处理NC89CAT1基因 RT-PCR表达分析Fig.4 Relative expression of NC89CAT1 gene under abiotic inducement
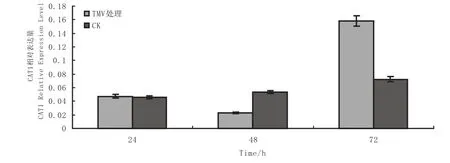
图5 接种TMV处理NC89CAT1基因 RT-PCR表达分析Fig.5 Relative expression of NC89CAT1 gene under inoculation of TMV
高温处理显示:CAT1基因对40℃高温响应较快。处理4 h后CAT1基因相对表达量升高是对照的2倍,处理8 h后CAT1基因相对表达量继续上升是对照的10倍,处理12 h后CAT1基因相对表达量达到最高值是对照的50倍,处理16 h后CAT1相对表达量则明显下降,约为对照的10倍。
干旱处理明显提高了CAT1基因的相对表达量,干旱处理1 d后CAT1基因相对表达量出现轻微增加,在处理3 d后达到最高峰是对照的20倍,处理5 d后CAT1基因相对表达量出现明显下降与对照相近,处理7 d后表达量与对照持平。
紫外处理明显抑制了CAT1基因的相对表达量,处理2 h后与对照表达量基本持平,处理4 h后CAT1基因表达量是对照的1/2,处理6 h、8 h后,CAT1表达量是对照的1/20,处理10 h后CAT1基因表达量达到最低水平是对照的1/38。
接种TMV处理CAT1基因先下降后上升,在处理24 h未变化,处理48 h后明显抑制是对照的1/2,处理72 h后出现上升是对照的2倍。
3 结论与讨论
CATs家族由多基因编码,在被子植物中,包括烟草、拟南芥、玉米、南瓜和大米等都发现三种过氧化氢酶基因[15-19]。本研究从N.tabacumvar.NC89叶片克隆获得CAT1 基因cDNA序列,通过Neighbor-Joiniing(N-J邻近法)构建系统发育树分析发现NC89CAT1与本氏烟的CAT1基因序列同源性较高。
前人研究表明,CAT1的表达具有组织和器官特异性。在正常生长条件下,玉米CAT1在盾片、叶、上胚轴及未成熟果实内均有表达[20];拟南芥CAT1、CAT2和CAT3在花序和种子内都表达,CAT2和CAT3在叶中表达量高[21];蓖麻CAT1主要在胚乳和胚轴中表达[22]。本研究通过real-time RT-PCR对CAT1在NC89的不同组织部位表达特征进行了分析。其结果:CAT1基因在烟草NC89的根、茎、叶、花瓣、花萼、种子中都有表达,CAT1基因在叶组织中表达量最高,花萼和花瓣次之,根、茎、种子表达量相对较低,其中根组织表达量最低,可能与植物地上部的光呼吸产生的H2O2清除有关,而相对于地下部的光呼吸产生的H2O2的清除则可能与其他同源基因的表达有关。
机械损伤胁迫可以使NC89CAT1基因显著上调。在玉米未成熟的种子中,机械损伤处理能够诱导3种CATs基因提高表达量;而在成熟叶片中,仅有CAT1和CAT3表达量提高,都在处理12 h后表达量显著提高,CAT基因参与了玉米对损伤的适应[23]。本研究中,NC89在遭受机械损伤时,CAT1表达量变化与玉米的CAT1基因表达趋势一致。从而推测NC89在遭受机械损伤时,CAT1表达量与玉米CAT1有同样的功能。
CAT1的表达与盐胁迫相关。高羊茅FaCAT1能够清除渗透胁迫下产生的H2O2,Northem杂交的时间曲线表明,植株叶片在受到高盐胁迫时,FaCAT1在高盐处理4 h后,CAT1的表达量增加到最大[14]。红麻在盐渍诱导下CAT酶活性上升,清除活性氧造成的损害[24]。本研究中盐胁迫能够提高NC89CAT1表达量,清除高盐胁迫下产生的H2O2,从而参与高盐胁迫的适应。
低温和高温胁迫都能够引起CAT1基因上调。在14℃冷锻炼时玉米CAT3表达增强、酶活力提高,并可以提高在5℃低温冷处理时对氧化胁迫的抗性[25];随着冷驯化时间的延长,拟南芥(Arabidopsis thaliana L.Heynh.)叶绿体基质中CAT2的含量都有不同程度地增加[26],低温胁迫可使冬小麦叶中CAT活性升高,从而减轻膜脂过氧化伤害,使小麦对低温产生一定的抗性[27]。Rainwater等发现,高温胁迫导致番茄(Solanum lycopersicum Linn.)产量降低,而耐热品种比热敏感品种产量降低少,在耐热品种中CATS活性都明显增加[28]。本研究中低温胁迫能诱导NC89CAT1基因上调,通过提高CAT活性增强烟株对低温胁迫耐受性。而在高温胁迫条件下CAT1基因表达量提高说明CAT1基因可能在夏季高温天气适应过程中发挥着重要作用。
干旱胁迫能够诱导CAT1基因上调。高粱具有较强的抗早能力和伤害修复及超补偿能力,在干旱胁迫条件下高粱CAT活性显著增加[29]。玉米在干旱胁迫下CAT等保护酶活性先升高后降低[30]。受到严重干旱时,小麦CAT1和CAT2的表达量显著增强[31]。本研究表明在烟株遭受干旱胁迫时,CAT1基因上调,可以推测其在适应干旱条件有着重要作用。
紫外胁迫能够引起CAT1基因下调。55 mJ·m-2强度的紫外线照射影响N.plumbaginifolia L.三种CAT基因表达量,CAT1基因下调,而CAT2和CAT3基因上调[8]。胡萝卜CAT1基因在紫外处理1 h后被诱导表达,而CAT2、CAT3则在处理6 h后才被诱导表达[32]。本研究结果与在N.plumbaginifolia L.中CAT1基因变化一致,而与胡萝卜等植物中的CAT1基因表达量变化相反,因此推测在紫外光胁迫下可能引起NC89叶片光合作用的光失活,而CAT1基因表达受到光抑制,而此时NC89体内H2O2的清除可能由其他同源基因发挥作用。
植物受病原物侵染后,其过氧化物酶活性均有提高,而寄主植物的抗病性强弱不同其增幅也有差异。Sean等试验表明,病毒侵染后CAT酶活性降低[33];陈学平等研究表明,抗病品种CAT酶活性在感染TMV后低于感病品种[34];马学萍等发现枯斑三生烟接种病毒后响应TMV侵染伤害CAT酶活性提高,随后酶活降低可能与病毒侵染诱导植株获得系统抗性,缓解了病毒对植株的生理胁迫[35]。Zhanlin等的研究结果表明,感病植株接种病毒后前5天CAT酶活性升高,以后随之降低;而在保护植株中(以前曾接种过病毒,目前检测不到病毒含量,但是已获得对病毒免疫能力的植株)并没有发现CAT酶活性的明显变化[36]。到目前为止,烟株感病后体内CAT活性变化及其机制还未得到一致的结论,一般认为抗病品种的增减率低于感病品种,可能是由于抗病品种能尽快地接受病毒侵染信号并迅速传递、及时启动防卫反应的结果。本研究烟草NC89CAT1基因由于接种TMV出现上调,推测CAT1基因在抗TMV方面具有一定作用。
[1]Loew O.A new enzyme of general occurrence in organisms[J].Science,1990,11(279):701-702.
[2]刘灵芝,钟广蓉,熊莲,等.过氧化氢酶的研究与应用新进展[J].化学与生物工程,2009,26(3):15-18.
[3]Scandalios J G.Oxidative stress molecular perception and transduction of signal striggering antioxidant gene defenses[J].Brazilian Journal of Medical and Biological Research,2005,38(7):995-1001.
[4]Schriner S E,Linford N J,Martin G M,et al.Extension of marine life span by overexpression ofcatalase targeted to mitochondria[J].Science,2005,(308):1909-1911.
[5]王凤德,衣艳君,王海庆,等.豌豆过氧化氢酶在烟草叶绿体中的过量表达提高了植物的抗逆性[J].生态学报,2011,31(4):1058-1063.
[6]Lee S H,An C S.Differential expression of threecatalase genes in hot pepper(Capsicum annuum L.)[J].Molecules and cells,2005,20(2):247-255.
[7]Badiani M,Schenone G,Paolacci A R,et al.Daily fluctuations of antioxidants in bean(Phaseolus vulgaris L.)leaves as affected by the presence of ambient air pollutants[J].Plant and cell physiology,1993,34(2):271-279.
[8]Willekens H,Van C W,Van M M,et al.Ozone,sulfur dioxide,and ultraviolet B have similar effects on mRNA accumulation of antioxidant genes in Nicotiana plumbaginifolia L.[J].Plant Physiology,1994,106(3):1007-1014.
[9]Prasad T K,Anderson M D,Martin B A,et al.Evidence for Chilling-Induced Oxidative Stress in Maize Seedlings and a Regulatory Role for Hydrogen Peroxide[J].Plant Cell,1994,6(1):65-74.
[10]Pei Z M,Murata Y,Benning G,et al.Calcium channels activated by hydrogen peroxide mediate abscises acid signaling guard cells [J].Nature,2000,406(6797):731-734.
[11]Liang Yongchao,Chen Qin,Liu Qian,et al.Exogenous silicon(Si)increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley(Hordeum vulgare L.)[J].Journal of plant physiology,2003,160(10):1157-1164.
[12]Mandhania S,Madan S,Sawhney V.Antioxidant defense mechanism under salt stress in wheat seedlings[J].Biologia Plantarum,2006,50(2):227-231.
[13]Marshall O J.PerlPrimer:cross-platform,graphical primer design for standard,bisulphite and real-time PCR[J].Bioinformatics,2004,20(15):2471-2472.
[14]Yang WenLong,Liu JingMei,Chen Fan,et al.Identification of Festuca arundinacea schrebCat1catalase gene and analysis of its expression under abiotic Stresses[J].Journal of Integrative Plant Biology,2006,48(3):334-340.
[15]Willekens H,Inzé D,Van Montagu M,et al.Catalases in plants[J].Mol Breed,1998,1(3):207-228.
[16]Frugoli J A,Zhong H H,Nuccio M L,et al.Catalase is encoded by a multigene family in Arabidopsis thaliana(L.)Heynh[J].Plant Physiology,1996,112(1):327-336.
[17]Guan L,Scandalios J G.Molecular evolution of maizecatalases and their relationship to other eukaryotic and prokaryoticcatalases[J].Journal of molecular evolution,1996,42(5):570-579.
[18]Esaka M,Yamada N,Kitabayashi M,et al.cDNA longing and differential gene expression of threecatalases in pumpkin[J].Plant molecular biology,1997,33(1):141-155.
[19]Iwamoto M,Higo H,Higo K.Differential diurnal expression of ricecatalase genes:the 5’-flanking region ofCatA is not sufficient for circadian control[J].Plant Science,2000,151(1):39-46.
[20]Redinbaugh M G,Wadsworth G J,Scandalios J G.Characterization ofcatalase transcripts and their differential expression in maize[J].Biochimica et biophysica acta,1988,951(1):104-116.
[21]McClung C R.Regulation ofcatalases in Arabidopsis[J].Free radical biology & medicine,1997,23(3):489-496.
[22]Suzuki M,Ario T,Hattori T,et al.Isolation and characterization of two tightly linkedcatalase genes from castor bean that are differentially regulated[J].Plant molecular biology,1994,25(3):507-516.
[23]Guan L M,Scandalios J G.Hydrogen-peroxide-mediatedcatalase gene expression in response to wounding[J].Free radical biology & medicine,2000,28(8):1182-1190.
[24]陈涛,王贵美,祁建民,等.盐胁迫对红麻幼苗生长及抗氧化酶活性的影响[J].植物科学学报,2011,29(4):493-501.
[25]刘汉梅,张怀渝,谭振波,等.玉米Catalase-3基因克隆及低温表达研究[J].四川农业大学学报,2006,24(3):272-275.
[26]Goulas E,Schubert M,Kieselbach T,et al.The chloroplast lumen and stromal proteomes of Arabidopsis thaliana show differential sensitivity to short-and long-term exposure to low temperature[J].Plant Journal,2006,47(5):720-734.
[27]王树刚,王振林,王平,等.不同小麦品种对低温胁迫的反应及抗冻性评价[J].生态学报,2011,31(4):1064-1072.
[28]Rainwater D T,Gossetp D R,Millhollon E P,et al.The relationship between yield and the antioxidant defense system in tomatoes grown under heat stress[J].Free Radical Research,1996,25(5):421-435.
[29]Zhang A,Jiang M,Zhang J,et al.Mitogen-activated protein kinase is involved in abscisic acid-induced antioxidant defense and acts downstream of reactive oxygen species production in leaves of maize plants[J].Plant Physiology,2006,141(2):475.
[30]张仁和,郑友军,马国胜等.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5):1303-1311.
[31]Görlach J,Volrath S,Knauf-Beiter G,et al.Benzothiadiazole,a novel class of inducers of systemic acquired resistance,activates gene expression and disease resistance in wheat[J].Plant Cell,1996,8(4):629-643.
[32]Kwon S I,Lee H,An C S.Differential expression of threecatalase genes in the small radish(Rhaphanus sativus L.var.sativus)[J].Molecules and cells,2007,24(1):37-44.
[33]Clarke S F,Guy P L,Burritt D J,et al.Changes in the activities of antioxidant enzymes in response to virus infection and hormone treatment[J].Physiologia Plantarum,2002,114(2):157-164.
[34]陈学平,姚忠达,郭家明,等.不同烟草品种感染TMV过程中CAT,PAL活力变化研究[J].安徽农业大学学报,2002,29(2):103-107.
[35]马学萍,刘开全,和云,等.烟草与 TMV 非亲和性互作中根系活力及CAT活性变化[J].中国烟草科学,2012,33(1):78-80.
[36]Li Z L,Burritt D J.The influence of Cocksfoot mottle virus on antioxidant metabolism in the leaves of Dactylis glomerata L.[J].Physiological and Molecular Plant Pathology,2003,62(5):285-295.
Cloning of catalase gene(CAT1) and its expression patterns inNicotiana tabacumL.
WANG Shengping1,2,YANG Jinguang2,ZHAN Huaixu2,SHEN Lili2,QIAN Yumei2,WU Xia1,WANG Fenglong2,LI Xihong3,
CHEN Xiaoming4,SONG Yuchuan5
1 Key Lab of Integrated Crop Pest Management of Shandong Province,College of Agronomy and Plant Protection,Qingdao Agricultural University,Qingdao 266109,Shandong,China;
2 Key Laboratory of Tobacco Pest Monitoring Controlling & Integrated Management,Tobacco Research Institute,Chinese Academy of Agricultural Sciences,Qingdao 266101,Shandong,China;
3 Tobacco Research Institute of Hubei Province,Wuhan 430030,China;
4 Zunyi Municipal Tobacco Company,Zunyi 563000,Guizhou,China;
5 Baoshan Oriental Tobacco Company,Baoshan 678000,Yunnan,China
The full-length cDNA of Catalase 1(CAT1)from Nicotiana tabacum var.NC89 was cloned based on specific primers designed according toCAT1mRNA sequences in other plants.An amino acid sequence alignment indicated thatCAT1contains 492 amino acid residues.Phylogenetic analysis showed that NC89CAT1shares high similarity with gene from N.benthamiana.Real-time quantitative polymerase chain reaction(qPCR)analysis revealed thatCAT1is highly expressed in leaf and calyx,while less expressed in roots and seeds.The expression of NC89CAT1was enhanced by abiotic and biotic stressors,such as mechanical damage,osmotic pressure,low temperature,high temperature,drought,and TMV infection,whereas it was inhibited by ultraviolet irradiation.It was suggested thatCAT1plays an important role in growth,development,and interplay of abiotic and biotic stresses in plant.
catalase;nicotiana tabacum;expression analysis;biotic stress;abiotic stress
10.3969/j.issn.1004-5708.2014.05.017
Q81 文献标志码:A 文章编号:1004-5708(2014)05-0103-07
国家烟草专卖局全国烟草有害生物调查研究(110200902065);湖北省烟草公司科技项目(027Y2013-006);云南省烟草公司科技项目(2013YN37);遵义市烟草公司科技项目(2013-11);山东省“泰山学者”建设工程专项经费;中国农业科学院基本科研业务费预算增量项目(2013ZL025)
王升平(1988—),农学硕士,植物病理学,Email:844862497@qq.com
武 侠(1963—),博士,教授,植物线虫学,Tel:0532-86080594;Email:wuxia3897@163.com王凤龙(1964—),博士,研究员,植物病毒学,Email:wangfl@sohu.com
2013-10-21
