血管生成素样蛋白基因1和2(ANGPTL1、2)在多囊卵巢综合征患者卵丘颗粒细胞上的表达
2014-11-26薛茜文黄鑫郝翠芳
薛茜文,黄鑫,郝翠芳*
(1.山东青岛大学医学院,青岛 266021;2.山东烟台毓璜顶医院生殖医学中心,烟台 264000)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄妇女最常见的内分泌代谢紊乱性疾病之一,发病率高达5%~10%[1],也是女性无排卵性不育的常见原因,临床表现高度异质性,表现为:月经紊乱,无排卵或稀发排卵,雄激素过多,不少患者伴有胰岛素抵抗,导致高胰岛素血症[2]。PCOS患者无排卵或稀发排卵的主要原因是优势卵泡的募集过程障碍。卵泡的发育成熟的全过程涉及到较多的激素调节、信号转导及血管形成。卵丘细胞与卵母细胞之间复杂的“对话机制”在卵泡成熟过程中起着重要的作用,并对受精及胚胎的发育过程有着一定的影响[3]。卵泡的成熟过程遵循减数分裂,分为胞核和胞质两方面的成熟。卵的核成熟可以分为三个时期:germinal vesicle(GV)、metaphase I(M I)和 metaphaseⅡ (MⅡ)[4,5]。在核成熟过程的终极阶段,卵通过排出第一极体(PB)进入MⅡ期,达到成熟期,进而才有可能能完成正常受精[6]。
血管生成素样蛋白1和2(ANGPTL1和ANGPTL2)隶属于血管生成素样蛋白家族成员,参与调节血管的发生。在内皮细胞表面,ANGPTL1和ANGPTL2通过未知受体发挥作用来调节血管生成,根据所处的环境不同,可能是促进血管生成,也可能是抑制血管生成[7]。ANGPTL1 和ANGPTL2均是通过磷脂酰肌醇3-激酶途径(PI3-K)/Akt途径发挥作用,并且他们的共同活性很有可能在斑马鱼胚胎发育的过程起重要作用[8,9],但是关注点却在斑马鱼上,并未在人类身上展开其相关研究。有研究[10]证实,卵泡液中 ANGPT1和ANGPT2水平的改变很有可能与排卵前卵母细胞的发育有关。有研究[6]采用基因芯片技术证明,比起MⅠ时期的卵母细胞,MⅡ时期卵母细胞的卵丘颗粒细胞(CC)上ANGPTL1基因的高水平表达,进一步说明了ANGPTL1亦在基因水平参与卵泡的发育,但是并未筛选到基因ANGPTL2。近来越来越多的文献开始倾向于研究不同卵母细胞成熟期(GV、MⅠ、MⅡ)对应的 CC上不同的基因的表达[6,11],并且不仅仅局限于壁层或黄体颗粒细胞[12]。
本文采用实时荧光定量聚酶链反应(qRTPCR)来研究经过促排卵周期治疗的PCOS患者的MⅡ时期的CC上ANGPTL1和ANGPTL2基因的差异性表达。通过与非PCOS(non-PCOS)患者MⅡ时期CC上相应基因的表达进行定量分析,进而充分把握存在于PCOS和non-PCOS患者间控制卵核成熟的分子机制。
资料和方法
一、患者的选择
收集2013年1月~6月在烟台毓璜顶生殖中心就诊的PCOS患者38例作为实验组,PCOS的诊断均符合鹿特丹诊断标准[2],具备以下特征:长期稀发排卵或无排卵,雄激素分泌过多和多囊卵巢等特征,并排除库欣综合征、先天性肾上腺增生及一些分泌雄激素的肿瘤;另选取同期相同年龄段因男方因素不育就诊的non-PCOS患者42例为对照组,且妇女月经周期规律及内分泌均正常。本研究经本院临床研究伦理委员会批准,所有实验对象均满足以下特征(表1),且均签署相关知情同意书。
表1 临床患者指标( ±s)
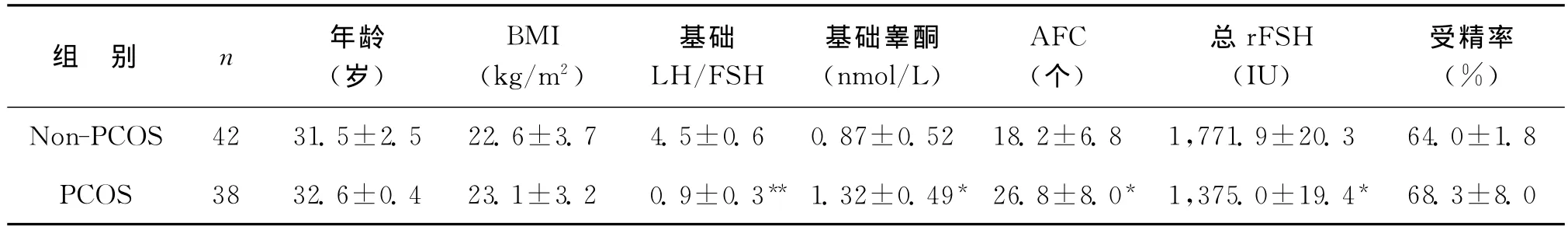
表1 临床患者指标( ±s)
注:与non-PCOS组比较,*P<0.05,**P<0.01
组 别 n 年龄(岁)BMI(kg/m2)基础LH/FSH基础睾酮(nmol/L)AFC(个)总rFSH(IU)受精率(%)Non-PCOS 42 31.5±2.5 22.6±3.7 4.5±0.6 0.87±0.52 18.2±6.8 1,771.9±20.3 64.0±1.8 PCOS 38 32.6±0.4 23.1±3.2 0.9±0.3** 1.32±0.49* 26.8±8.0* 1,375.0±19.4*68.3±8.0
二、主要试剂和仪器
RNA的提取采用 Qiagen RNeasy Mini Kit(Qiagen,Hilden,德国),RNA测定采用电泳仪和电泳槽(BIO-RAD,美国),TRANSILLUMINA70R,BINTA 2020D凝胶成像系统(北京华兴科仪科技公司),实时荧光聚合酶链反应试剂盒[TaKaRa Biotechnology(Dalian)Co.Ltd,日本]和逆转录仪(BIO-RAD T100TMThermal Cycle,美国),荧光定量 PCR采用 LightCycler(Roche Diagnostics,Mannheim,德国)和 Rotor Gene 3000system(Corbett,澳大利亚)。
三、方法
1.超排卵方案:根据文献[3,13],所有患者均采用长方案促排卵:在黄体中期开始给予促性腺激素释放激素激动剂(GnRH-a,Diphereline,Ipen,Pharma Biotech,法国),0.05mg/d 皮下注射,持续到14d,若测得血清雌二醇(E2)<30pg/ml(109.80pmol/L)、LH<5IU/L,则可以确定已达到降调节的理想状态,此时再给予重组人促性腺激素 (rFSH,Gona-f,Follitropin Alfa,Serono,瑞 士)(159.97~237.30IU/d)进行启动,阴道超声示有2个以上卵泡直径>18mm,测血清E2>300pg/ml(1,098pmol/L)并有1个主导卵泡时,当晚9:00左右给予人绒毛膜促性腺激素(HCG,Profasi,Serono,瑞士)10,000IU 肌肉注射。36h后,阴道超声引导下取卵。
2.CC的处理与分类:取出的卵丘-卵母细胞复合物(COCs)浸于IVF-3.0培养液(Qiagen,Hilden,德国)中,显微镜下用5ml注射器的细针将CC从邻近的卵母细胞上进行剥离,将每一个卵母细胞对应的剥离下来的CC收集在一个盛有80μl Buffer裂解液(RNeasy Minikit,Qiagen,Hilden,德国)的微量离心管(Eppendorf)中。冻存于-80℃冰箱,实验备用。选取成熟的MⅡ期卵母细胞对应的卵丘颗粒细胞(CCMⅡ)共300个(PCOS-CCMⅡ=148个,non-PCOS-CCMⅡ=152个)样品进行分组,所有的实验对象可以分为以下6 组:PCOS-CCMⅡ-1,CCMⅡ-2, CCMⅡ-3, Non-PCOS-CCMⅡ-1, CCMⅡ-2,CCMⅡ-3,每组大约45~55个CC样品并保持统一。
3.RNA的提取及逆转录(RT)反应:RNA的提取按照试剂盒(RNeasy Minikit,Qiagen,德国)的说明进行。将所提取的RNA马上取4μl进行琼脂糖凝胶电泳,符合测定标准后,从每组样品中提取大约140~150ng RNA样品加入到逆转录仪的10μl体系中进行逆转录反应,操作按照PrimeScript RT regent kit(Perfect Real time)(TaKaRa,日本)的说明书进行,温度设置如下:37℃15min,85℃5s,4℃5min。
4.实时荧光定量聚合酶链反应(qRT-PCR):引物序列根据Genebank上所查的序列,由上海生工公司合成。引物序列如下,目的基因:ANGPTL1forward,5’TGGGAGGTAACGAGATTCAGAG 3’,ANGPTL1reverse,5’GCTTCTTTTGCTTGCTGACAGT3’;ANGPTL2forward,5’GGCTCGCCAAG-AGAGAGTTCAT3’,ANGPTL2reverse,5’TTCATGTTGCGGCTCTCCTT3’;内参基因:GAPDH forward,5’TGTTGCCATCAATGACCCCTT 3’,GAPDH reverse,5’CTCCACGACGTACTCAGCG3’。从逆转录过来的每份cDNA样品中吸取2μl进行10μl体系的扩增反应,反应按照LightCycler(Roche Diagnostics,Mannheim,德国)和Rotor Gene 3,000system(Corbett,澳大利亚)说明书进行:95℃预热30s;循环温度如下:95℃持续5s,60℃持续20s,在20℃时选择荧光FAM/SYBER,持续40个循环;溶解曲线温度:65℃持续15s。总体反应持续大约1h,运算分析最终所得CT值。
四、统计学分析
将qRT-PCR 所得的 CT 值按照公式 2-ΔΔCT[14]进行运算,所得的值采用SPSS17.0统计软件进行独立样本t检验,P<0.05具有统计学差异。
结 果
一、CCMII中ANGPTL1mRNA的表达
PCOS和non-PCOS患者的CCMII中均有ANGPTL1mRNA的表达,且PCOS组中的表达量低于non-PCOS 组的表达量,即PCOS 组ANGPTL1mRNA的表达量约是 non-PCOS的(0.83±0.16)倍,ANGPTL1mRNA 在 non-PCOS患者的CCMII的表达是上调的,但无统计学差异(P>0.05)(图1)。

图1 ANGPTL1在PCOS患者的CCMII上表达
二、CCMII中ANGPTL2mRNA的表达
PCOS和non-PCOS患者的CCMII中均有ANGPTL2mRNA的表达,且PCOS组中的表达量高于non-PCOS组的表达量,即 PCOS 组ANGPTL2mRNA的表达量约是 non-PCOS的(1.99±0.23)倍,ANGPTL2mRNA 在PCOS患者的CCMII的表达是上调的,与non-PCOS相比,有统计学差异(P<0.05)(图2)。

图2 ANGPTL2在PCOS患者的CCMII上呈显著性高表达
讨 论
人类的卵泡发育是一个有序的复杂过程。在卵巢组织中,始基卵泡在激素的作用下开始募集生长,最终仅有一个优势卵泡得以排卵,达到成熟状态,完成随后的受精及胚胎发育。在此过程中,卵母细胞分泌的细胞因子参与颗粒细胞的增长和延伸过程。CC中的某些基因的表达调控着卵母细胞的减数分裂及胞核成熟[15],这些基因大多与卵泡内应激反应如缺氧、营养供应不足、细胞凋亡有关[16]。卵丘CC起源于壁层颗粒细胞(granulosa cell,GC)。在哺乳动物中,颗粒细胞与卵丘颗粒细胞,卵丘颗粒细胞与卵丘颗粒细胞,卵母细胞与卵丘颗粒细胞之间存在着广泛的缝隙连接,因此卵母细胞与卵丘颗粒细胞复合物(COCs)之间靠着丰富的缝隙连接进行着丰富的信号交流,从而达到一个内环境的稳态。同时也可以看出卵母细胞与CC之间有着最直接的联系。因此,通过研究CC上基因的表达特点来间接反映卵母细胞的发育特点。选择CC入组研究的另一个原因是比起GC,CC的同源性较高,研究所用的GC经常混有白细胞、淋巴细胞及其他膜层细胞的污染[13]。组织及细胞的同源性对于控制实验对象的一致性是十分重要的。而且其他因素如:卵母细胞均为体内成熟,均用rFSH,且PCOS患者(1,375.0±19.4IU)低于non-PCOS(1,771.9±20.3IU)患者,以防卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)。
PCOS导致的高雄激素血症、高胰岛素血症及许多与血管发生密切相关的细胞因子的改变,严重扰乱了卵巢内环境的稳定。PCOS患者紊乱的卵丘细胞-卵母细胞信号降低了卵母细胞的发育潜能[17]。PCOS严重影响了育龄妇女的生活质量,其肥胖及胰岛素代谢异常的异质性表现,亦是代谢综合征的临床表现,均有可能导致2型糖尿病和冠状动脉血管性疾病。随着分子生物学的发展,人们逐渐从分子层面入手,展开对PCOS的相关基因的研究。如PCOS患者的CC上表达的基因比non-PCOS的差异性校大,具体说来,PCOS患者的CC上异常表达最明显的是许多生长因子类的基因,包括:表皮生长因子类似物,如表皮生长因子受体(EGFR)、表皮调节素(EREG)、双调蛋白(AREG)和胰岛素样生长因子受体1和2(IGF-1R、IGF-2R),它们参与卵母细胞的成熟过程。在PCOS患者的CC上,与类固醇代谢有关的基因下调,同时还发现在PCOS患者中,转录生长因子受体及孕激素受体两条信号途径的异常调节[18]。有研究发现,在Bmp15-1-和Gdf9+/- 双重基因突变小鼠的 CC中,胆固醇合成过程中酶的转录水平下降,严重影响了排卵前CC中的胆固醇代谢及糖酵解过程[19]。
卵泡的发育过程离不开大量血管的发生来提供充足的营养。血管生成素样蛋白(angiopoietinlike proteins,ANGPTLs)与血管的发生密切相关。ANGPTLs包含有7个家族成员,ANGPTL1~7,由7个同名的基因编码而成。ANGPTLs结构上与血管生成素(angiopoietins,ANGPTs)高度同源,具有一个卷曲-卷曲样区域(coiled-coiled district,CCD)和一个受体结合区域(fibrinogen-like district,FLD)[7,20,21]。由于ANGPTLs既 不 与 TIE1结合,也不与TIE2结合,因此被誉为孤立配体,只是结构与功能上和ANGPTs高度同源,所以被称为ANGPTLs或血管生成素相关蛋白(angiopoietin related proteins,ARP)[9]。有研究[22]显示,ANGPTLs的活性不仅仅局限于脉管系统,同时也体现在其他组织中。有研究显示,ANGPTL1、2在小鸡胚胎移植前的子宫中高表达,证明了其参与了细胞外基质的重塑和血管发生过程。先前的关于ANGPTL1、2的研究较多地仅关注于其血管发生作用,如ANGPTL1、2在内皮细胞表面通过未知受体来调节血管发生,具体是促进还是抑制血管生成,主要取决于所处的周围的环境而定[7],并且二者可能是通过PI3-K/Akt信号途径参与斑马鱼的胚胎发生过程[8,9]。目前就ANGPTLs在调节卵泡发育的报道较少见。近年来,关于ANGPTL2在脂质代谢方面的研究逐渐增多。在脂肪组织中,AN-GPTL2能够介导慢性脂肪组织炎症的发生,促进肥胖相关的胰岛素抵抗[23]。然而也有研究恰恰相反,ANGPTL2喂养小鼠的血浆中,血糖、胰岛素、甘油三酯(TG)水平下降,说明了ANGPTL2在2型糖尿病不同时期发挥的不同作用[24]。本研究结果显示,ANGPTL2在PCOS患者的CCs上高表达,其表达量约是non-PCOS患者的1.99倍(P<0.05),提示ANGPTL2可能参与了PCOS致病的发生。虽然实时荧光定量的比值未>2,但差异性是存在的。ANGPTL1在PCOS患者的CCs上低表达,但差异也无统计学意义,提示ANGPTL1的表达可能与PCOS这种疾病状态无关。造成ANGPTL1、2的这种的表达的差异也有可能是本实验中两组患者的特异性差异。但两组体重指数(BMI)比较无统计学意义,所以需要大量的实验来验证ANGPTL1、2与PCOS这种疾病的确切相关性。但是比较明确的一点是,相比ANGPTL1,ANGPTL2与PCOS卵母细胞的发育有着更紧密的相关性,其可能参与了PCOS的致病过程,引起卵巢内及其周围脂质代谢的异常,从而影响卵泡的正常发育。
PCOS的发病机制很复杂,由于其病因不清楚,所以目前仍缺乏理想的治疗方法。本实验通过研究ANGPTL1、2在PCOS患者CC上的表达,探讨ANGPTLs与PCOS的相关性,不仅有助于深入理解PCOS的发病机制,同时也为PCOS的治疗提供新的思路和药物治疗的靶点。
[1]Wei Z,Cao Y,Cong L,et al.Effect of metformin pretreatment on pregnancy outcome of in vitro matured oocytes retrieved from women with polycystic ovary syndrome[J].Fertil Steril,2008,90:1149-1154.
[2]The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group.Revised 2003consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J].Fertil Steril,2004,81:19-25.
[3]Huang X,Hao C,Shen X,et al.Differences in the transcriptional profiles of human cumulus cells isolated from MI and MII oocytes of patients with polycystic ovary syndrome[J].Reproduction,2013,145:597-608.
[4]Cha KY,Chian RC.Maturation in vitro of immature human oocyte for clinical use[J].Hum Reprod Update,1998,4:103-120.
[5]Marteil G,Richard-Parpaillon L,Kubiak JZ,et al.Role of oocyte quality in meiotic maturation and embryonic development[J].Reprod Biol,2009,9:203-224.
[6]Ouandaogo ZG,Frydman N,Hesters L,et al.Differences in transcriptomic profiles of human cumulus cells isolated from oocytes at GV,MI and MII stage after in vivo and in vitro oocyte maturation[J].Hum Reprod,2012,27:2438-2447.
[7]Dhanabal M,LaRochelle WJ,Jeffers M,et al.Angioarrestin:an antiangiogenic protein with tumor-inhibiting properties[J].Cancer Res,2002,62:3834-3841.
[8]Kubota Y,Oike Y,Satoh S,et al.Cooperative interaction of Angiopoietin-like proteins 1and 2in zebrafish vascular development[J].Proc Natl Acad Sci U S A,2005,102:13502-13507.
[9]Kubota Y,Oike Y,Satoh S,et al.Isolation and expression patterns of genes for three angiopoietin-like proteins,Angptl1,2and 6in zebrafish[J].Gene Expr patterns,2005,5:679-685.
[10]Nishiqaki A,Okada H,Tsuzuki T,et al.Angiopoietin 1and angiopoietin 2in follicular fluid of women undergoing a long protocol[J].Fertil Steril,2011,96:1378-1383.
[11]Quandaogo ZG,Haouzi D,Assou S,et al.Human cumulus cells molecular signature in relation to oocyte nuclear maturity stage[OL].PLoS One,2011,6:e27179.
[12]王影,魏兆莲,曹云霞.CHOP/GADD153在多囊卵巢综合征患者卵巢黄体颗粒细胞上的表达[J].生殖与避孕,2012,32:306-310.
[13]Kenigsberg S,Bentov Y,Chalifa-Caspi V,et al.Gene expression microarray profiles of cumulus cells in lean and overweight obese polycystic ovary syndrome patients[J].Mol Hum Reprod,2009,15:89-103.
[14]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25:402-408.
[15]Eppig JJ.Maintenance of meiotic arrest and induction of oocyte maturation in mouse ooctye-granulosa cell complexes developed in vitro from preantral follicles[J].Biol Reprod,1991,45:824-830.
[16]Corn CM,Hauser-Kronberger C,Moser M,et al.Predictive value of cumulus cell apoptosis with regard to blastocyst development of corresponding gametes[J].Fertil Steril,2005,84:627-633.
[17]Dumesic DA,Abbott DH.Implications of polycystic ovary syndrome on oocyte development[J].Semin Reprod Med,2008,26:53-61.
[18]Haouzi D,Assou S,Monzo C,et al.Altered gene expression profile in cumulus cells of mature MII oocytes from patients with polycystic ovary syndrome[J].Hum Reprod,2012,27:3523-3530.
[19]Su YQ,Sugiura K,Wigglesworth K,et al.Oocyte regulation of metabolic cooperativity between mouse cumulus cells and oocytes:BMP15and GDF9control cholesterol biosynthesis in cumulus cells[J].Development,2008,135:111-121.
[20]Kersten S,Mandard S,Tan NS,et al.Characterization of thefasting-induced adipose factor FIAF,a novel peroxisome proliferator-activated receptor target gene[J].J Biol Chem,2000,275:28488-28493.
[21]Koishi R,Ando Y,Ono M,et al.Angptl3regulates lipid metabolism in mice[J].Nat Genet,2002,30:151-157.
[22]Scott CA,van Huyen D,Bany BM,et al.Angiopoietin-like gene expression in the mouse uterus during implantation and in response to steroids[J].Cell Tissue Res,2012,348:199-211.
[23]Lee HJ,Kim JH,Martinus RD,et al.Angiopoietin-like 2,a chronic inflammatory mediator,is a new target induced by TGF-β1through a Smad3-dependent mechanism[J].Biochem Biophys Res Commun,2013,430:981-986.
[24]Kitazawa M,Naqano M,Masumoto KU,et al.Angiopoietinlike 2,a circadian gene,improves type 2diabetes through potentiation of insulin sensitivity in mice adipocytes[J].Endocrinology,2011,152:2558-2567.
