烟草灰霉病复合生防细菌的筛选
2014-11-24周荣金陈永珍黎起秦袁高庆林纬
周荣金,陈永珍,2,黎起秦,袁高庆,林纬
1 广西大学农学院,南宁 530005;
2广东中能酒精有限公司,湛江 524018
植物保护
烟草灰霉病复合生防细菌的筛选
周荣金1,陈永珍1,2,黎起秦1,袁高庆1,林纬1
1 广西大学农学院,南宁 530005;
2广东中能酒精有限公司,湛江 524018
采用平板对峙法和孢子萌发法,测定470株烟草内生细菌对烟草灰霉病菌的抑菌活性,初筛出抑菌作用较强的27株菌株;利用烟叶组织法进行复筛,获得防治效果超过50%的12株菌株,属于芽孢杆菌属或假单胞菌属;测试了7株生防菌之间的亲和性,除菌株Y98外,其他菌株之间均表现亲和;根据菌株亲和性及生防效果,选择5株生防菌株进行混配,测定其对烟草灰霉病的防治效果,发现芽孢杆菌菌株Y11与假单胞菌菌株Y141在其比例为2:1时的防效较好,且高于单菌株处理。
烟草灰霉病;复合生防菌;筛选
由灰葡萄孢(Botrytiscinerea)引起的烟草灰霉病在我国黑龙江、云南、贵州以及陕西烟区已有报道[1]。近年来在湖南、广西及福建烟区具有加重危害的趋势[2-4]。病原菌主要危害烟草叶片及茎部,在烟草整个生育期都可以发生,但以漂浮苗受害最重,一旦发生,易造成烟苗成丛死亡。条件合适时,大田期间继续危害。因此,积极寻找安全有效防治烟草灰霉病的措施具有重要的实践意义。
近年来,人们通过大量试验发现,一些有益微生物以及抑菌植物对灰霉病菌有较强的抑制作用,并在一定情况下表现出较好的防治效果。生物防治日益成为控制灰霉病一条很有发展前景的途径。但是,目前有关生防菌防治植物病害的研究多是针对某个单一菌株进行,在实际生产应用时综合防治效果常有变化,或偏低或不够稳定。一些研究表明,复合生防菌在环境适应性、抗病范围、防效稳定性等方面比单一菌株更有优势,应用复合生防菌能够提高生防菌对植物病害的防治效果[5-6]。本研究对前期已得到的一批烟草内生细菌[7]进行多重筛选,以期获得具有生防开发潜力的有益菌株,在明确生防菌间的亲和性的基础上,构建具有增效作用的生防菌组合,为开发有效防治烟草灰霉病的复合生防菌菌剂提供科学依据。
1 材料与方法
1.1 供试材料
培养基:马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基、牛肉膏蛋白胨(Nutrient Agar,NA)培养基的配制参照方中达[8]的方法。
菌株:470株烟草内生细菌及烟草灰霉病菌均由广西大学农学院植物病理学研究室提供。内生细菌使用前在NA培养基平板上于28℃培养1d,在NA培养液中于28℃120r/m培养48h;烟草灰霉病菌接种到PDA培养基平板上,于16℃恒温条件下培养4d后,一部分制成7mm的菌饼备用,另一部分加入灭菌的蒸馏水洗脱,制成孢子悬浮液备用。
烟草品种及基质:烟草品种为云烟97,由广西壮族自治区烟草公司提供;全价育苗基质(有机质+腐殖酸≥50%)由长春市赛世农业开发有限责任公司生产。
农药:对照药剂25%异菌脲悬浮剂由江苏省徐州润泽化工有限公司生产。
1.2 方法
1.2.1 拮抗菌初筛
采用平板对峙培养法和孢子萌发法初步筛选拮抗菌。平板对峙培养法:将内生细菌在PDA培养基平板的中间划一直线,距离划线两侧20mm处接烟草灰霉病菌菌饼,每处理重复4次,于23℃恒温培养3d后测量培养基平板上的抑菌带宽度。孢子萌发法:将波长600nm下OD值为0.35的细菌菌液与光学显微镜100倍镜下有40~50个灰葡萄孢孢子悬浮液等比例混合,并加入0.1%葡萄糖液以促进孢子萌发。置于25℃恒温保湿培养12h,在光学显微镜下随机观察不同视野下病菌孢子(共200个)的萌发情况,统计其孢子萌发率,按下式计算抑制率。以含有相对浓度的培养液和葡萄糖液混合液作为对照。每处理重复3次。

1.2.2 拮抗菌复筛
采用烟叶组织法对初筛结果进行复筛:采集健康烟草叶片,每张烟草叶片一边喷施烟草内生菌液的5倍稀释液(含0.1%吐温),另一边喷施等量的培养液(含0.1%吐温)作为空白对照,之后接种烟草灰霉病菌菌饼,每处理3张叶片,每张叶片接6块菌饼,20℃恒温保湿培养6d后测量病斑直径,按下式计算防治效果。以225 mg/L的异菌脲作为药剂对照。

1.2.3 生防菌株之间的亲和性测试
根据前期离体抑菌活性与烟叶组织法测定结果,选择目标生防菌株,采用打孔法进行亲和性测定。具体为:在NA培养基平板上均匀的打4个孔洞(直径为7mm),取其中1株目标生防菌株菌液(OD600=1.0)50 µL加入到其中一个孔洞作为挑战菌株,将其他目标生防菌株作为被挑战菌株,分别取其50 µL菌体悬浮液(OD600=1.0)加入到其他的孔洞中,置于28℃恒温培养2d后,观察亲和性反应试验结果。不产生抑菌圈者计为亲和,产生抑菌圈者计为不亲和。依次将所有目标生防菌株分别作为挑战菌株和被挑战菌株进行上述亲和性测试,每处理重复3次。
1.2.4 生防菌单菌株与复合菌株防治效果比较
根据亲和性测试结果,选取有代表性的相互亲和的目标生防菌株,首先按照等量混配比例混配,比较单菌株与复合菌株的防治效果。根据结果选择防效较好的菌株组合按照不同比例进行混配,比较其防治效果。试验方法参照1.2.2。
1.2.5 复合菌株对烟草灰霉病的盆栽防治效果
供试烟草品种为云烟97,有机质育苗45d(4、5叶期),置于温室中(22±5℃)。试验共设5个处理:振荡培养48h的生防菌Y11与Y141按照 2:1比例配置复合生防菌液,Y11菌液,Y141菌液,300mg/L异菌脲作为药剂对照,无菌水为空白对照。其中生防菌液稀释5倍,每株烟草茎基部灌入50mL菌液。每处理15株,3次重复。菌液或药剂处理48h后,在烟草茎基部接种直径7mm的烟草灰霉病菌菌饼,45d后计算死株率和防治效果。
2 结果与分析
2.1 拮抗菌初筛
平板对峙法显示,470株烟草内生细菌中有70株对烟草灰霉病菌的抑菌带宽度大于1.50mm,其中,27株菌株的抑菌带宽度大于5.0 mm,超过7.8 mm的菌株有10株,它们之间的差异未达到显著水平。另有32株菌株虽然没有出现抑菌带,但是可在培养基上快速蔓延生长,并能完全抑制烟草灰霉病菌菌落的扩展,从而表现出营养竞争作用。孢子萌发法中,有72株菌株的孢子萌发抑制率大于50%。其中,有26株生防菌的抑制率超过95%,达到100%的生防菌有13株(见表1和图1)。结合平板对峙法和孢子萌发法结果,从中挑选出拮抗作用较强的27株细菌作下一步试验,根据陈永珍等对这些烟草内生细菌的初步分类[7],其中G1和G110属于肠杆菌属(Enterobacter);G2和J52属于土壤杆菌属(Agrobacterium);G130、J37、J50、J130、Y29、Y39、Y54、Y58、Y68、Y82、Y86、Y88、Y98、Y113、Y141等 15株 属 于假单胞菌属 (Pseudomonas);J29、J30、J80、Y11、Y19、Y38、G59、G81等8株属于芽孢杆菌属(Bacillus)。

表1 部分内生细菌菌株对烟草灰霉病菌的抑菌作用Tab. Inhibition effect of some endophytic bacteria strains on Botrytis cinerea
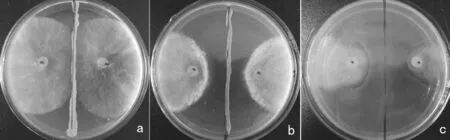
图1 生防菌的离体平板对峙法筛选(a:无拮抗作用和营养竞争作用;b:拮抗作用;c:营养竞争作用)Fig.1 Screening of biocontrol bacteria by flat-stand method (a:no antagonistic effect or nutrition competitive effect; b: antagonistic effect; c: nutrition competitive effect )
2.2 拮抗菌复筛
表2显示,离体平板表现出抑制作用的27株菌株对烟叶上烟草灰霉病病斑的扩展表现出不同程度的抑制作用。防治效果在50%以上有12株,占44.44%,为芽孢杆菌或假单胞菌;防治效果在60%以上有5株,占18.52%,其中 2株为芽孢杆菌,3株为假单胞菌。
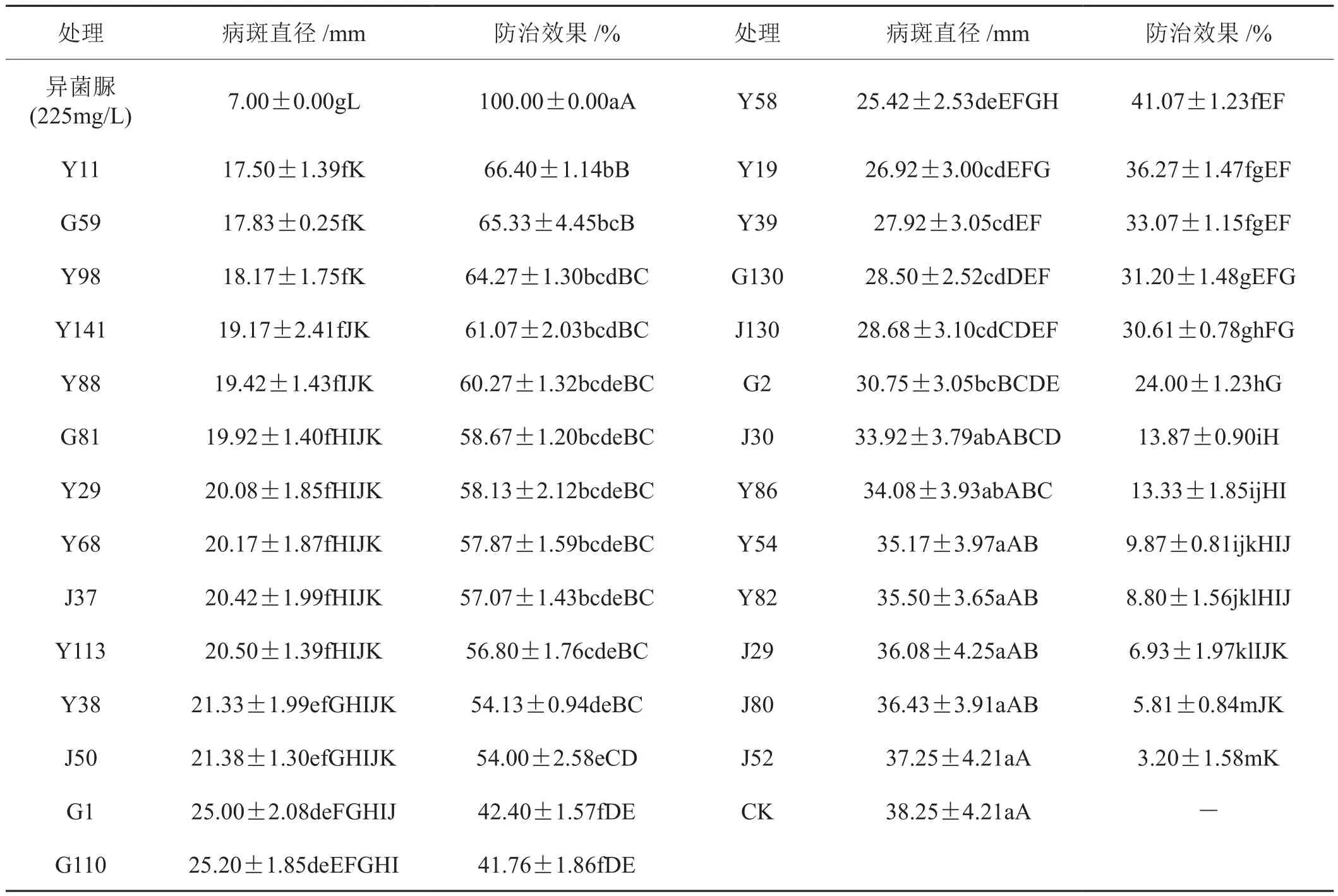
表2 27株拮抗菌株对烟草灰霉病的防治效果Tab.2 Control efficiency of 27 antagonistic strains on tobacco grey mould
2.3 目标生防菌之间的亲和性
选取3株芽孢杆菌(Y11、G59和G81)以及4株假单胞菌属(Y98、Y141、Y88和Y29)进行亲和性反应测试。当菌株Y98作为挑战菌株时,与其余所有的菌株均表现亲和性,而Y98作为被挑战菌株时,仅与Y29和Y141表现亲和性,与G59、G81、Y11和Y88表现为拮抗;其余菌株不管作为挑战菌株还是被挑战菌株,各菌株间均表现为亲和。
2.4 生防菌株组合的筛选结果
根据2.3的试验结果并结合这7株生防菌对烟草灰霉病的抑制作用以及它们的初步分类结果,对3株芽孢杆菌(Y11、G59和G81)和2株假单胞菌(Y141和Y88)进行混配。由表3可看出,Y11+Y88+Y141+G59菌株组合的防治效果显著低于其他处理,仅为42.41%;其次为Y11+Y141+G59菌株组合,防治效果为54.01%,这两组菌株组合的防治效果均低于任何一株单菌株的防治效果。Y11+Y141菌株组合处理的病斑直径为17.8mm,防治效果达到72.02%,比任何单菌株和菌株组合的防治效果高,但与Y11 和G59单菌株处理以及Y11和G59混配处理相比未达到显著水平,而其余菌株组合的防治效果与单菌株的防治效果比较接近或者更低。

表3 单菌株和复合菌株对烟草灰霉病的防治效果Tab.3 Control efficiency of single and complex strains on tobacco grey mould
2.5 复合生防菌株不同混配比例的确定
根据2.4的试验结果,由于Y11和Y141菌株组合中含有芽孢杆菌和假单胞菌这2种不同的生防菌,选择该菌株组合测定其不同混配比例对烟草灰霉病的防治效果。表4和图2显示,Y11与Y141组合中比例为2:1的防治效果达到75.68%,高于其他任何混配比例和单菌株处理的防治效果,但与同等比例混配的处理结果没有显著差异。
2.6 复合生防菌株对烟草灰霉病的盆栽防治效果
复合生防菌对烟草灰霉病的盆栽防治作用如表5和图3所示。药剂对照异菌脲处理的防治效果最好,极显著高于生防菌液处理;Y11与Y141按照2:1混配的防治效果为65.81%,高于单一菌株Y11或Y141处理,但与Y11处理相比,尚未达到显著水平。
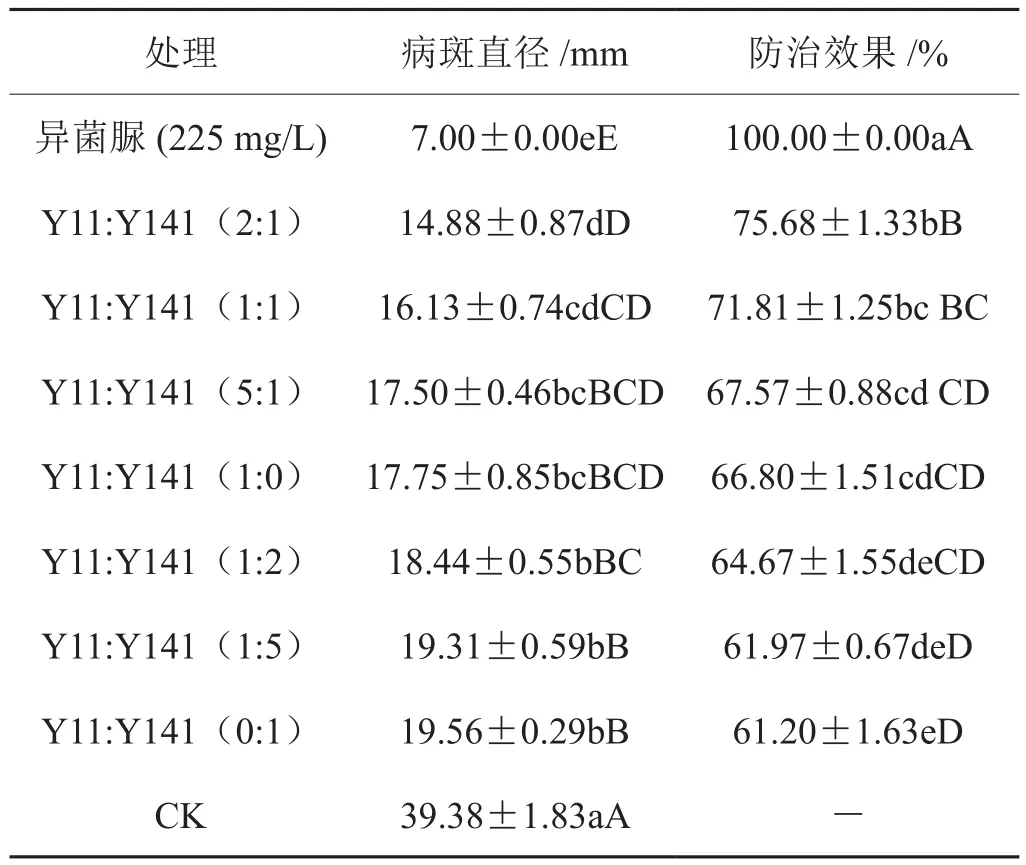
表4 复合生防菌株不同混配比例对烟草灰霉病的防治效果Tab.4 Control efficiency of complex biocontrol strains in different ratios on tobacco grey mould

图2 烟叶组织法测定拮抗菌单菌株和复合菌株对烟草灰霉病的防治效果Fig.2 Control efficiency of single and complex antagonistic strains on tobacco grey mould by tobacco leaves tissues method

表5 复合生防菌株对烟草灰霉病的盆栽防治效果Tab.5 Control efficiency of complex biocontrol strains on grey mould of potted tobacco

图3 拮抗菌复合菌株对烟草灰霉病的盆栽防治效果(接种10 d)Fig.3 Control efficiency of complex antagonistic strains on grey mould of potted tobacco (inoculation 10 d)
3 讨论
平板对峙法和孢子萌发法结果中,许多菌株在抑制病原菌菌丝生长和孢子萌发上有很大不同,如菌株Y62和Y141,对病原菌菌丝生长的抑制能力明显大于菌株J37和Y88,而对病菌孢子萌发的抑制作用却远小于菌株J37和Y88;另外,27株生防菌株的活体复筛结果显示,生防菌抑制烟草灰霉病病斑扩展的能力与离体平板抑制菌丝生长和孢子萌发的结果不完全一致。其原因可能和菌株产生具有拮抗作用的代谢物质有关。拮抗物质作为生防菌的防病的机制之一,不同种类的拮抗菌或同种拮抗菌的不同株系产生的拮抗物质都有可能不同[9-11],还有些生防菌可能诱导植株产生抗病性。诱导抗病性的产生使得某些生防菌株在培养基平板上抑菌能力弱而活体防治效果好,因此生防效果不一定完全依赖于拮抗物质[12-13]。鉴于生防菌株常常存在多种防病机制,在进行植物病害生防菌的筛选时,单纯依靠一种方法来筛选某一种植物病害的生防菌是不够全面的。采用多种筛选方法相结合,有利于筛选出不同抗病机制的生防菌[14],从而获得较强的、较稳定的拮抗菌株。目前在植物病害生物防治中,已经获得很多种具有不同抗病机制的优良生防菌株,将这些生防菌株进行不同的混配组合,从构建复合菌株的角度来看,探索这些具有不同防病机制的生防菌株的复合,将显著提高生防菌的防治效果,拓宽生防菌的应用范围,为生防菌及其制剂的发展提供了新思路。
本文前期研究结果发现,土壤杆菌属和肠杆菌属为烟草内生细菌中的优势种群,但本研究综合多种方法筛选出的具有应用潜力的烟草内生细菌均为芽孢杆菌或假单胞菌,这种植株内生细菌的优势种群和生防菌优势种群的不一致可能会影响到生防菌对病害的防治效果,此领域尚需深入探讨。
4 结语
在470株烟草内生细菌中,有2株芽孢杆菌和3株假单胞菌对烟草灰霉病菌的离体和活体抑菌活性均较强;将芽孢杆菌菌株Y11和假单胞菌菌株Y141按照2:1体积比混配,对烟草灰霉病的防治效果较好,且高于单菌株处理,说明在防治烟草灰霉病方面,Y11和Y141复合生防菌有较大的开发潜力,但对其具体分类地位、作用机理和应用方法等仍需要进一步研究。
[1]单宏英.香菇多糖对烟草灰霉病的防治效果研究[J].中国烟草学报,2012,18(4): 56-61.
[2]陈志敏,过赋文,张晓阳.烟草茎腐病的病原鉴定及生物学特性[J].烟草科技,2011,(4): 78-80,84.
[3]卢燕回,谭海文,袁高庆,等.烟草灰霉病病原鉴定及其生物学特性[J].植物保护,2012,18(3): 61-66.
[4]邓真,顾钢,张绍升.福建省烟草灰霉病的发生与病原鉴定[J].亚热带农业研究,2012,8(3): 164-168.
[5] Akgül D S,Mirik M.Biocontrol ofPhytophthoracapsicion pepper plants byBacillusmegateriumstrains[J].Journal of Plant Pathology,2008,90(1): 29-34.
[6] Maketon M,Apisitsantikul J,Siriraweekul C.Greenhouse evaluation ofBacillussubtilisAP-01 andTrichoderma harzianumAP-001 in controlling tobacco diseases[J].Brazilian Journal of Microbiology,2008,39(2): 296-300.
[7]陈永珍,杨义,卢燕回,等.广西烟草内生细菌的动态分布及其对烟草疫霉的拮抗作用[J].中国烟草学报,2012,18(4): 51-55.
[8]方中达.植病研究方法(第三版)[M].北京: 农业出版社,1998:1-356.
[9]刘 静,王 军,姚健铭,等.枯草芽孢杆菌JA抗菌物特性的研究及抗菌肽的分离纯化[J].微生物学报,2004,44(4):511-514.
[10]Zhang Z,Yuen G Y,Sarath G,et al.Chitinases from the plant disease biocontrol agent,Stenotrophomonas maltophiliaC3[J].Phytopathology,2001,91(2): 204-211.
[11]李永刚,郭晓慧.枯草芽孢杆菌BS2对葡萄灰霉病菌的抑菌机制的初步探索[J].微生物学通报,2010,37(5):721-725.
[12]Duffy B,Schouten A,Raaijmakers J M.Pathogen selfdefense: mechanisms to counteract microbial antagonism[J].Annual review of phytopathology,2003,41(1): 501-538.
[13]Droby S,Vinokur V,Weiss B,et al.Induction of resistance toPenicilliumdigitatumin grapefruit by the yeast biocontrol agent Candida oleophila[J].Phytopathology,2002,92(4): 393-399.
[14]De Costa D M,Zahra A R F,Kalpage E M G,et al.Effectiveness and molecular characterization ofBurkholderiaspinosa,a prospective biocontrol agent for controlling postharvest diseases of banana[J].Biological Control,2008,47: 257-267.
Screening of bacteria strain complex against tobacco grey mould
ZHOU Rongjin1,CHEN Yongzhen1,2,LI Qiqin1,YUAN Gaoqing1,LIN Wei1
1 College of Agriculture,Guangxi University,Nanning 530005,China;
2 Guangdong Zhongneng Alcohol CO.LTD,Zhanjiang 524018,China
Antibacterial activities of 470 endophytic bacteria strains in tobacco againstBotrytis cinereawere determined by flat-stand and spore germination methods.27 strains with strong inhibition effects were selected.Another 12 strains with control efficiency over 50%were further screened with tobacco leaf tissue method,and these strains were classified asBacillusorPseudomonas.Results of compatible reactions of 7 strains showed that most of strains displayed compatibility except Y98.According to compatible reactions and biocontrol efficiency results,5 strains were mixed together to study control effect on tobacco grey mould.It was shown that the control efficiency of mixedBacillusstrainY11 andPseudomonasstrain Y141in the ratio of 2:1 was higher than that of single strain treatment.
tobacco grey mould; biocontrol bacteria complex; screening
10.3969/j.issn.1004-5708.2014.06.017
S476 文献标志码:A 文章编号:1004-5708(2014)06-0107-06
广西大学科研基金项目(XBZ120839)
周荣金(1986—),硕士研究生,主要研究方向为植物细菌性病害及其防治,Email:1120325529@qq.com
袁高庆(1971—),博士,副教授,主要研究方向为植物土传病害及其生物防治,Email:ygqtdc@sina.com
2013-12-01
