毛竹林生态系统植硅体的分布及其影响因素
2014-11-24李蓓蕾宋照亮姜培坤周国模李自民
李蓓蕾,宋照亮,2,3,姜培坤,2,周国模,2,李自民,4
(1.浙江农林大学 环境与资源学院,浙江 临安 311300;2.浙江农林大学 浙江省森林生态系统碳循环与固碳减排重点实验室,浙江 临安311300;3.中国科学院 地球化学研究所 环境地球化学国家重点实验室,贵州 贵阳 550002;4.中国农业科学院 茶叶研究所/农业部茶树生物学与资源利用重点实验室,浙江 杭州310008)
植硅体,又称 “植硅石”[1],存在于很多植物细胞中,禾本科Poaceae植物细胞中其含量特丰富[2]。植硅体是高等植物在生长过程中沉淀在细胞壁、细胞腔内以及细胞间隙中的非晶质二氧化硅矿物颗粒[3]。植硅体结构复杂,其主要成分是二氧化硅(670~950 g°kg-1),水(10~120 g°kg-1),碳(1~60 g°kg-1)以及一些微量元素钠、钾、钙、铁、铝、钛等[4]。植物死亡或凋落以后,大量的植硅体被释放到土壤中并很好的保存起来[5],对全球碳汇起到重要作用[2]。竹子作为典型的硅超富集禾本科植物[6-7],在全球范围内的覆盖面积约为22×106hm2[8]。中国是世界上竹子分布最广的国家之一,现存的竹林面积约有5×106hm2[9],其中约有2/3是毛竹Phyllostachys edulis[10]。毛竹是中国经营历史悠久的竹种[11],具有巨大的生物量,它的生态学功能在陆地硅和碳循环中起到重要的作用[12]。在植物的生长过程中,受蒸腾作用控制,硅元素主要以植硅体的形式富集在竹子等植物的叶片中[2,13-14]。植硅体主要通过竹叶凋落物归还于土壤中[2]。本研究选取浙江省不同地区的毛竹作为研究对象,通过对不同岩性土壤上发育的同一竹龄毛竹竹叶和同一岩性土壤上发育的不同竹龄的毛竹竹叶中植硅体含量的分布特征进行分析,来阐明毛竹中植硅体的分布规律,为了解毛竹林植硅体碳汇调控以及植硅体在竹林生态系统硅和碳在生物地球化学循环中的作用提供科学参考。
1 材料与方法
本研究所选取的毛竹竹叶样品的采集点分别位于浙江省临安市青山(30°13′N,119°46′E),安吉县山川乡船坝(30°27′N,119°41′E),绍兴市新昌县巧英(29°23′N,121°11′E)和绍兴市新昌县大市聚(29°28′N,120°59′E)。所处地区岩性分别为页岩、花岗闪长岩、花岗岩和玄武岩。不同地区毛竹林均已去除林下灌木、杂草。样品采集时间为5月竹叶成熟期。页岩地区选取1年生、3年生和5年生的毛竹,分为上(距离毛竹冠顶0~1 m),中(距离毛竹冠顶2~3 m)和下(距离毛竹冠顶3~4 m)等3个部位,分别采集竹叶150 g左右,编号装袋;按照同样的方法,在花岗闪长岩、花岗岩和玄武岩地区分别采集5年生毛竹3个部位的竹叶(其中1年生的竹子实际为1年2个月生的竹子)。同时,采集各点附近0~20 cm的土壤500 g左右,编号装袋。将采集回来的竹叶样品用自来水反复冲洗,再用去离子水冲洗干净,放置鼓风烘箱中105℃杀青后,75℃左右烘干至恒量。将每袋植物样品充分混合,分成2份,一份用剪刀将样品其剪至0.5 cm左右供植硅体提取分析,另一份用植物粉碎机粉碎,供总硅测试分析。将采集回来的土壤样品自然风干,挑根,研磨并过筛后供土壤pH、有机碳和有效硅的分析测试。
植物样品中总硅的测定采用偏硼酸锂熔融-分光光度法[15],并利用植物灌木枝叶标样CBW07602进行监测。竹叶样品中植硅体采用改进的微波消解法提取[16],同时运用Walkley-Black方法检验并除去植硅体外缘可能存在的有机碳[17]。将已提取的植硅体放入鼓风烘箱中70℃烘干,然后对植硅体进行称量和记录,计算样品中植硅体质量分数。土壤pH值、有机碳和有效硅质量分数等测定参照文献[15]方法。
本研究的结果数据为3次重复的平均值,运用Duncan新复极差法进行多重比较分析。数据的统计分析均在Microsoft,Excel和SPSS等软件上进行。
2 结果与分析
2.1 毛竹土壤的基本理化参数
表1给出了不同岩性上发育的同一竹龄毛竹土壤的基本理化参数。不同岩性下毛竹土壤pH值差异显著,变化范围为pH 4.33~5.15,呈现为酸性。4种不同岩性下的土壤中有机碳的质量分数差异显著,花岗岩和花岗闪长岩上发育的土壤中有机碳分别为32.9和29.3 g°kg-1,要远高于页岩和玄武岩。玄武岩上发育的土壤中有效硅的含量为237.5 mg°kg-1,显著高于其他3种岩性(表1)。

表1 不同岩性类型毛竹土壤的基本理化参数Table 1 Basic physicochemical parameters of soil from different lithologies
2.2 不同竹龄以及不同岩性下毛竹中二氧化硅和植硅体的平均质量分数
同一岩性(页岩)下不同竹龄的毛竹竹叶中二氧化硅平均质量分数变化范围是51.8~62.6 g°kg-1,植硅体平均质量分数为50.8~57.6 g°kg-1,差异不显著(表2)。不同岩性下同一竹龄的毛竹竹叶中二氧化碳以及植硅体平均质量分数变化见表3。由表3可知:不同岩性下所发育的毛竹竹叶中二氧化硅质量分数以及植硅体质量分数的变化显著,变化范围分别为 56.1~103.7 g°kg-1,50.8~99.1 g°kg-1。

表2 页岩土壤上不同竹龄毛竹竹叶中二氧化硅及植硅体平均质量分数Table 2 Effects of plant age based on the same lithology on the average contents of SiO2and phytolith in moso bamboo leaves
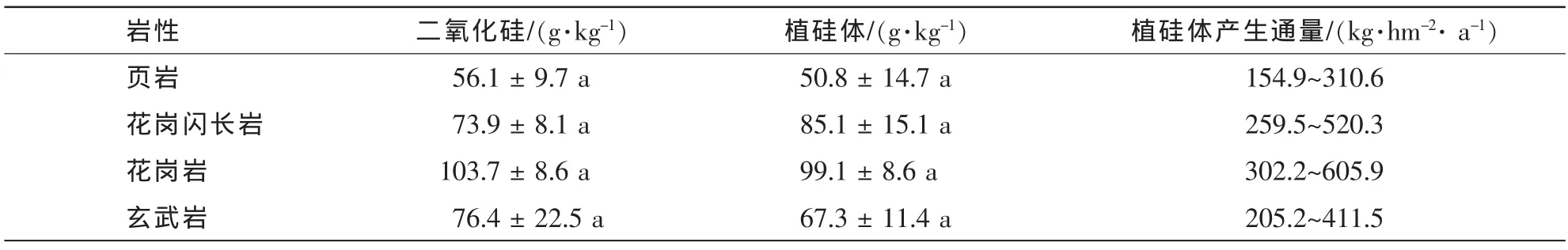
表3 不同岩性土壤上5年生毛竹竹叶中二氧化硅及植硅体平均质量分数Table3 Effectsoflithologywiththesameplantageontheaverage contents of SiO2and phytolith in moso bamboo leaves
2.3 不同竹龄和不同部位毛竹竹叶中植硅体质量分数
如图1中所示:通过对青山地区不同竹龄同一部位竹叶中植硅体质量分数对比,不同竹龄的上部和中部叶子中植硅体没有明显差异,但是和下部叶子中植硅体质量分数差异明显。青山湖地区同一竹龄竹叶中植硅体的质量分数基本上是由下部到上部递增的,除了青山3年生毛竹中不同部位的叶子中植硅体没有显著性差异,青山1年生毛竹和青山5年生毛竹中具有显著差异。
2.4 不同岩性和不同部位毛竹竹叶中植硅体质量分数
不同岩性对其上发育的毛竹中植硅体质量分数的影响是比较大的,如图2所示。不同岩性上毛竹的同一部位竹叶的对比,植硅体质量分数的变化都是比较大的,并且都有显著差异。花岗岩以及玄武岩上发育的毛竹,其不同部位竹叶中植硅体的质量分数差异不大;在页岩和花岗闪长岩上发育的毛竹中上部、中部和下部叶子中植硅体质量分数变化比较大,差异显著。
3 讨论
3.1 毛竹竹叶中植硅体质量分数及其影响因素
毛竹竹叶中植硅体质量分数变化范围为50.8~99.1 g°kg-1,同一岩性土壤上发育的不同竹龄的毛竹竹叶中二氧化硅和植硅体的平均质量分数的不显著变化可能是与竹叶平均2 a为周期的更新有关。此外,毛竹林的凋落量还受大、小年(大年是指出笋多的年份,小年是指出笋少的年份)的影响。一般来讲,小年毛竹林的凋落量要大于大年,凋落量的变化也可能影响竹叶中二氧化硅和植硅体的质量分数[18]。不同岩性条件下发育的毛竹林竹叶中二氧化硅以及植硅体的质量分数差异都比较大,这与母岩及其形成土壤的理化性质有关。不同母岩发育的土壤的pH值、有机碳和有效硅的质量分数差异比较大,从而影响其上发育的毛竹林对土壤溶液中硅的吸收以及竹叶中植硅体的产生。如相对于玄武岩和页岩地区的土壤,以花岗岩和花岗闪长岩为母岩的土壤中有效硅的质量分数虽然不高,但是在这2种岩性土壤上发育的毛竹竹叶中植硅体的质量分数较高,这可能与这2种土壤的pH值较低、土壤中有机碳的质量分数相对较高,土壤较疏松,能够促进植物对硅的吸收,有利于植物中植硅体的积累有关[13,19]。然而到底是哪种原因占主要地位,或是几种原因同时作用,亦或是还有其他的可能原因的影响,都还需要更进一步的调查研究。
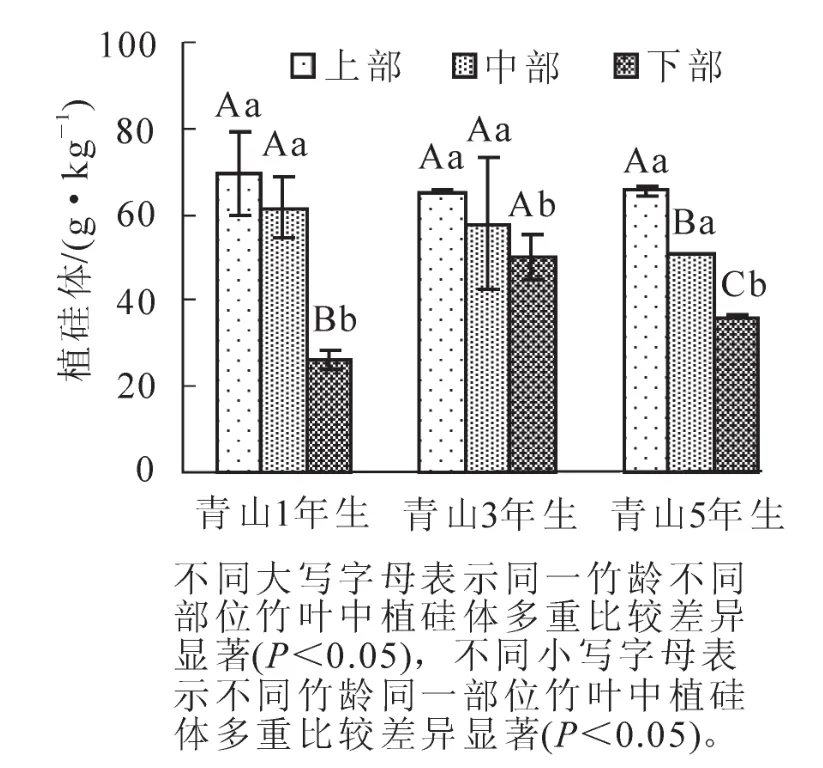
图1 页岩土壤上不同竹龄和不同部位毛竹叶中植硅体的质量分数Figure 1 Contents of phytolith in different parts of the leaves within Moso bamboo among different ages

图2 不同岩性和不同部位5年生毛竹叶中植硅体的质量分数Figure 2 Contents of phytolith in different parts of the leaves within Moso bamboo among different lithologies
植硅体质量分数与二氧化硅质量分数间极显著的相关性(R2=0.852 1,P<0.01,图3)说明:植硅体与硅的吸收与积累量密切相关。毛竹竹叶中植硅体质量分数基本呈现从上部到下部递减的趋势且差异性显著(图1,图2),主要与不同部位对硅吸收与积累不同有关。竹子对硅的吸收主要受蒸腾作用控制,上部的蒸腾作用要强于中部和下部,从而积累更多的硅[13,20]。
3.2 毛竹竹叶中植硅体产生通量及其影响因素
据报道,毛竹竹叶初级净生产力约为3 049~6 114 kg°hm-2°a-1[21]。据此,我们估算毛竹中植硅体产生的平均通量为209.5~420.2 kg°hm-2°a-1。不同岩性上毛竹竹叶植硅体产生通量从大到小的顺序依次为: 花岗岩(605.9 kg°hm-2°a-1)>花岗闪长岩(520.3 kg°hm-2°a-1)>玄武岩(411.5 kg°hm-2°a-1)>页岩(310.6 kg°hm-2°a-1)。相对于玄武岩和页岩地区的毛竹林,花岗岩和花岗闪长岩上发育的毛竹中植硅体的产生通量相对较高,这主要与花岗岩和花岗闪长岩上发育的毛竹叶片中植硅体含量较高有关。
除了不同母质发育的土壤可通过改变植硅体质量分数对植硅体产生通量具有影响外,竹叶初级净生产力的变化也是不可忽略的因素。毛竹林的叶凋落全年都会发生,但其数量随着季节和竹子自身的生长特点而变化[21]。此外,经营模式的不同也会对竹叶初级净生产力产生一定的影响。一般来讲,粗放经营要大于集约经营[21]。
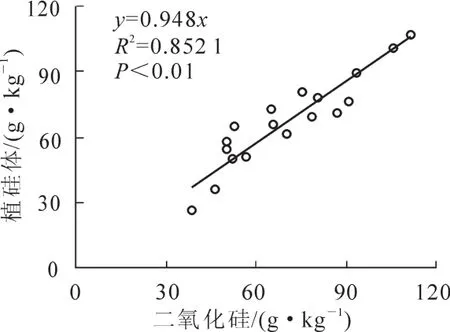
图3 植硅体质量分数与二氧化硅质量分数的相关性Figure 3 Correlation of phytolith content and SiO2content
3.3 对中国毛竹林植硅体碳汇调控的启示
竹子(主要是毛竹)主要分布在热带和亚热带地区,约占世界森林总面积的1.5%~2.0%。中国现存的竹林面积约为5.0×106hm2[9],毛竹面积约为3.3×106hm2[10],集中分布在浙江、江西和湖南等中亚热带红壤地区[22-23]。若按植硅体产生通量为 209.5~420.2 kg°hm-2°a-1计算,那么全国毛竹林的植硅体产生量约为 0.7~1.4 Tg°a-1(1 Tg=1012g)。在植硅体形成的过程中,植硅体内可以包裹 1%~6%的有机碳[2,24-25],称为植硅体碳,其在全球碳循环和气候变化中发挥着重要的作用[26-27]。若以植硅体中植硅体碳含量(3±1)%[14]和植硅体平均产生通量计算,那么中国毛竹每年通过植硅体大约可以固定(76.1~152.5)×106kg二氧化碳。竹子具有生长快、繁殖快、易再生等优点[28]。如果未来二三十年竹子面积继续按目前每年2%~3%的速率增长[8],那么,到2050年竹子的面积将增加1倍以上[29]。若以毛竹植硅体产生平均通量计算,全国毛竹林植硅体及其包裹有机碳的含量都将增加1倍以上。
相对于玄武岩和页岩等其他岩性上发育的毛竹林,花岗岩和花岗闪长岩上毛竹植硅体产生通量较高(约为前者的1.5倍),植硅体在土壤中的稳定性相对较高(因土壤具有较低pH值)[13],碳汇潜力较大。今后开展竹林造林—再造林时,可以尽量选择花岗岩和花岗闪长岩等地区。此外,施用硅肥[30-34]或高供硅能力的岩粉,来提高毛竹竹叶中植硅体的产生通量都可以增加毛竹林植硅体产生量,从而提高植硅体内所包裹的有机碳含量,固定更多大气中的二氧化碳,对增加全球碳汇起到重要作用。
4 结论
不同岩性上发育的毛竹竹叶中植硅体质量分数为花岗岩(99.1 g°kg-1)>花岗闪长岩(85.1 g°kg-1)>玄武岩(67.3 g°kg-1)>页岩(56.1 g°kg-1)。不同的岩性对其上发育的毛竹中植硅体的产生通量影响比较大,花岗岩(606.0 kg°hm-2°a-1)>花岗闪长岩(520.4 kg°hm-2°a-1)>玄武岩(411.6 kg°hm-2°a-1) >页岩(310.6 kg°hm-2°a-1)。
按毛竹林面积的3.3×106hm2和植硅体产生通量为209.5~420.2 kg°hm-2°a-1计算,全国毛竹林通过竹叶凋落物形式产生的植硅体量为0.7~1.4 Tg°a-1。若以植硅体中含碳量(3±1)%计算,那么全国毛竹大约可以固定二氧化碳(76.1~152.5)×106kg°a-1。
选择花岗岩和花岗闪长岩等毛竹植硅体产生通量高的岩性上开展竹林造林—再造林,或施用硅肥或高供硅能力的岩粉,或增加竹林的面积可显著提高毛竹竹叶中植硅体及其包裹碳的产生通量,增强植硅体碳汇能力。
[1]吕厚远,贾继伟,王伟铭,等.“植硅体”含义和禾本科植硅体的分类[J].微体古生物学报,2002,19(4):389-396.LÜ Houyuan,JIA Jiwei,WANG Weiming,et al.On the meaning of phytolith and its classification in gramineac[J].Acta Micropalaeontol Sin,2002,19(4): 389-396.
[2]PARR J,SULLIVAN L,CHEN Bihua,et al.Carbon bio-sequestration within the phytoliths of economic bamboo species [J].Global Change Biol,2010,16(10): 2661-2667.
[3]PIPERNO D R.Phytolith Analysis: An Archaeological and Geological Perspective [M].San Diego: Academic Press,1988.
[4]吕后东,李荣华,徐庆梅.植物硅酸体分析与中草药鉴定[J].时珍国药研究,1998,8(5):28-30.LÜ Houdong,LI Ronghua,XU Qingmei.Analysis of opal phytoliths and identification of Chinese herbal medicine[J].Shizhen J Tradit Chin Med Res,1998,8(5): 28-30.
[5]ALEXANDRE A,MEUNIER J D,COLIN F,et al.Plant impact on the biogeochemical cycle of silicon and related weathering processes [J].Geochim Cosmochim Acta,1997,61(3): 677-682.
[6]LI Zhenji,LIN Peng,HE Jianyuan,et al.Silicon’s organic pool and biological cycle in moso bamboo community of Wuyishan Biosphere Reserve [J].J Zhejiang Univ Sci B,2006,7(11): 849-857.
[7]黄张婷,姜培坤,宋照亮,等.不同竹龄雷竹中硅及其他营养元素吸收和积累特征[J].应用生态学报,2013,24(5): 1347-1353.HUANG Zhangting,JIANG Peikun,SONG Zhaoliang,et al.Uptake and accumulation characteristics of silicon and other nutritional elements in different age Phyllostachys praecox plants [J].Chin J Appl Ecol,2013,24(5):1347-1353.
[8]郭起荣,杨光耀,杜天真,等.中国竹林的碳素特征[J].世界竹藤通讯,2005,3(3):25-28.GUO Qirong,YANG Guangyao,DU Tianzhen,et al.Carbon character of Chinese bamboo forest[J].World Bamboo Rattan,2005,3(3): 25-28.
[9]GUI Renyi,LENG Huanan,ZHUANG Shunyao,et al.Aluminum tolerance in moso bamboo (Phyllostachys pubescens) [J].Bot Rev,2011,77(3): 214-222.
[10]JIANG Peikun,MENG Cifu,ZHOU Guomo,et al.Comparative study of carbon storage in different forest stands in subtropical China [J].Bot Rev,2011,77(3): 242-251.
[11]应叶青,郭璟,魏建芬,等.水分胁迫下毛竹幼苗光合及叶绿素荧光特性的响应[J].北京林业大学学报,2009,31(6): 128-133.YING Yeqing,GUO Jing,WEI Jianfen,et al.Photosynthetic and chlorophyll fluorescent responses of Phyllostachys pubescens seeding to water deficiency stress [J].J Beijing For Univ,2009,31(6): 128-133.
[12]DU Huaqiang,ZHOU Guomo,FAN Wenyi,et al.Spatial heterogeneity and carbon contribution of aboveground biomass of moso bamboo by using geostatistical theory [J].Plant Ecol,2010,207(1): 131-139.
[13]SONG Zhaoliang,WANG Hailong,STRONG P J,et al.Plant impact on the coupled terrestrial biogeochemical cycles of silicon and carbon: implications for biogeochemical carbon sequestration [J].Earth-Sci Rev,2012,115(4): 319-331.
[14]SONG Zhaoliang,LIU Hongyan,LI Beilei,et al.The production of phytolith-occluded carbon in China’s forests:implications to biogeochemical carbon sequestration [J].Global Change Biol,2013,19(9): 2907-2915.
[15]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:12-202.
[16]PARR J F,DOLIC V,LANCASTER G,et al.A microwave digestion method for the extraction of phytoliths from herbarium specimens [J].Rev Palaeobot Palynol,2001,116(3/4): 203-212.
[17]WALKLEY A,BLACK I A.An examination of the degtjareff method for determining soil organic matter,and a proposed modification of the chromic acid titration method [J].Soil Sci,1934,37(1): 29-38.
[18]陈灵芝,黄建辉,严昌荣.中国森林生态系统养分循环[M].北京:气象出版社,1997:3-10..
[19]李建武.海南岛玄武岩发育土壤的痕量元素和Sr-Nd同位素特征与大气物源贡献[D].南京:中国科学院南京土壤研究所,2012.LI Jianwu.Trace Elemental and Sr-Nd Isotopic Characteristics in Relation to Dust Accretion of Basalt-derived Soils in Hainan Island [D].Nanjing: Chinese Academy of Sciences.Institure of Soil Science,2012.
[20]DING Tiping,ZHOU Jianxiong,WAN Defang,et al.Silicon isotope fractionation in bamboo and its significance to the biogeochemical cycle of silicon [J].Geochim Cosmochim Acta,2008,72(5): 1381-1395.
[21]周国模,吴家森,姜培坤.不同管理模式对毛竹林碳储量的影响[J].北京林业大学学报,2006,28(6):51-55.ZHOU Guomo,WU Jiasen,JIANG Peikun.The impacts of different management modes on the carbon storage within moso bamboo [J].J Beijing For Univ,2006,28(6): 51-55.
[22]周国模,姜培坤,徐秋芳.竹林生态系统中碳的固定与转化[M].北京:科学出版社,2010:1-5.
[23]汪庆华,唐根年,李睿.浙江省特色农产品立地地质背景研究[M].北京:地质出版社,2007:10-180.
[24]PARR J F,SULLIVAN L A,QUIRK R.Sugarcane phytoliths: encapsulation and sequestration of a long-lived carbon fraction [J].Sugar Technol,2009,11(1): 17-21.
[25]PARR J F,SULLIVAN L A.Phytolith occluded carbon and silica variability in wheat cultivars [J].Plant Soil,2011,342(1-2): 165-171.
[26]孟赐福,姜培坤,徐秋芳,等.植物生态系统中的植硅体闭蓄有机碳及其在全球土壤碳汇中的重要作用[J].浙江农林大学学报,2013,30(6):921-929.MENG Cifu,JIANG Pengkun,XU Qiufang,et al.PhytOC in plant ecologica system and its important roles in the global soil carbon sink [J].J Zhejiang A & F Univ,2013,30(6): 921-929.
[27]李自民,宋照亮,李蓓蕾,等.杭州西溪湿地植物植硅体产生及其影响因素[J].浙江农林大学学报,2013,30(4): 470-476.LI Zimin,SONG Zhaoliang,LI Beilei,et al.Phytolith production in wetland plants of the Hangzhou Xixi Wetlands ecosystem [J].J Zhejiang A & F Univ,2013,30(4): 470-476.
[28]XU Yong,WONG Minghung,YANG Jianli,et al.Dynamics of carbon accumulation during the fast growth period of bamboo plant[J].Bot Rev,2011,77(3): 287-295.
[29]CHEN Xiangang,ZHANG Xiaoquan,ZHANG Yiping,et al.Changes of carbon stocks in bamboo stands in China during 100 years [J].For Ecol Manage,2009,258(7): 1489-1496.
[30]MATICHENKOV V,CALVERT D,SNYDER G.Silicon fertilizers for Citrus in Florida [J].Proc Fla State Hort Soc,1999,112: 5-8.
[31]ALVAREZ J,DATNOFF L E.The economic potential of silicon for integrated management and sustainable rice production [J].Crop Prot,2001,20(1): 43-48.
[32]MA Jianfeng,TAKAHASHI E.Soil,Fertilizer,and Plant Silicon Research in Japan [M].Amsterdam: Elsevier 2002:9-26.
[33]LIANG Yongchao,HUA Haixia,ZHU Yongguan,et al.Importance of plant species and external silicon concentration to active silicon uptake and transport[J].New Phytol,2006,172(1): 63-72.
[34]MECFEL J,HINKE S,GOEDEL W A,et al.Effect of silicon fertilizers on silicon accumulation in wheat [J].J Plant Nutr Soil Sci,2007,170(6): 769-772.
