真菌性尿路感染的病原菌分布与药物敏感性特点分析*
2014-11-21孙伟苏建荣首都医科大学附属北京友谊医院临检中心北京100050
孙伟,苏建荣(首都医科大学附属北京友谊医院临检中心,北京 100050)
近年来随着抗肿瘤药物、免疫抑制剂及广谱抗生素的广泛应用,介入治疗及器官移植的大量开展,加之导尿管在体内留置时间过长等原因,真菌性尿路感染的发病率呈日益上升趋势[1-3]。本文通过对本院分离收集的真菌性尿路感染病原菌菌株进行菌种分布与药敏特点分析,为治疗真菌性尿路感染提供实验室依据。
1 材料与方法
1.1 菌株来源收集2013年1月至2014年5月本院各临床科室送检的清洁中段尿培养或清洁中段尿真菌培养标本中分离得到的507株非重复真菌。药敏试验质控菌株为克柔念珠菌ATCC6258。
1.2 仪器与试剂沙保弱培养基、哥伦比亚血平板及科玛嘉显色培养基均购自英国OXOID 公司;ATB-FUNGUS 3药敏试剂购自法国生物梅里埃公司;Vitek 2Compact全自动微生物鉴定仪和YST 卡购自法国生物梅里埃公司。
1.3 方法无菌操作,定量接种10μL 清洁中段尿标本至沙保弱培养基或哥伦比亚血平板,35℃培养24h。挑取镜检为真菌的纯菌落接种于科玛嘉显色培养基进行菌种鉴定,显色培养基无法鉴定或鉴定不理想的菌种,采用YST 卡通过Vitek 2 Compact进行鉴定。同时采用ATB-FUNGUS 3试剂进行药敏试验。
1.4 药敏结果判读标准两性霉素B、5-氟胞嘧啶、氟康唑、伊曲康唑、伏立康唑均采用CLSI M27-S3标准[4]。
1.5 统计学处理采用SPSS 13.0统计学软件进行数据分析;计数资料以百分率表示。
2 结果
2.1 真菌性尿路感染病原菌分布特点清洁中段尿标本培养后分离所得507株真菌均为念珠菌,其中白色念珠菌267株(52.7%),光滑念珠菌150株(29.6%),热带念珠菌55株(10.8%),其他念珠菌35株(6.9%)。
2.2 真菌性尿路感染的易感因素通过对所收集菌株的临床病例进行分析,归纳真菌尿路感染产生可能的易感因素有:长期大量应用广谱抗菌药物;激素、免疫抑制剂的使用;肿瘤患者行放疗或(和)化疗;留置导尿管及尿路畸形等使尿路局部抵抗力下降;慢性严重疾病致使体质极度虚弱;糖尿病患者,尤其血糖大于8.3mmol/L者。
2.3 真菌药物敏感性特点临床真菌性尿路感染病例分离的所有念珠菌对两性霉B敏感。虽然白色念珠菌所致感染所占比例为第1位,但其绝大部分对临床常用抗真菌药物敏感。光滑念珠菌与热带念珠菌所致的尿路感染所占比例较高,且其易对唑类药物产生耐药,故应引起临床的充分重视。见表1。
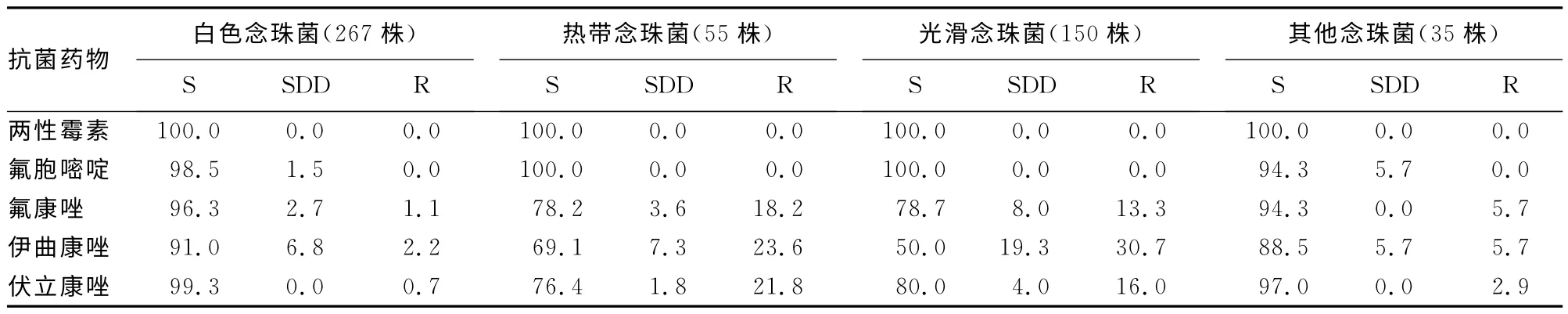
表1 临床常见抗真菌药物对尿路感染念珠菌的药物敏感性(%)
3 讨论
尿路感染是临床常见感染性疾病,细菌性尿路感染已成为影响住院患者的主要危害之一。近年来,真菌所致尿路感染发病率逐年上升。真菌培养及药敏试验不但可以准确提供尿路感染的病原菌种类,还可为临床合理使用抗真菌药物提供实验室依据,对研究尿路感染的流行病学调查、治疗效果、疾病转归及院内感染的控制均有重要意义。
本研究发现,白色念珠菌是真菌性尿路感染的主要病原菌,且其对临床常用抗真菌药物敏感性较高;其中氟康唑虽然在临床用药时间较长,但目前仍保持良好的活性,对治疗白色念珠菌性尿路感染效果良好。其次为光滑念珠菌和热带念珠菌,二者对唑类抗真菌药物敏感性较白色念珠菌低,且存在剂量依赖,临床治疗时应注意剂量的调整[5-6]。本研究中未发现有克柔念珠菌,故未对其敏感性进行分析。另外,分离到的35株其他念珠菌,在科玛嘉显色平板上显色不明确或显色为白色,后通过Vitek-2Compact仪器鉴定分属于不同的菌种,文中未具体列出。
由于不同种念珠菌对抗真菌药物的敏感性差异很大,因此实验室对临床分离株鉴定到菌种就显得尤为重要。准确的菌种鉴定和药敏报告可为临床有效治疗,以及减少耐药菌株的产生提供重要的科学依据。
[1]Fisher JF,Kavanagh K,Sobel JD,et al.Candida urinary tract infection:pathogenesis[J].Clinical Infectious Disea-ses,2011,52(Suppl 6):S437-S451.
[2]Gonzalez-Pedraza AA,Luis HR,Luna AJ,et al.Urinary tract infection by Candida species[J].Aten Primaria,2006,38(3):147-153.
[3]Osawa K,Shigemura K,Yoshida H,et al.Candida urinary tract infection and Candida species susceptibilities to antifungal agents[J].J Antibiot(Tokyo),2013,66(11):651-654.
[4]Pfaller MA,Espinel-Ingroff A,Bustamante B,et al.Multicenter study of anidulafungin and micafungin MIC distributions and epidemiological cutoff values for eight Candida species and the CLSI M27-A3 broth microdilution method[J].Antimicrob Agents Chemother,2014,58(2):916-922.
[5]Costa C,Nunes J,Henriques A,et al.Candida glabrata drug:H +antiporter CgTpo3(ORF CAGL0I10384g):role in azole drug resistance and polyamine homeostasis[J].J Antimicrob Chemother,2014,69(7):1767-1776.
[6]Forastiero A,Mesa-Arango AC,Alastruey-Izquierdo A,et al.Candida tropicalis antifungal cross-resistance is related to different azole target(Erg11p)modifications[J].Antimicrob Agents Chemother,2013,57(10):4769-4781.
