癫痫患儿血清中S-100β蛋白变化的意义
2014-11-21罗序峰朱建萍
吴 涛,罗序峰,张 胜,朱建萍,周 涛
(南方医科大学附属中山市博爱医院儿科,中山 528400;*通讯作者,E-mail:1438821620@qq.com)
癫痫是小儿神经系统的常见病,人群累积患病率为7%(2001)[1]。在癫痫人群患者中,50%以上在10岁以内起病。在新诊断的癫痫患者中,有20%的患者经治疗,其惊厥发作仍持续存在而成为难治性癫痫,严重影响小儿精神运动的发育[2]。而癫痫发作引起的脑部损伤早期通过影像学方法是不能观察到的。因此如果能寻找一种可以反映这种变化的生化指标,并且应用于临床,就可以及时检测到脑损伤,指导临床治疗。本文观察72例癫痫患儿血清中S-100β蛋白浓度的变化,发现血清中S-100β蛋白随癫痫病情严重程度而变化,推测S-100β蛋白可能可以作为反映脑损伤的严重程度和观察抗癫痫药物疗效的监测指标,现报告如下。
1 资料与方法
1.1 一般资料
收集2010-06~2012-12在我院儿科确诊的癫痫患儿72例,其中新诊断癫痫组28例(全面性发作及部分性发作);难治性癫痫44例。新诊断癫痫28例患儿从收住院完善检查,到确诊癫痫并加用药物治疗所用时间11-30 d不等,平均为14.8 d。难治性癫痫44例(其中婴儿痉挛22例,癫痫电持续状态11例,不典型失神2例,Lennox-Gastaut综合征1例,肌阵挛性癫痫3例,无法确定类型的癫痫5例),从首次确诊癫痫并接受正规的抗癫痫药物治疗,到确诊为难治性癫痫所用时间为4月-1.1年,平均为8.4月。全部病例均完善了头颅MRI、视频脑电图、血串联质谱分析、尿气相色谱分析、电解质、肝肾功能、血气、血氨等检查,排除了先天遗传代谢性疾病、颅内占位性疾病、脑出血、脑梗死及神经系统器质性疾病。诊断均符合癫痫及难治性癫痫的诊断标准[3]。均采用口服抗癫痫药物治疗:新诊断癫痫组28例为单药治疗;难治性癫痫组均为3种药物联合治疗。
72例癫痫患儿中,男性40例,女性32例;年龄最小4个月,最大8岁,中位年龄11个月。对照组31例均为同期我院儿童保健科健康体检的患儿(采血前已经与家长签署同意书);年龄最小7个月,最大6.5岁,年龄中位数11.5月,与研究组比较差异无统计学意义。
1.2 试验方法
新诊断癫痫病例组(确诊即采静脉血)、难治性癫痫组(分别于确诊及经治疗临床缓解50%以上4周时采静脉血)和对照组患儿均取静脉血2 ml,于低温离心机(4℃)2 000 r/min离心10 min,留取上清,置-20℃冰箱保存待检。S-100β蛋白水平测定采用酶联免疫吸附试验双抗体夹心法,试剂盒购自CUSa Bio.Biotech公司(美国)。检测仪器为酶标仪(DG3022型)。严格按说明书操作。
1.3 统计学分析
采用SPSS13.0统计软件,对计量资料采用配对t检验及单因素方差分析,对计数资料采用卡方检验。P<0.05为差异有统计学意义。
2 结果
三组治疗前血清S-100β蛋白测定结果显示,新诊断癫痫组及难治性癫痫组血清S-100β蛋白均明显高于对照组,差异显著(P<0.01,见表1);难治性癫痫组血清S-100β蛋白明显高于癫痫组,差异有统计学意义(P<0.01)。
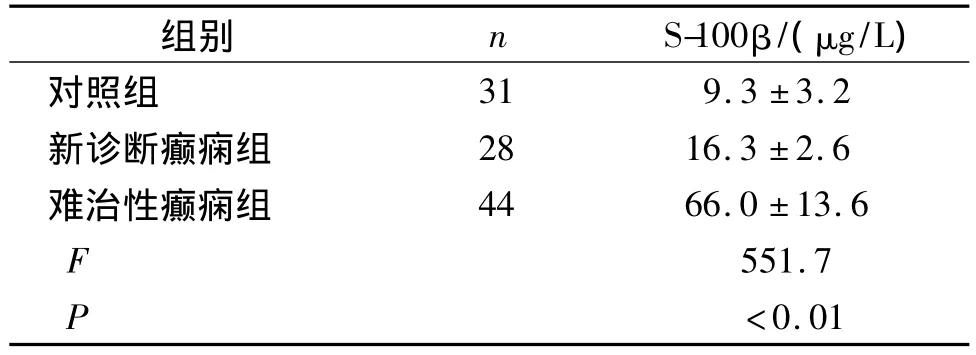
表1 治疗前新诊断癫痫组、难治性癫痫组与对照组血清S-100β蛋白测定结果Table 1 Comparison of serum level of S-100βprotein among three groups before treatment
难治性癫痫组治疗前后血清S-100β测定结果显示,治疗后(症状缓解50%以上4周)血清S-100β蛋白较治疗前明显降低,差异有统计学意义[(19.62±8.07)μg/L vs(66.0± 13.6)μg/L,t=18.509,P<0.01]。
3 讨论
癫痫是一种常见的、慢性脑部疾病,其特点是由于大脑神经元过度同步放电所致的突然、短暂的和反复性发作的中枢神经系统功能失常。癫痫的整个神经活动过程中,神经细胞膜、突触功能以及兴奋性和抑制性介质起着极其重要的作用,常伴随不同程度的脑组织损伤。有研究显示[4],癫痫发作造成脑组织损伤是一个慢性、复杂的过程,涉及脑微血管的改变,神经元变性、坏死、凋亡,胶质细胞增生,中枢神经髓鞘的脱失等病理变化。
S-100蛋白是一种能与钙、锌结合的酸性蛋白家族。由α、β两种亚基组成。S-100αα(主要存在于横纹肌、心脏、肾脏)、S-100αβ(主要存在于胶质细胞)、S-100ββ(主要存在于神经胶质及雪旺细胞)三种组合形式。中枢神经系统表达的主要是S-100β,主要定位于星形胶质细胞,少突胶质细胞及周围神经系统的Schwann细胞,是S-100蛋白的活性形式。S-100β蛋白基因位于人类2l号染色体远端q22.2-q22.3处,编码 91个氨基酸。S-100β是在脑内主要和最具活性的成员,具有调节细胞生长、能量代谢和参与细胞内信号传导的作用,是胶质细胞与神经元相互作用的桥梁。S-100β对中枢神经系统组织具有高度特异性,生理浓度下发挥多种重要的生理功能;过量则诱导细胞凋亡、甚至坏死。S100β持续激活RAGE受体,破坏细胞内的氧化还原反应,增加了氧自由基的产生,引起线粒体功能的紊乱和细胞凋亡;过多的S-100β也可参与炎症反应加重脑损伤。中枢神经系统受损时,S-100β蛋白在脑脊液中的浓度可以反映中枢神经系统受损害的程度。同时S-100β蛋白可透过受损的血脑屏障进入血液循环,所以通过检测血清中S-100β蛋白浓度同样可以反应脑损害的程度。另一方面,S-100β蛋白作为一种钙结合蛋白参与Ca2+介导的信号传递途径,而Ca2+在癫痫的发病中具有重要的作用。有文献[5]报道,卡因酸注射鼠细胞外S100β水平明显增加,这一结果提示S-100β的释放与癫痫发病有关。癫痫发作可引起S-100β蛋白的增加,而增加的S-100β可通过改变神经元的电活动而促使癫痫发作。综上所述,S-100β蛋白可以作为评价及检测脑组织损伤的特异性指标[6]。
本文针对72例癫痫患儿及31例正常对照组儿童血清中S-100β蛋白浓度进行测定,结果显示:癫痫组及难治性癫痫组血清S-100β均明显高于对照组,差异非常显著(P<0.01);难治性癫痫组较初诊断癫痫组血清S-100β蛋白水平明显升高,差异显著(P<0.01);提示癫痫患儿血清S-100β蛋白水平明显升高;其升高的程度与癫痫的严重程度相关。与相关报道一致[6]。
本文中44例难治性癫痫患儿治疗后(症状缓解50%以上4周)血清S-100β蛋白水平明显低于治疗前,差异有统计学意义(P<0.01)。此结论显示,随着癫痫患儿症状的缓解,血清S-100β蛋白水平明显下降。提示血清S-100β蛋白可以作为癫痫疗效判断的指标,与相关报道一致[7]。
综上所述,血清S-100β蛋白浓度的变化,对于癫痫导致的脑损伤具有早期预警作用。其测定方便、可靠、实用,可帮助临床提高癫痫的诊断、判断预后、估计疗效。
[1]胡亚美,江载芳,诸福棠.实用儿科学[M].北京:人民卫生出版社,2008:1850-1851.
[2]吴希如,林庆.小儿神经系统疾病基础与临床[M].北京:人民卫生出版社,2000:34.
[3]林庆.小儿癫痫发作的分类及最新进展[J].中华儿科杂志,2002 ,40(5):313-315.
[4]Sutula TP,Hagen J,Pitkanen A.Do epileptic seizures damage the brain[J].Curt Opin Neurol,2003,16(2):189-195.
[5]Sakatani S,Seto-Ohshima A,Shinohara Y,etal.Neura-activitydependent release of S-100βfrom astroeytes enhances kainite-induced gamma Oscilations in vivo[J].J Neurosci,2008,28(43):10928-10936.
[6]杭妍,张晖.癫痫脑损伤早期标志物的研究进展[J].医学综述,2010,4(18):1190-1192.
[7]MeHo LE,Cavailheiro EA,Tan AM,etal.Circuit mechanisms of seizures in the pilocarpine model of chronic epilepsy:cell loss and mossy fiber sproufing[J].Epilepsia,1993,34(6):985-995.
[8]马欢,陈雪红,王正江,等.癫痫发作间期脑血流灌注功能与脑组织损伤程度相关性研究[J].中华核医学杂志,2011,31(1):58-60.
