季铵盐-镧-蒙脱土复合材料的制备及性能研究
2014-11-18姜秀榕吴惠亮林标声
姜秀榕,吴惠亮,林标声
(1.龙岩学院 化学与材料学院,福建 龙岩 364000;2.龙岩学院 生命科学学院,福建 龙岩 364000)
0 引言
膨润土(bentonite)的主要成分是蒙脱土(montmorillonite,MMT).蒙脱土的主要成分为蒙脱石.蒙脱土的分子式为(Al2-xMgx)Si4O10(OH)2·(M·nH2O)[1],其中M=Na+,Ca2+,Mg2+.晶体属单斜晶系2:1 型结构的层状硅酸盐粘土矿物,厚度约为1mm.蒙脱土的单位晶胞由两层硅氧四面体夹一层氧铝八面体组成.四面体片由一个硅和四个氧紧密堆积,按二维面呈六角网连接,无限展开所构成;八面体片是铝按六次配位与O 或OH 紧密堆积而成八面体沿二维面无限展开构成;四面体片和八面体片相结合组成层状硅酸盐的晶层.八面体空隙中的阳离子为A13+离子,剩下两个空位,为二八面体型.MMT 四面体中的Si4+常被Al3+代替,八面体中的Al3+常被Mg2+、Fe3+、Fe2+、Ni2+、Li+等代替,从而使层间产生弱的负电荷.特殊的结构,使得蒙脱土具有独特的性质,具有较大的表面活性,较高的阳离子交换能力.同时蒙脱土具有很强的离子吸附性能,因此适合作为有机无机阳离子抗菌剂的吸附载体,所制备的抗菌剂添加在蒙脱土中可以制得长效的抗菌材料及制品,具有广泛的应用前景[2~7].本文采用将镧离子和季铵阳离子依次插入蒙脱土层间的方法,希望能够制得一款抗菌谱较广、稳定性好的新型复合抗菌剂,进而探究其抗菌性能.
1 实验
1.1 主要仪器和试剂
1.1.1 仪器
DX-2700 型X 射线衍射仪(丹东方圆仪器有限公司);DF-101S 集热式电动加热磁力搅拌器(巩义市英峪予华仪器厂);GZX-GF-9053A 电热恒温鼓风干燥箱(上海博泰实验设备有限公司);FTIR-7600 红外光谱仪(天津天光光学仪器有限公司);BS124S 电子天平(赛多利斯科学仪器(北京)有限公司);SHB-3 循环水多用真空泵(郑州杜甫仪器厂).
1.1.2 试剂
氟化钠(NaF)、十六烷基三甲基溴化铵(CTAB)、水合硝酸镧、硝酸银(广东·汕头市西陇化工厂生产);营养琼脂培养基、金黄色葡萄球菌和大肠杆菌(龙岩学院生物生命科学学院提供).
1.2 实验方法
1.2.1 有机蒙脱土的制备流程

图1 改性蒙脱土的制备工艺
1.2.2 精制蒙脱土
将一定量的连城膨润土原矿粉粉碎后置于崩解槽内,加水制成10%左右的悬浊液,粗滤除去泥沙等杂质后转入静置槽,经5~6 h 静置沉降分离后,于GZX-GF-9053A 电热恒温鼓风干燥箱110℃干燥48 h,研磨过325 目筛,得到精制蒙脱土,装瓶备用.
1.2.3 钠基蒙脱土的制备
往10%精制蒙脱土矿浆溶液中加入4.2%的氟化钠溶液,置于DF-101S 集热式电动加热磁力搅拌器中,调节磁力搅拌器的转速为1800 r/min,在70℃下恒温搅拌1.5 h,过滤得到白色沉淀物.将过滤得到的白色沉淀物置于65℃电热恒温鼓风干燥箱中真空干燥48 h,研磨,过325 目筛,装瓶备用.
1.3 复合抗菌剂的制备
1.3.1 载镧蒙脱土制备
先将5 g 钠基蒙脱土通过搅拌分散在50 mL 去离子水中得到悬浮液,再加入5 mmol 的水合硝酸镧,置于DF-101S 集热式电动加热磁力搅拌器中,于65℃下恒温搅拌4 h,抽滤,得到沉淀物;用去离子水反复洗涤、过滤.将沉淀物取出置于坩埚中,于65℃恒温鼓风干燥箱中真空干燥48 h,研磨,过325目筛,即得载镧蒙脱土(La-MMT).
1.3.2 季铵盐与钠基蒙脱土的离子交换
取5 g 钠基蒙脱土通过搅拌分散于20 mL 蒸馏水中,调节pH 值为7~8,加入40 mL 溶有5.5 mmol十六烷基三甲基溴化铵(CTAB)的溶液.将混合物置于DF-101S 集热式电动加热磁力搅拌器中80℃下恒温反应2 h,冷却,用蒸馏水多次洗涤,用0.1 mmol/L的AgNO3 溶液检查至溶液中无Br-离子.在恒温鼓风干燥箱中80~100℃下真空干燥烘干,研磨过325 目筛,制得十六烷基三甲基季铵盐改性蒙脱土(CTAB-MMT).
1.3.3 季铵盐-镧-蒙脱土复合材料的制备
将5.0 g 载镧蒙脱土(La-MMT)通过搅拌分散在100 mL 蒸馏水中,加入2.5 mmol 十六烷基三甲基溴化铵(CTAB),将混合物置于DF-101S 集热式电动加热磁力搅拌器中65℃条件下恒温搅拌5 h,抽滤,得到沉淀物,用蒸馏水反复洗涤、过滤,直至滤液中无Br-检出(用0.1 mmol/L 的AgNO3溶液检验),然后在恒温鼓风干燥箱中,65℃条件下真空干燥48 h.研磨,过325 目筛,即得十六烷基三甲基季铵盐-镧-蒙脱土复合材料(CTAB-La-MMT).
1.4 结构与成分表征
XRD 测试分析:使用DX-2700 型X-射线衍射仪对样品进行分析,Cu Ка 射线,λ=0.15418 nm,管电压35 KV,管电流30 mA,扫描速度为0.03°/ min,扫描范围2θ 为2°~10°,蒙脱土层间距由Bragg 方程计算.
红外光谱分析:使用FTIR-7600 红外光谱仪对样品进行红外光谱分析,光谱范围0-4500 cm-1.
1.5 抗菌活性测试
1.5.1 抑菌环试验
抑菌环实验参照文献[8]进行.将直径90 mm 玻璃培养皿及配好的营养琼脂培养基放在高温灭菌锅中,0.15 MPa 下灭菌20 min.待高温灭菌后的营养琼脂培养基自然冷却至50℃左右,在无菌操作台中倒平板固化.待固化约10 min 中后,用移液枪分别取适量金黄色葡萄球菌(Stapyloccus.aureus)和大肠杆菌菌(Escherichia.coli)菌液(0.2 mL,浓度约为1 ×106cfu/mL)注入相应的营养琼脂平板上,用涂布器涂布均匀.将直径5 mm 的滤纸圆片置于15 mL Na-MMT 溶液中浸泡20 min,晾干,制成圆形片剂.将制得的圆形片剂置于平板中央,分别作3 组平行实验.然后将培养皿置于37℃的恒温培养箱中培养24 h.用游标卡尺测量试样周围的抑菌圈的大小.以抑菌圈直径的平均值作为材料抗菌性能的评价依据.
同样,对La-MMT、CTAB-MMT 和CTAB-La-MMT 做相同抑菌环实验.
1.5.2 最小抑菌浓度(MIC)的测定
将玻璃培养皿及配好的营养琼脂培养基在高温灭菌锅中,0.15 MPa 下灭菌20 min.将营养琼脂培养基分别盛放在相应编号的锥形瓶中,于50℃条件下恒温水浴中保温.分别取6.4、3.2、1.6、0.8、0.4、0.2、0.1mg Na-MMT 加适量水溶解成相应浓度的浆液与琼脂培养基充分振动混合均匀.在无菌操作台中,将加入改性蒙脱土的营养琼脂培养基倒平板固化.用移液枪将事先调配好的金黄色葡萄球菌(Staphyloccus.aureus)和大肠杆菌菌(Escherichia.coli)菌液菌液约0.2 mL注入倒好的平板中,用涂布器均匀涂布.另外,取菌液约0.2 mL 均匀涂布在未加入载钠蒙脱土的培养基上,做阳性对照.然后将培养皿置于37℃的霉菌培养箱中培养24 h,观察.
同样,对La-MMT、CTAB-MMT 和CTAB-La-MMT 做相同的最小抑菌浓度测试实验.
2 结果与讨论
2.1 结构表征
2.1.1 蒙脱土的X-射线衍射(XRD)分析
本文采用XRD 对无机蒙脱土(Na-MMT)及改性蒙脱土(CTAB-MMT、La-MMT、CTAB-MMT)的层间距进行了测定,图3 为蒙脱土的XRD 图谱.
根据Bragg 方程:λ=2d sin θ,式中d 为蒙脱土硅酸盐片层之间的平均距离即(001)面的距离,θ 为半衍射角,λ 为入射X-射线波长,λ=0.154 nm.
由公式可以计算出蒙脱土的层面间距.
由图2 可知,钠基蒙脱土的2θ 为6.095°,d001面的层间距为1.448 nm,经过表面改性后的蒙脱土的2θ 均向小角度方向偏移,分别偏移到5.887°,4.387°和4.762°,面间距分别增加到1.499 nm(La-MMT)、2.012 nm(CTAB-La-MMT)和1.853 nm(CTAB-MMT).这使得三个晶片的实际层间距d(d=d001-0.96,0.96 是粘土的底面间距)由0.488 nm(Na-MMT)分别增加到0.539 nm(La-MMT)、1.052 nm(CTAB-La-MMT)和0.893 nm(CTABMMT).比较这些数据可以看到随着改性剂的变化,层间距发生了变化.这说明有较大的阳离子进入到蒙脱土的片层之间,增加了蒙脱土的片层间距,改善了蒙脱土的有序度.层间距的膨胀,使得处于层间可交换位置和晶内孔隙位置的镧离子,均易进入溶液,从而表现出抗菌性.
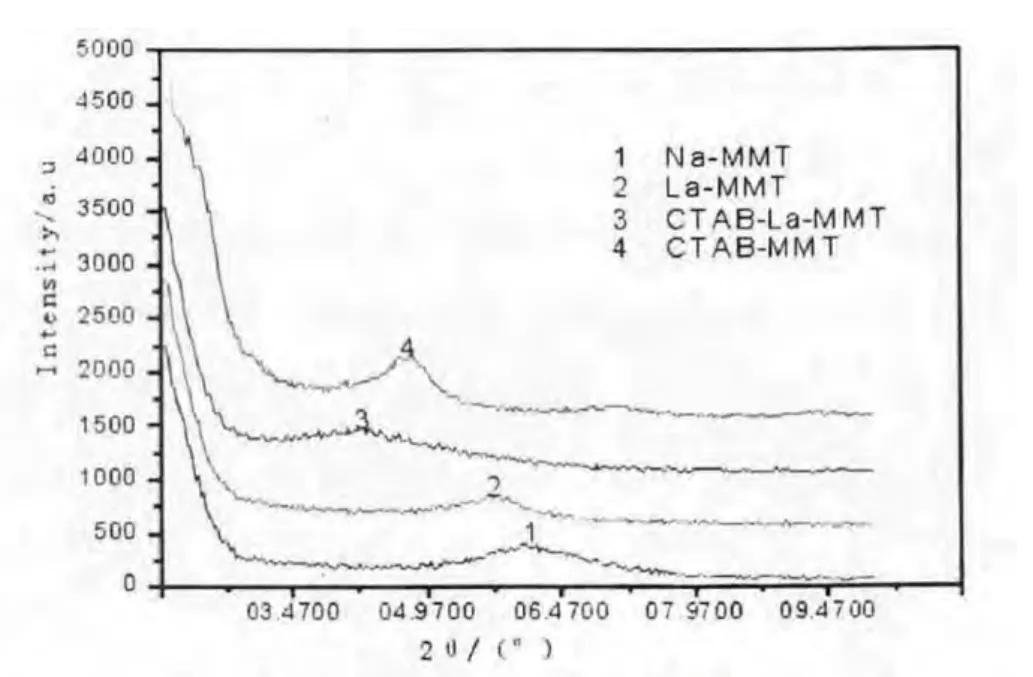
图2 各种蒙脱土的XRD 谱图

表1 蒙脱土的层面间距
2.1.2 蒙脱土的红外表征
图3 是Na-MMT、La-MMT 和CTAB-MMT,CTAB-La-MMT 的红外光谱图.从图3 中可以看出,Na-MMT 和改性蒙脱土的红外光谱的共同特征是在3623 cm-1 处都有Al-O-H 的伸缩振动和1000-1100cm-1处的Si-O-Si 的骨架振动吸收峰,800-500 cm-1为硅氧四面体和氧铝八面体的内部震动.La-MMT 在2851、2937、3025cm-1处出现C-H 伸缩振动峰,CTAB-La-MMT 在1475 cm-1处峰的强度加强.结合CTAB-La-MMT 的XRD 谱图,结果表明CTAB-La 已经结合进入到蒙脱土的层间.

图3 各种蒙脱土的红外光谱图
2.2 抗菌性能研究
2.2.1 抑菌环
钠基蒙脱土(Na-MMT)、改性蒙脱土的抑菌圈照片如图4 所示,抑菌环直径大小见表2.对于E.coli 和S.aureus,Na-MMT 样片的周围均未出现明显的抑菌圈,说明几乎没有抑菌作用;而CTAB-MMT、La-MMT 和CTAB-La-MMT 样片的周围出现了较为明显的抑菌环.对E.coli,CTAB-MMT、La-MMT 和CTAB-La-MMT 的抑菌圈大小分别为7 mm,8 mm,12 mm.对S.aureus,CTAB-MMT、La-MMT 和CTAB-La-MMT 的抑菌圈大小分别为12 mm,16 mm,20 mm.
对同一种细菌而言,CTAB-La-MMT 的抑菌圈大于La-MMT 和CTAB-MMT,而抗菌活性的强弱由抑菌环的大小决定.因此,对同一种细菌而言,CTAB-La-MMT 的抗菌活性大于La-MMT 和CTAB-MMT,这是因为复合抗菌剂的抗菌性能与季铵盐的烷基长链的亲油性和正电荷有关,镧离子和季铵盐阳离子的协同效应使得抗菌活性提高.而且同一种改性蒙脱土对S.aureus 的抗菌效果比E.coli 好,这是因为E.coli 是革兰氏阴性菌,而S.aureus 是革兰氏阳性菌,从细胞壁结构来看,虽然革兰氏阳性菌具有比革兰氏阴性菌厚的多的肽聚糖细胞壁,但其结构粗糙,很难阻止小分子的扩散.而革兰式阴细菌比革兰式阳性菌的细胞壁更复杂,且有一层像筛子一样荚膜,抗菌活性物质很难越过荚膜[9],使得改性蒙脱土更易进入S.aureus 细胞内,显示出较强的抗菌活性.

图3 各种蒙脱土的红外光谱图

表2 Na-MMT 和改性蒙脱土的抑菌圈大小
2.2.2 最小抑菌浓度MIC 的测定结果
从表3 可以看出,Na-MMT 对E.coli 和S.aureus 的最低抑菌浓度均大于6400 mg/L,说明钠基蒙脱土的抗菌效果很差.CTAB-MMT 对E.coli和S.aureus 的最小抑菌浓度分别为1600 mg/L 和400 mg/L,相对于Na-MMT 而言,抗菌效果有所改善.La-MMT 抗菌剂对E.coli 和S.aureus 的最小抑菌浓度分别为1600 mg/L 和800 mg/L,抗菌效果相对来说不如CTAB-MMT.而CTAB-La-MMT复合抗菌剂对E.coli 和S.aureus 的最小抑菌浓度分别为400 mg/L 和200 mg/L,其抗菌效果明显比CTAB-MMT、La-MMT 都好.

表3 Na-MMT 和改性蒙脱土的最小抑菌浓度(MIC)
3 结论
(1)用XRD,FT-IR 对所合成的改性蒙脱土进行表征,结果表明CTAB-La 已经进入了蒙脱土之间,其层间距达2.012 nm.
(2)通过抑菌环实验表明,CTAB-La-MMT 复合物的抗菌效果好,抗菌谱比较广,对是革兰氏阴性菌和革兰氏阳性菌均有较好的抗菌效果,CTAB-La-MMT 复合抗菌剂对E.coli 和S.aureus 的最小抑菌浓度分别为400 mg/L 和200 mg/L,抑菌环直径高达20.00 mm.
[1]李娜,马建中,鲍燕.蒙脱土改性研究进展[J].化学研究,2009,20(1):98-103.
[2]张葵花,谭绍早,刘应亮.季铵盐改性蒙脱土的抗菌活性及抗菌机理[J].硅酸盐学报,2006,34(1):87-92.
[3]HU C H,XU Z R,XIA M S.Antibacterial effect of Cu2+-exchanged montmorillonite on Aeromonas hydrophila and discussion on its mechanism[J].Veterinary Microbiology,2005,109:83-88.
[4]谭绍早,马文石,刘应亮.新型改性蒙脱土复合抗菌剂的制备及抗菌性能[J].华南理工大学学报:自然科学版,2006,34(8):2-6.
[5]周祚万,刘国梅,罗雁彬,等.国内外无机抗菌材料研究动态[J].新材料产业,2007 (3):80-82.
[6]谭绍早,郑佳,陈茵,等.含季鏻阳离子的抗菌改性蒙脱土的制备及表征[J],无机材料学报,2009,24(3):507-511.
[7]吴婷,闫新亚,蔡祥,等.季铵盐插层蒙脱土及其去除海洋卡盾藻的研究[J],无机化学学报,2010,26(8):1399-1403.
[8]KOGA HIROTAKA,KITAOKA TAKUYA,WARIISHI HIROYUKI.In situ synthesis of silver nanopartcles on zinc oxide whiskers incorporated in a paper matrix for antibacterial applications.Journal of Materials Chemistry,2009,19(15):2135-2140.
[9]OYA A,BANSE F.An antimicrobial and antifungal agent derived from montmorillontie[J].Applied Clay Science,1991,6(2):135-142.
