锌焙砂的选择性还原焙烧硫酸浸出工艺研究
2014-11-16侯栋科彭兵柴立元彭宁闫缓胡明
侯栋科 , 彭兵 ,2, 柴立元 ,2, 彭宁 , 闫缓 , 胡明
(1.中南大学冶金与环境学院环境工程研究所,长沙 410083;2.国家重金属污染防治工程技术研究中心,长沙 410083)
0 引 言
锌精矿主要以闪锌矿(ZnS)或铁闪锌矿(n ZnS,m FeS)形成存在,铁闪锌矿在我国分布广泛,其中仅云南省的高铁锌资源含锌储量就高达700万t[1].目前,80%以上的金属锌生产采用 “焙烧-浸出-净化-电积”湿法工艺流程.在氧化焙烧过程中,生成的氧化锌和伴生的铁反应生成结构稳定、普通条件下难以溶解的铁酸锌.铁酸锌的生成不仅降低了锌的回收率,造成有价金属的流失,而且含铁酸锌浸出渣的堆置也存在较大的环境风险[2].随着高铁硫化锌精矿越来越多地投入生产,铁酸锌的处理成为锌冶炼过程当中亟需解决的关键问题.
工业上处理锌冶炼过程中产生铁酸锌的主要方法[3]包括高温高酸浸出和回转窑烟化法,前者是在高温高酸的条件下将铁酸锌溶解,锌铁同时进入溶液,因而需要进行繁琐的沉铁净化以满足电积要求;后者则是在高温强还原条件下,破坏铁酸锌的结构,利用锌熔点较低的特点使锌从中挥发出来,但该工艺操作条件差、能耗高、污染重.
为了克服这些工艺的弊端,LangováŠ等[4]改变浸出体系,采用盐酸选择性浸出锌,该方法具有锌浸出率高、选择性分离好的优点,但需要高温高酸高压的苛刻反应条件;张承龙等[5]采用碱性溶液浸出含锌废渣,虽然可以提取大部分锌,但仍难以从铁酸锌中回收锌;Vahidi E等[6]使用萃取法回收锌浸出渣硫酸浸出液中的锌,锌的回收率很高,但萃取剂的再生问题尚需解决;氨浸条件下浸出率不高,同时存在着氨气污染和设备腐蚀的缺陷[7].可见单纯改变浸出体系不足以有效解决问题,为此Zhang Y等[8-9]提出了硫化焙烧-水浸等的火法-湿法组合工艺,这些工艺将废渣中的铁酸锌转化为可溶的中间产物,再进行湿法浸出,浸出液中铁锌分离困难的问题仍未解决;Li M[10-11]等开发了选冶联合的新工艺,采用磁法焙烧-磁选联合工艺处理含铁酸锌废渣,实现同步回收锌和铁,该工艺铁回收率高,但存在铁品位较低难以资源化的问题.
本研究在弱还原性气氛下,通过对焙烧条件的调控,使锌焙砂中铁酸锌选择性地转化为氧化锌和磁铁矿.由于磁铁矿和铁酸锌具有相同的结构,能够在中性或弱酸性条件下不被浸出,因此可以通过还原焙烧提升锌焙砂中可溶解性锌的含量,同时在硫酸浸出过程中实现铁锌分离.
1 实验材料及方法
1.1 实验原料
本研究所使用的锌焙砂取自内蒙古某铅锌冶炼厂,焙砂的元素含量经XRF检测,分析结果如表1所示,其中含有57.37%的锌和12.1%的铁,铁含量较高,为高铁锌焙砂.锌焙砂的物相成分经XRD分析(图1)可得,主要物相成分为氧化锌、铁酸锌、硅酸锌、硫化锌.锌焙砂中的可溶解性锌主要以氧化锌、硫酸锌、硅酸锌的形式存在,难溶解性锌则以铁酸锌和硫化锌的形式存在.化学物相分析结果如表2所示,铁酸锌中锌占总锌的12.84%,成为制约锌浸出的关键.

表1 锌焙砂的元素含量/wt%
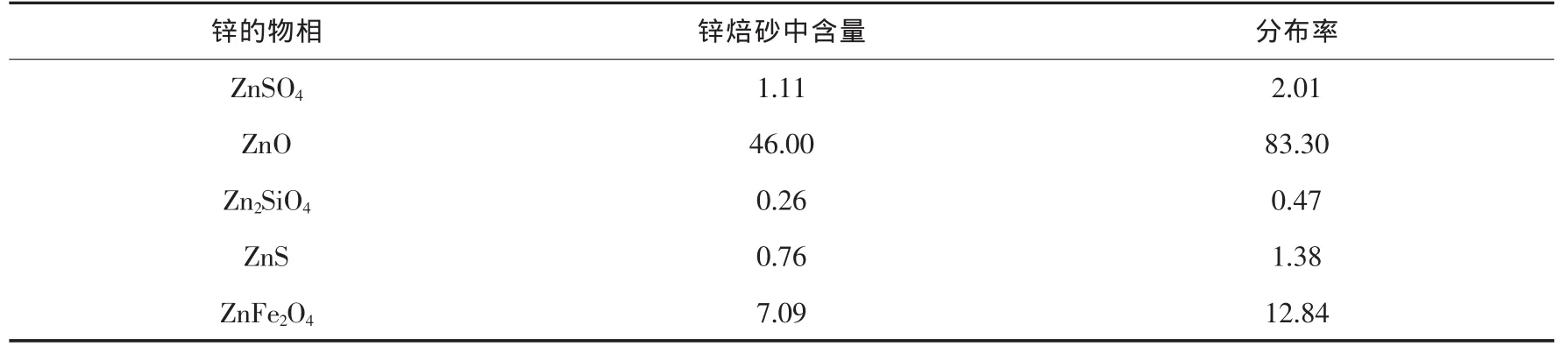
表2 锌焙砂的物相含量/wt%
1.2 试验方法
1.2.1 还原焙烧
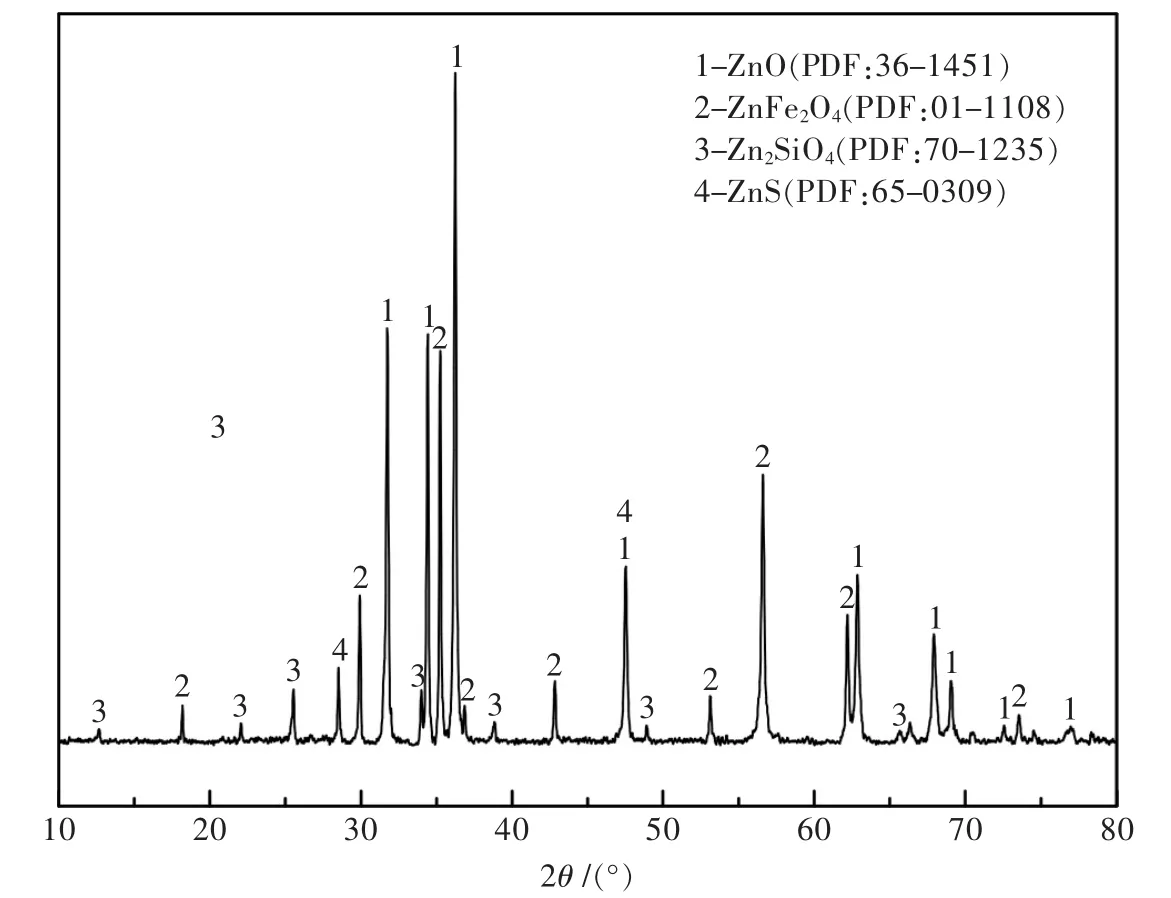
图1 锌焙砂的XRD谱
还原焙烧实验在管式升降气氛炉中进行,依据反应的热力学计算结果划定实验条件范围,分别考察焙烧温度、CO 浓度、CO/(CO+CO2)和焙烧时间对焙烧效果的影响.每次称取50 g锌焙砂置于坩埚中,在惰性氮气流中升温至预定温度,然后按照CO浓度和CO/(CO+CO2)的气氛比例通入CO和CO2气体,调整N2流量使总流量为2 L/min.达到反应时间后,迅速将焙烧样品取出水淬冷却,过滤烘干后,分析检测以评价焙烧效果.
1.2.2 硫酸浸出
确定最佳焙烧条件后,批量制备还原焙砂进行酸性浸出条件实验.浸出实验在六联搅拌器中进行,搅拌速率控制为300 r/min,硫酸体积为100 mL.依据化学反应计算确定实验酸度条件范围,分别考察浸出温度、硫酸浓度、液固比(mL:g)(指液体体积与固体质量之比(下同))和浸出时间对浸出效果的影响.反应一段时间后,准确吸取浸出液分析其中的铁锌含量,计算浸出率以评价浸出效果.为了防止吸取溶液对液固比的影响,浸出时间的条件实验采用500 mL的硫酸.
1.3 分析及检测
铁锌的含量及物相的分析依据文献[12]中介绍的方法,分别采用EDTA滴定法测定锌,重铬酸钾滴定法测定铁.其中,可溶解性锌的含量等于焙砂中硫酸锌、氧化锌及硅酸锌的含量之和,即为用硅酸锌的物相分离方法溶解的锌含量.用20%的醋酸一步溶出焙砂中的可溶解性锌成分,避免了多步物相分离所造成的实验误差,在最优浸出条件尚未确定的情况下以此评价焙烧效果.实验过程中为了防止铁的浸出,需要避免铁酸锌过还原形成氧化亚铁,但是化学分析较难准确测定铁的物相及含量,因此用亚铁含量作为评价过还原程度的指标.
使用X射线衍射分析仪(Rigaku,TTR-Ⅲ)鉴定锌焙砂原样、还原焙砂的物相成分,用扫描电镜及电子能谱(SEM-EDS,Nova NanoSEM230)观察还原焙砂的微观形貌和表面成分.
2 结果与讨论
2.1 还原焙烧工艺
2.1.1 还原焙烧反应的热力学分析
锌焙砂的还原焙烧过程是在CO+CO2+N2的混合气氛中进行,为了实现铁酸锌选择性转化为磁铁矿和氧化锌,同时避免磁铁矿和氧化锌的过还原,需要对焙烧温度和还原气氛进行调控.
锌焙砂中的铁酸锌在还原焙烧过程中,主要发生如下反应:
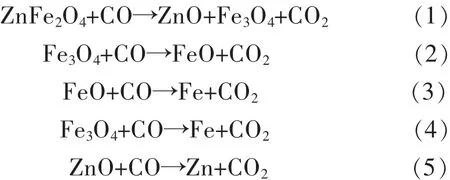
图2和图3是根据热力学计算软件Factsage[13]所提供的热力学参数绘制而成.由图2可见,铁酸锌的选择性还原焙烧即反应(1)所需的CO气氛比例很低,750℃下仅需 2.6%以上的 CO/(CO+CO2), 并随着温度的升高所需CO气氛比例逐渐降低.但过高的反应温度也会降低过还原反应即反应(2)所需的CO气氛比例,因此必须同时调控温度和气氛比例,使得有利于铁酸锌的选择性还原和防止过还原.750℃下Fe-Zn-C-O系的热力学优势区域图如图3所示,铁酸锌选择性还原形成磁铁矿和氧化锌的区域较大.图3中方点表示固定CO/(CO+CO2)为20%、CO浓度变的实验条件,可见在20%CO/(CO+CO2)的气氛比例条件下,有限的CO浓度变化的反应条件均会落在选择性还原的优势区域(Fe3O4+ZnO)内.图2中圆点表示固定CO浓度为8%、CO/(CO+CO2)气氛比例变化的实验条件,可见在固定CO浓度的条件下,气氛比例CO/(CO+CO2)的变化会使反应条件落入过还原的优势区域(FeO+ZnO)中,因此在750℃的条件下应重点控制 CO/(CO+CO2)比例低于 36.18%.
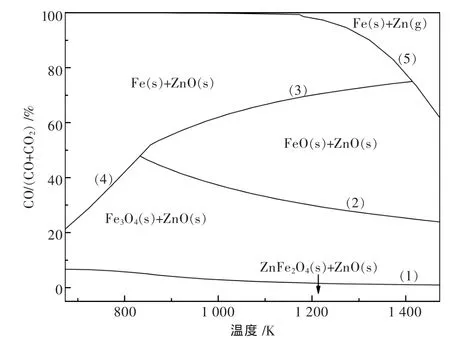
图2 CO还原铁酸锌的平衡气相组成与温度的关系
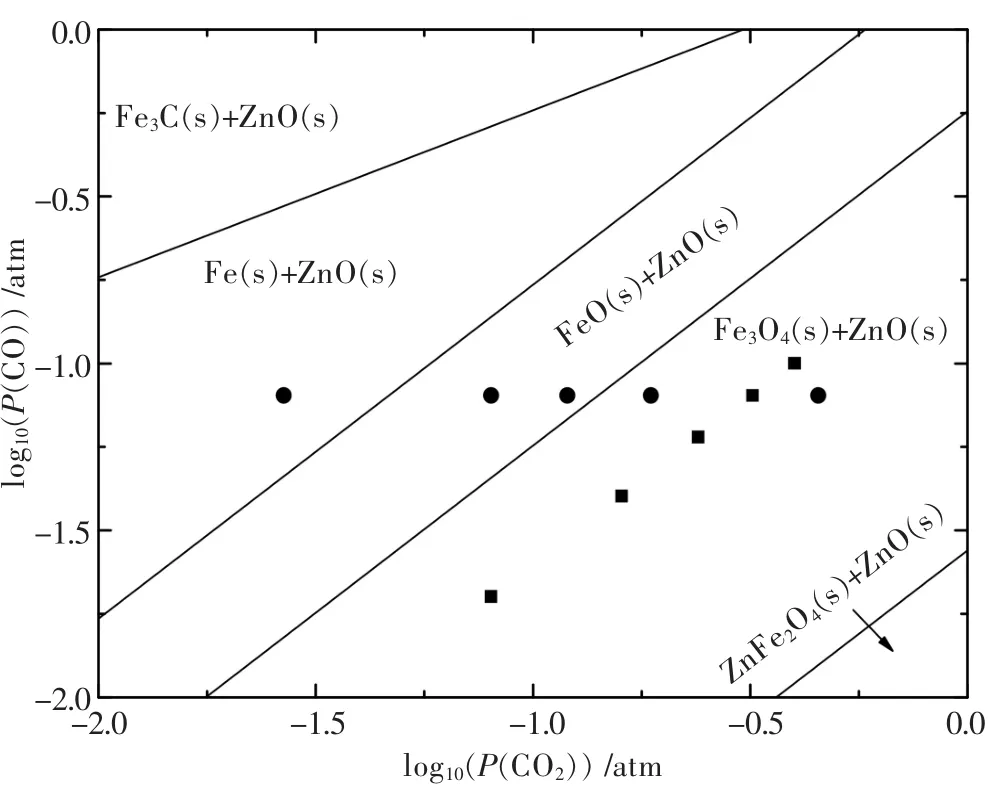
图3 750℃下的Fe-Zn-C-O系的热力学优势区域图
2.1.2 温度对焙烧效果的影响
在 CO 浓度为 8%,CO/(CO+CO2)为 20%,焙烧时间为1 h的条件下,考察焙烧温度对可溶锌率和亚铁含量的影响,分别进行了温度为650℃、700℃、750℃、800℃、850℃的条件实验,结果如图4所示.由图4可以看出,焙烧温度从650℃提升至750℃时,可溶锌率从87.05%提高至91.75%.之后随着温度的升高,可溶锌率变化不大;亚铁含量却一直随着温度的增高而增大,并且超过750℃后,有显著的提高,含量超过50%达到60.65%.这说明温度对焙烧效果有较大影响,过高的焙烧温度对可溶锌率的提升不大,反而会导致磁铁矿的过还原,导致亚铁的大量生成,不利于后续浸出工艺中锌铁的分离;同时过高的反应温度也会导致富锌体系的锌焙砂中氧化锌的过还原.因此,选取750℃为锌焙砂还原焙烧的最佳焙烧温度.
2.1.3 CO浓度对焙烧效果的影响
在 CO/(CO+CO2)为 20%,焙烧温度为 750 ℃,焙烧时间为1 h条件下,考察CO浓度对可溶锌率和亚铁含量的影响,分别进行了CO浓度为2%、4%、6%、8%、10%的条件实验,结果如图5所示.
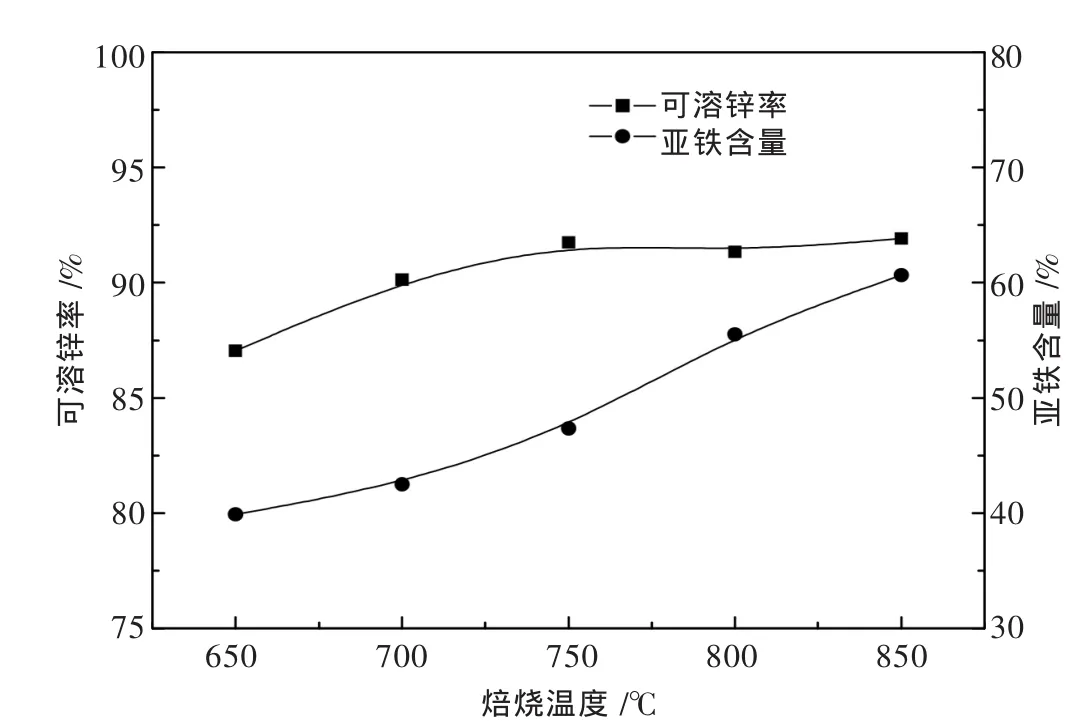
图4 焙烧温度对可溶锌率和亚铁含量的影响
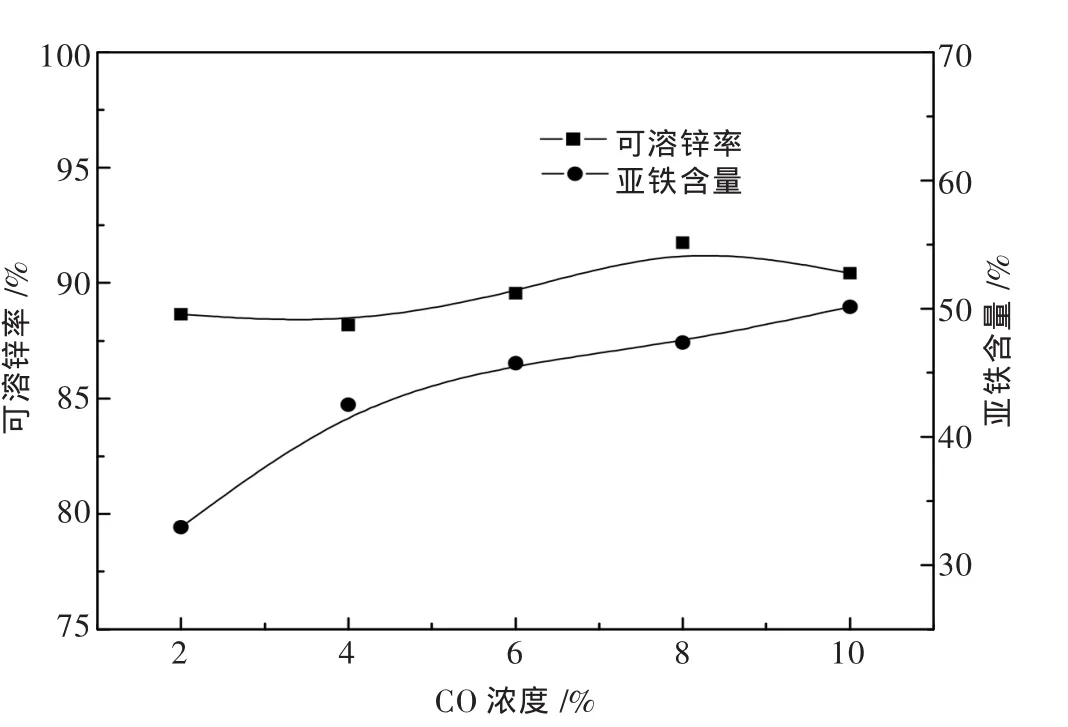
图5 CO浓度对可溶锌率和亚铁含量的影响
由图5可见随着CO浓度的增加,可溶锌率从88.65%提升为91.75%,当CO浓度超过8%时,继续提高CO浓度,可溶锌率略有下降,亚铁含量略有上升.在 20%CO/(CO+CO2)的气氛比例条件下,亚铁含量达到50.15%,其增长受到控制.由此可见,在控制气氛比例的前提下,CO的浓度变化对可溶锌率和亚铁含量影响不大,但从工业应用和节能减排的角度考虑,选取8%的CO浓度作为最优条件.
2.1.4 CO/(CO+CO2)对焙烧效果的影响
在CO浓度为8%,焙烧温度为750℃,焙烧时间为1 h的条件下,考察 CO/(CO+CO2)气氛比例对可溶锌率和亚铁含量的影响,分别进行了CO/(CO+CO2)为 15%、20%、30%、40%、50%、75%的条件实验,结果如图6所示.
从图6可以看出,CO/(CO+CO2)从15%提高为20%时,可溶锌率从89.97%提升到91.75%,之后即保持不变,并略有降低.亚铁含量仍然随着CO/(CO+CO2)的升高而升高,并且最高达到70.85%.根
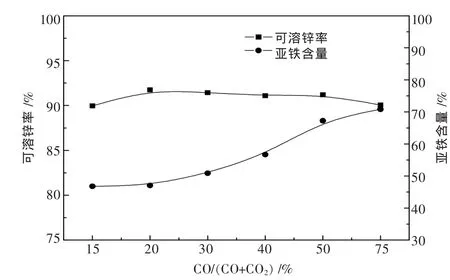
图6 CO/(CO+CO2)对可溶锌率和亚铁含量的影响
由图7可见,15 min后,可溶锌率由原焙砂中的79.64%提升为88.39%,同时亚铁含量大幅增加了31%.再经过30 min的还原,可溶锌率增大至91.78%,亚铁含量则增加了4.2%.之后可溶锌率和亚铁含量基本保持不变.这说明在选择性还原条件下可溶锌率和亚铁含量密切相关,这是因为铁酸锌的还原反应可以看作亚铁从铁酸锌中置换出锌[14],以形成磁铁矿和氧化锌,这一过程中亚铁与可溶锌同步增长,并随着亚铁还原的终止,反应最终达到平衡.亚铁含量可达到47%,高于磁铁矿的理论亚铁含量,这不仅由于锌焙砂本身含有一定量的亚铁,同时部分亚铁离子可能固溶于氧化锌中.由此可见,反应需要至少45 min的焙烧时间,选择60 min作为最优焙烧时间.
2.1.6 还原焙砂的物相组成及形貌特征
最优焙烧条件下的还原焙烧样的物相分析如图8所示,可以看出焙烧过程实现了选择性还原,没有氧化亚铁的峰出现.由于磁铁矿和铁酸锌具有相同的晶体结构,并不能在XRD中分辨出单独的衍射峰.这使得大部分铁能够保存在稳定的尖晶石结构中,在浸出据热力学计算,选择性还原反应在750℃时CO/(CO+CO2)应控制在2.6%~36.18%.15%已经超过了反应所需 CO气氛比例,20%是适宜的 CO/(CO+CO2)气氛比例,超过20%对可溶锌的效果不大,只会导致磁铁矿的还原,使亚铁含量增多.CO2在气氛中的作用是在还原反应发生的同时参与反应的逆反应,抑制磁铁矿的过还原.由此可见,CO/(CO+CO2)主要对亚铁含量影响较大,20%的CO/(CO+CO2)为最优气氛比例条件.
2.1.5 焙烧时间对焙烧效果的影响
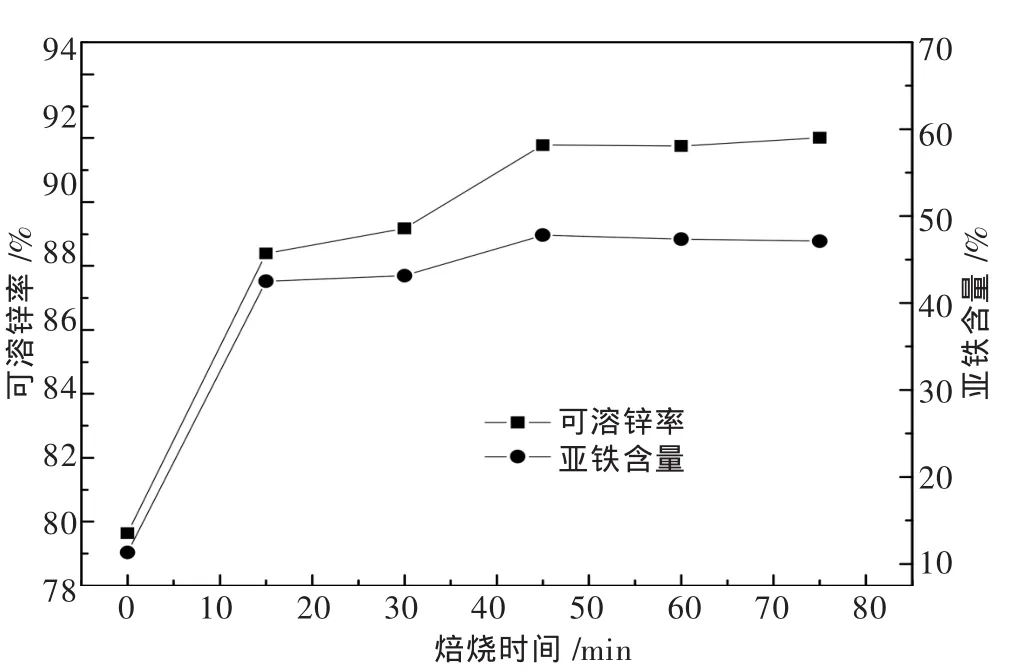
图7 焙烧时间对可溶锌率和亚铁含量的影响
在 CO/(CO+CO2)为 20%,焙烧温度为 750 ℃,CO浓度为8%的条件下,考察焙烧时间对可溶锌率和亚铁含量的影响,结果如图7所示.中不被溶出.还原焙烧样的表面形貌和能谱图如图9所示,由图9可见,还原焙砂的颗粒大小约为20μm,疏松多孔,未发生团聚烧结,这有利于焙烧及浸出过程中的传质.图9中a加号指示的位置表面致密光滑,能谱鉴定为氧化锌(ZnO);b加号指示的位置则表面粗糙不规则,能谱鉴定为锌铁氧化物(ZnxFe1-xO).可以看出锌焙砂基本被这两种形貌的表面覆盖,说明氧化锌的包裹是选择性还原反应效率有限的主要原因.还原反应生成的部分亚铁会固溶至氧化锌中[15],这使锌焙砂中亚铁含量偏高,偏离磁铁矿中亚铁含量.这部分亚铁不能替代铁酸锌中的锌以提高可溶锌率,只会使锌焙砂中亚铁含量升高,并在浸出过程随氧化锌溶解,不利于后续浸出的铁锌分离,因此需要控制焙烧条件防止过还原,使亚铁含量不超过50%.
2.2 浸出工艺实验研究
锌焙砂经过还原焙烧后,需通过选择性的硫酸浸出实现铁锌的分离.在浸出过程中发生的主要反应如下:
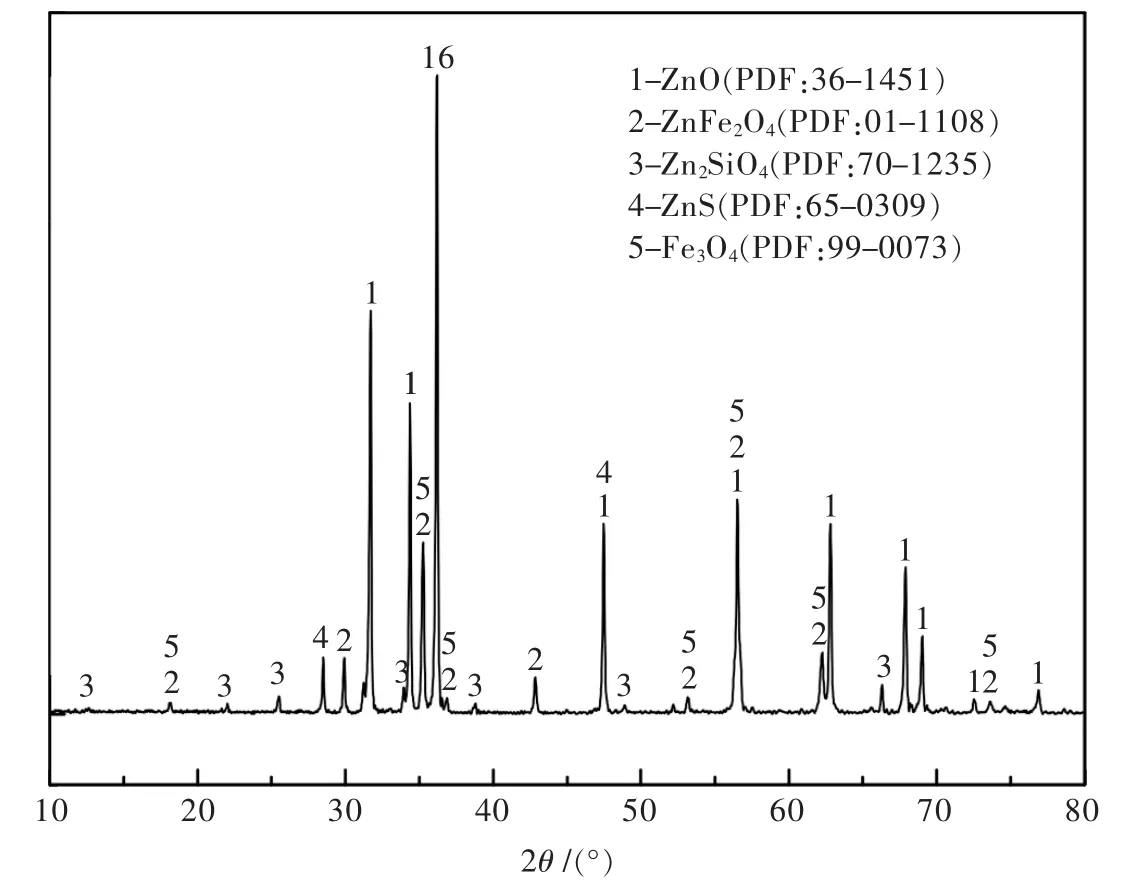
图8 还原焙砂的XRD图

图9 还原焙砂的SEM-EDS图
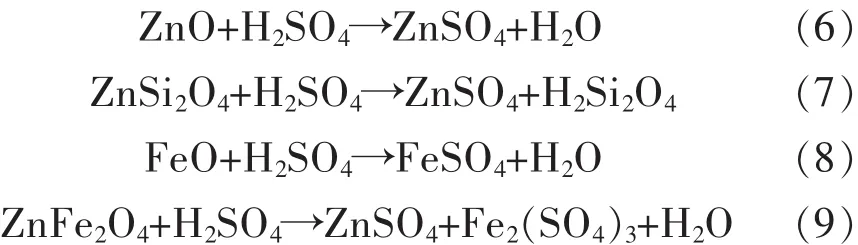
根据还原焙砂中的可溶锌含量和反应式(6)和式(7)可以计算出在10∶1的液固比条件下,反应至少需要80.05 g/L硫酸才能溶出还原焙砂中的可溶解性锌.以此为依据设计单因素实验分别研究浸出酸度、温度、液固比和浸出时间的影响.
2.2.1 浸出酸度的影响
在浸出温度为30℃,液固比为10∶1,浸出时间为30 min的条件下,考察硫酸浓度对锌铁浸出率的影响,结果如图10所示.
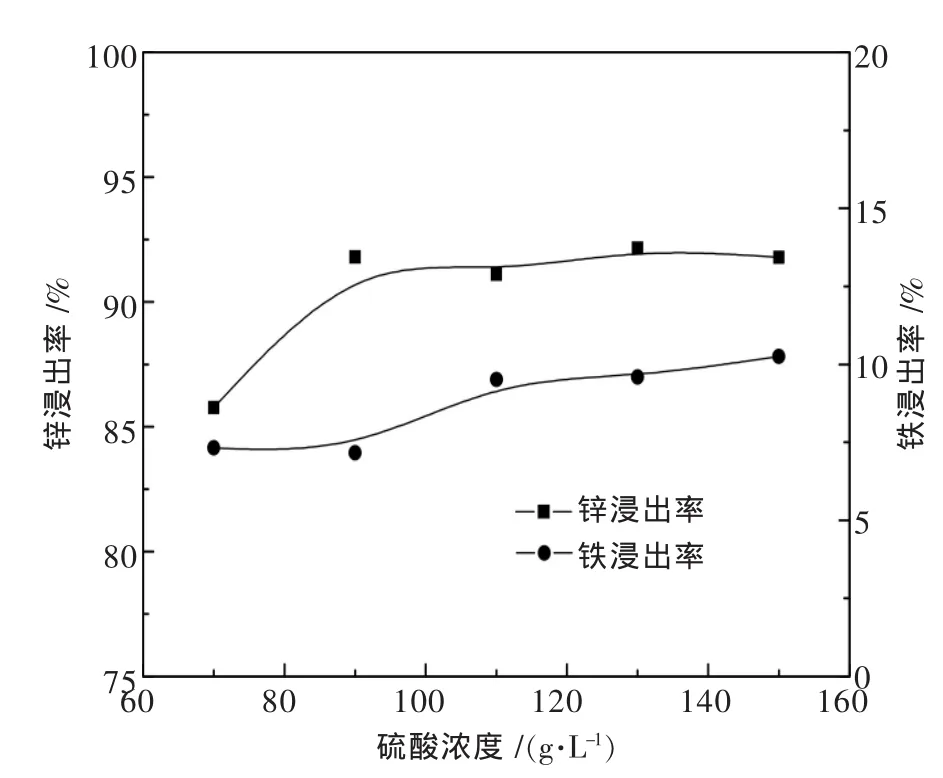
图10 浸出酸度对锌铁浸出率的影响
由图10可见,随着硫酸酸度从70g/L升高为90g/L,锌浸出率从85.76%提高为91.8%,铁的浸出率在70 g/L即达到7.32%,在90 g/L时变化不大,这种酸度条件下溶出的铁为赋存于氧化锌中的铁,并随着氧化锌的溶出而浸出到溶液中.之后随着酸度的进一步升高,锌浸出率维持不变,而铁浸出率则进一步升高至10%以上.说明有限的酸度提升不能破坏破磁铁矿和铁酸锌的结构,使锌铁进一步溶出.锌浸出而铁存留于浸出渣中,实现了铁锌的分离.90 g/L的浸出酸度略高于理论硫酸需求量,最高的锌浸出率与还原焙砂的可溶锌率基本一致,可见可溶锌率能有效评价焙烧效果.浸出7%的铁可供后续浸出液净化的需要,同时避免了复杂的沉铁工艺.由此可得,还原焙砂的硫酸浸出是选择性溶出可溶解性锌,90 g/L可作为最优的硫酸浸出条件.
2.2.2 浸出温度的影响
在浸出酸度为90 g/L,液固比为10∶1,浸出时间为30 min的条件下,考察浸出温度对锌铁浸出率的影响,结果如图11所示.
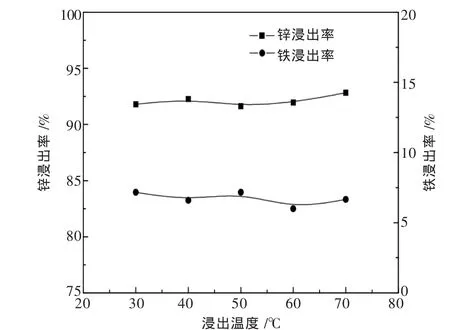
图11 浸出温度对锌铁浸出率的影响
由图11可见,随着浸出温度的升高,锌铁的浸出率基本维持不变,升高温度对锌铁浸出率的提升收效不大.这是由于锌焙砂的浸出过程是放热反应,同时在弱酸浸出的条件下,单独提升温度不能起到破坏结构,提高浸出率的作用.仅在常温条件下的浸出就能获得较高的浸出率在工业实践当中有重要意义,能够大幅节省能耗,使工艺更利于应用.由此可得,选择30℃常温作为最优浸出温度.
2.2.3 液固比的影响
在浸出酸度为90 g/L,浸出温度为30℃,浸出时间为30 min的条件下,考察液固比对锌铁浸出率的影响,结果如图12所示.
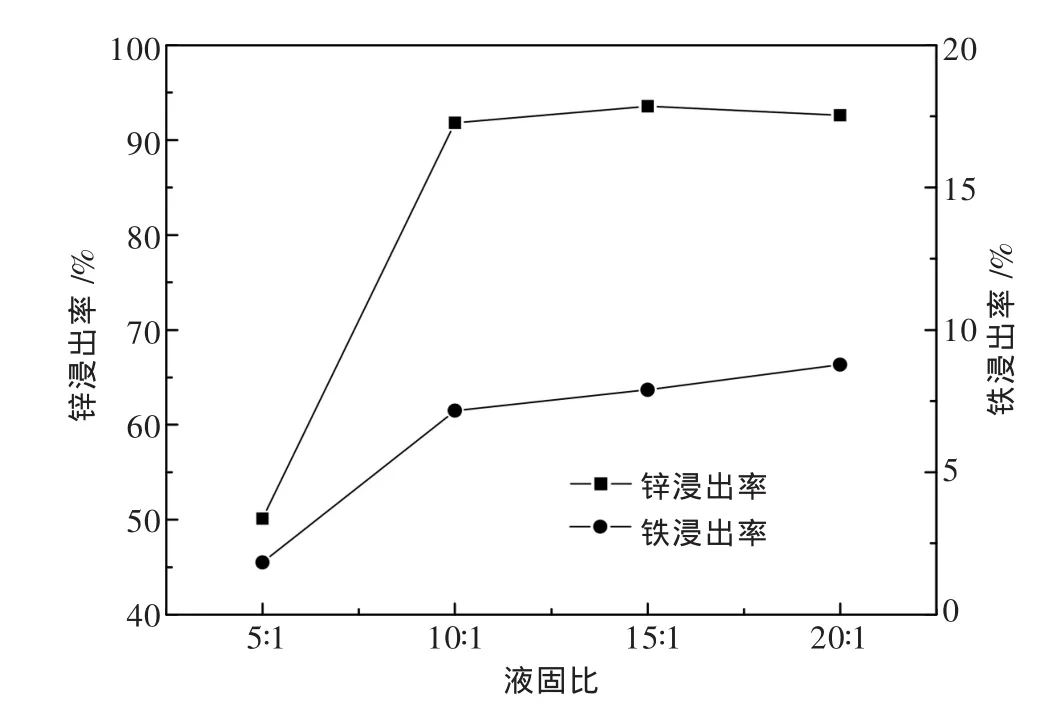
图12 液固比对锌铁浸出率的影响
由图 12 可见,液固比从 5∶1 提升为 10∶1,反应锌铁浸出率分别从50.1%和1.83%上涨为91.8%和7.17%.在液固比为5∶1的条件下,反应硫酸浓度不足,锌铁仅能部分溶出.之后随着液固比的进一步提升,锌铁浸出率的变化较小.较高的液固比意味着较高固液传质速率,同时相当于硫酸过量,但是浸出率没有实质提升,说明锌焙砂的还原反应不受传质扩散影响.由此可得,选择10∶1作为最优液固比,实践中可根据实际需要换算调整.
2.2.4 浸出时间的影响
在浸出酸度为90 g/L,浸出温度为30℃,液固比为10∶1的条件下,考察浸出时间对锌铁浸出率的影响,结果如图13所示.
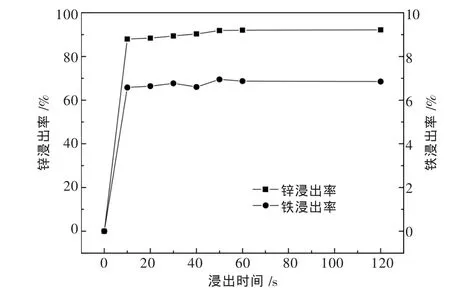
图13 浸出时间对锌铁浸出率的影响
由图13可见,锌焙砂浸出过程是一个极快的过程,在浸出10 s时铁锌的浸出率已经分别达到了87.96%和6.58%,1 min后铁锌浸出率已升高至92%和6.87%.这说明还原焙砂中可溶锌的浸出反应速率非常快,不受反应控制,基本是接触即反应的过程.较快的反应速率在实际应用中有积极意义,能大幅缩短锌浸出过程的时间,同时含有磁铁矿的浸出渣能通过外加磁场等方式快速实现浸出渣的沉降分离.因此选择30 min作为最优浸出时间条件.
2.2.5 小 结
在最优浸出条件下浸出,获得浸出液的锌铁浓度分别为52.73 g/L和0.98 g/L,终点pH值为1.5~2.5,实际工业生产中可调节液固比和初始酸度以进一步提高浸出液中锌浓度.浸出渣中含锌17.20%,含铁42.10%,锌含量较传统工艺有所降低,但仍较高.这是由于原焙砂中硫含量较高,同时氧化锌的包裹也限制了部分铁酸锌的还原.因此在实际应用当中氧化焙烧阶段应充分脱硫,同时采用球磨预处理强化还原焙烧效果,以进一步提升选择性还原效率,降低浸出渣锌含量.浸出渣可通过磁选工艺分选其中的磁铁矿,并富集其中的有价金属元素.
3 结 论
(1)焙烧工艺条件试验表明,最优焙烧条件为750℃的焙烧温度,8%的CO浓度,20%的CO/(CO+CO2)气氛比例和45~60 min的焙烧时间,在最优条件下焙烧后,锌焙砂中可溶锌从焙烧前的79.64%提高到91.75%,且亚铁含量控制在50%以内.
(2)还原焙砂的XRD分析表明,还原焙烧实现了铁酸锌选择性分解为氧化锌和磁铁矿,避免了过还原生成氧化亚铁;SEM-EDS结果表明,氧化锌的包裹是反应效率有限的重要原因.
(3)硫酸浸出考察了浸出温度、酸度、液固比和浸出时间对浸出率的影响,最优浸出条件为常温浸出、硫酸浓度90 g/L、液固比 10∶1和浸出时间 30 min,最优条件下锌铁的浸出率分别能够达到91.8%和7.17%,基本实现了锌铁分离.
[1]周廷熙,王吉坤.高铁硫化锌精矿冶炼工艺研究进展[J].中国有色冶金,2006 (1):13-17.
[2]Min X, Xie X, Chai L,et al.Environmental availability and ecological risk assessment of heavy metals in zinc leaching residue[J].Transactions of Nonferrous Metals Society of China,2013, 23(1): 208-218.
[3]刘洪萍.锌浸出渣处理工艺概述[J].云南冶金,2009,38(4):34-37.
[4]Langová Š, Leško J, Matýsek D.Selective leaching of zinc from zinc ferrite with hydrochloric acid[J].Hydrometallurgy,2009, 95(3): 179-182.
[5]张承龙,邱媛媛,黄希,等.含锌危险废物的碱法浸出研究[J].有色冶金设计与研究,2007,28(23):88-90.
[6]Vahidi E, Rashchi F, Moradkhani D.Recovery of zinc from an industrial zinc leach residue by solvent extraction using D2EHPA[J].Minerals Engineering, 2009, 22(2): 204-206.
[7]魏志聪,方建军.低品位氧化锌矿石氨浸工艺影响因素研究[J].矿冶,2011,20(4): 70-72.
[8]Zhang Y,Yu X,Li X.Zinc recovery from franklinite by sulphation roasting[J].Hydrometallurgy, 2011, 109(3): 211-214.
[9]郭晓娜,张亚莉,于先进,等.从锌浸出渣中湿法回收锌[J].湿法冶金,2012,31(1):33-36
[10]Li M,Peng B,Chai L,et al.Recovery of iron from zinc leaching residue by selective reduction roasting with carbon[J].Journal of Hazardous Materials, 2012, 238(10): 323-330
[11]Peng N,Peng B,Chai L Y, et al.Recovery of iron from zinc calcineby reduction roastingand magnetic separation[J].Minerals Engineering, 2012, 35(8): 57-60.
[12]张惠斌.矿石和工业产品化学物相分析[M].北京:冶金工业出版社, 1992:138-352.
[13]Bale CW,Bélisle E,Chartrand P, et al.FactSage thermochemical software and databases-recent developments[J].Calphad, 2009,33(2): 295-311.
[14]Tong LF.Reduction mechanismsand behaviour of zinc ferrite-Part 1: Pure ZnFe2O4[J].Mineral Processingand Extractive Metallurgy,2001, 110(1): 14-24.
[15]Jak E,Zhao B,Hayes P C.Experimental study of phase equilibria in the “FeO”-ZnO-(CaO+SiO2) system with CaO/SiO2weight ratios of 0.33, 0.93, and 1.2 in equilibrium with metallic iron[J].Metallurgical and Materials Transactions B,2002, 33 (6): 877-890.
