微波辅助提取杏鲍菇多糖及降血糖作用的研究
2014-11-09杨丽艳娄大伟
韩 波,杨丽艳,张 艳,祝 波,娄大伟*
(1.中油吉化集团公司总医院药剂科,吉林长春132021;2.中油吉林石化公司化肥厂,吉林吉林132021;3.吉林化工学院化学与制药工程学院,吉林吉林132022)
食用菌生物多糖是一种非特异性免疫增强剂和免疫激活剂,广泛用于医药和保健食品,被称为“生物应答调节剂”.食用菌多糖是从真菌子实体、菌丝体、发酵液中分离出的由10个分子以上的单糖通过糖苷键连接而成的高分子多聚物,是一类可以控制细胞分裂分化、调节细胞生长和衰老的活性多糖[1-2].杏鲍菇,又名刺芹侧耳,是近年来开发栽培成功的集食用、药用、食疗于一体的珍稀食用菌新品种.杏鲍菇多糖是杏鲍菇水提物中一种活性成分,具有抗肿瘤、抗氧化、抗损伤、抗疲劳、调节免疫以及抑菌等作用[3-7].
微波是指频率为300 MHz~300 kMHz,波长在1 m~1 mm之间的电磁波.通过微波来实现提取的方法称为微波提取法.其原理是微波射线辐射于溶剂并透过细胞壁到达细胞内部,由于溶剂及细胞液吸收微波能,细胞内部温度升高,压力增大,当压力超过细胞壁的承受能力时,细胞壁破裂,位于细胞内部的有效成分从细胞中释放出来,传递转移到溶剂周围被溶剂溶解[8].本研究以杏鲍菇为实验材料,采用正交实验设计,优化杏鲍菇多糖微波辅助提取的最佳工艺条件,并观察其降血糖作用,为进一步开发和利用杏鲍菇资源提供实验依据.
1 试剂与仪器
杏鲍菇,市售;无水乙醇、苯酚、硫酸均为国产分析纯;葡萄糖,标准品购自中国(长春)药品生物制品检定所;生理盐水,吉林康乃尔药业有限公司批号20130910;肾上腺素,黑龙江肇东华富药业有限责任公司批号20120928,用前用生理盐水配成0.1%的溶液;格列本脲,郑州荔诺生物科技发展有限公司批号20090314,用前用0.5%CMC配成2.5%的溶液.
RE-52A旋转蒸发器(上海亚荣生化仪器厂);725型紫外光栅分光光度计(山东高密彩虹分析仪器有限公司);LDZ-5-2低速自动平衡离心机(北京医用离心机厂);FA-2004分析天平(上海精细科技仪器厂);血糖仪和血糖试纸长沙三诺传感生物技术有限公司.
2 实验方法
2.1 标准曲线的制备
按照文献方法,绘制标准曲线.精密吸取葡萄糖储备液3,4,5,6,7 mL 分别置50 mL 量瓶中,加蒸馏水定容,摇匀.分别吸取上述溶液0.5 mL(每0.5 mL含糖30~70μg),置于10 mL具塞试管中,加入50 mL·L-1苯酚溶液 1 mL,迅速加入3 mL浓硫酸,迅速摇匀,于40℃水浴放置30 min后,自然冷却15 min,在490 nm波长处测定吸光度,以吸光度为横坐标、对照品质量浓度为纵坐标,绘制标准曲线,得到回归方程:Y=5.97X-0.093 8,相关系数 r=0.999 9.
2.2 单因素实验
考察微波温度、提取时间、微波功率3个因素对杏鲍菇多糖提取率的影响,按标准曲线方法计算多糖含量,选择最佳单因素提取条件.每次准确称取杏鲍菇干粉2.0 g,分别对微波温度(40,50,60,70 和80 ℃),提取时间(4,6,8,10 和12 min),微波功率(400,500,600,700 和 800 w),三个因素进行实验.单因素实验的条件为微波温度70℃、提取时间10 min、微波功率600 w.
2.3 正交实验
以微波温度、提取时间、微波功率作为考察因素,多糖提取率为考察指标,进行正交实验,因素与水平见表1,实验方法与单因素实验方法相似,每号实验重复3次,计算提取率、K值、k值和R值,并进行方差分析.
2.4 对肾上腺素所致高血糖小鼠的影响
取60只小鼠,按体重随机分为空白组、模型组、格列本脲组、杏鲍菇多糖低、中、高剂量组.模型组及空白组给予蒸馏水,格列本脲组给予2.5%的格列本脲,杏鲍菇多糖低、中、高组分别给予3%、6%、12%的多糖溶液.以上各组均灌胃给药,20 mg·kg-1,每天 1 次,连续 7 d.
末次给药前禁食不禁水12 h,以血糖试纸测定各组动物空腹血糖值作为药前值,给药30 min后,除空白组外其它各组均皮下注射0.1%肾上腺素0.25 mg·kg-1,以血糖试纸测定注射 0.1%肾上腺素后各组小鼠30 min、60 min、90 min的血糖值.
2.5 糖耐量实验
取60只昆明小鼠,雌雄各半,按体重随机分6组,即空白组、模型组、格列本脲组、杏鲍菇多糖低、中、高剂量组.模型组及空白组给予蒸馏水,格列本脲组给予2.5%的格列本脲,杏鲍菇多糖低、中、高组分别给予3%、6%、12%的多糖溶液.以上各组均灌胃给药,20 mL·kg-1,每天1次,连续10 d,末次给药前禁食不禁水12 h,以血糖试纸测定各组动物空腹血糖值作为药前值,然后给药.末次药后60 min,除正常对照组外其他各组经腹腔注射葡萄糖 2 g·kg-1,测定 30、60、90 min 的血糖值,观察各组药物作用.
3 结果与讨论
3.1 单因素实验
微波温度为70℃时,多糖的提取率最大,此后微波温度升高,提取率减少;微波功率为700 W时,提取率最大,以后提取率下降,可能由于功率过大会引起糖结构改变,多糖含量降低;杏鲍菇多糖提取率随着提取时间的增大呈现先增大后减小,超声时间10 min时多糖提取率最大,可能由提取时间小于10 min时,多糖类物质还未充分溶出;提取时间大于10 min时,引起糖结构变化甚至是碳环裂解或一些其他的成分溶出而使多糖类化合物提取率降低.

图1 微波温度对多糖含量的影响

图2 微波功率对多糖含量的影响
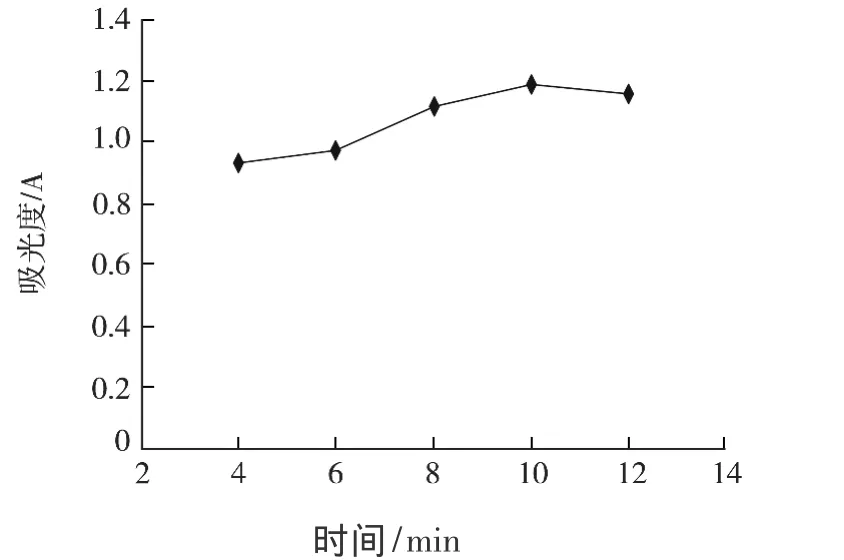
图3 提取时间对多糖含量的影响
3.2 正交实验
根据单因素实验结果,选择考察因素的3个实验水平,实验因素与水平见表1,实验结果见表2,采用直观分析法比较K值可知,影响较为显著的因素平分别为:A3、B3、C2.由极差 R值可知,A因素的R值最大,因此,A因素为影响杏鲍菇多糖提取率的主要因素,这3个因素对多糖提取率影响的主次顺序为A>B>C,即微波时间>微波功率>提取时间.由直观分析法可得杏鲍菇多糖的最佳的提取工艺为:A3B3C2,即微波温度80℃、微波功率800 W、提取时间10 min.

表1 因素水平表

表3 方差分析表
方差分析结果见表3,由计算的F值与查表临界值比较可判断,A因素对杏鲍菇多糖提取率影响非常显著P<0.01,B和D因素对杏鲍菇多糖提取率影响不显著P>0.05,影响的主次顺序为A>B>C,与直观分析法所得结果基本一致.
因B因素影响不显著,所以从降低生产成本角度考虑应选B2水平,即700 W.综上,最佳工艺条件为A3B2C2,即微波温度80℃、微波功率700 W、提取时间10 min.为了验证实验结果的可靠性,选取微波温度80℃、微波功率700 W、提取时间10 min,进行三组平行实验,计算提取液中多糖的含量,3次平行实验得到实际平均总提取率为12.83%,RSD%为 0.19.
3.3 对肾上腺素所致高血糖小鼠的影响
如表4所示.与空白组比较,模型组30 min,60 min,90 min血糖值均有所升高,P <0.05,说明高血糖模型造模成功;与模型组比较,杏鲍菇多糖中剂量组90 min,高剂量组60 min、90 min血糖值均有所降低,P <0.05.
表4 杏鲍菇多糖对肾上腺素所致高血糖的影响(mmol·L-1)(±S,n=10)

表4 杏鲍菇多糖对肾上腺素所致高血糖的影响(mmol·L-1)(±S,n=10)
**P <0.01 vs Normal;#P <0.05 vs Model
5.19 ±0.22 Model 5.25 ±1.03 16.86 ±3.09** 14.03 ±3.93** 12.08 ±2.21**低剂量组 5.21 ±0.55 17.58 ±2.15 14.60 ±3.29 12.26 ±1.21中剂量组 5.34 ±0.95 17.05 ±3.01 13.89 ±3.87 10.91 ±1.76#高剂量组 5.22 ±0.99 16.93 ±1.96 12.84 ±2.07# 10.69 ±2.69#Glibenclamide 5.19 ±0.67 16.99 ±1.97 9.97 ±1.78# 9.74 ±2.10 90 min Normal 5.21 ±0.23 5.26 ±0.11 5.24 ±0.45 Group 药前值 30 min 60 min#
3.4 糖耐量实验
与空白对照组比较,模型组小鼠注射葡萄糖后30~120 min血糖均明显升高,有显著性差异(P<0.01).与模型组比较,格列本脲组注射葡萄糖后60、90 min血糖值明显下降(P<0.05或P<0.01);杏鲍菇多糖低剂量组注射葡萄糖后120 min,中、高剂量组注射葡萄糖后 60 min、120 min血糖值均明显下降(P<0.05或 P<0.01),提示杏鲍菇多糖可明显对抗葡萄糖所致的高血糖,见表5.
表5 杏鲍菇多糖对葡萄糖所致高血糖的影响±s,n=10)

表5 杏鲍菇多糖对葡萄糖所致高血糖的影响±s,n=10)
#P <0.05 vs Normal;*P <0.05,**P <0.01 vs Model
5.63 ±0.91 Model 5.65 ±1.16 14.22 ±0.99# 11.56 ±2.76# 10.71 ±1.75#低剂量组 5.79 ±1.12 12.81 ±1.16 10.15 ±2.11 6.32 ±1.58*中剂量组 5.78 ±1.09 11.92 ±1.67 8.24 ±1.33* 5.56 ±1.12**高剂量组 5.65 ±0.98 11.67 ±1.70 8.18 ±1.01* 5.27 ±0.92**Glibenclamide 5.71 ±1.19 11.48 ±2.01* 8.02 ±0.95* 5.01 ±1.72 120 min Normal 5.76 ±0.69 5.69 ±0.44 5.64 ±0.32 Group FBG/(mmol·L-1)0 min 30 min 60 min**
4 结 论
采用F临界值对实验结果进行方差分析时,根据数理统计方法[9-10]和张艳等[11]文献报道,误差自由度=实验号数×(每号实验次数-1),本正交设计共9号实验,每号实验做3次,因此,误差自由度=9×(3-1)=18,每一因素的自由度=水平数-1=3-1=2.查F分布临界值表,F0.05(2,18)=3.55,F0.01(2,18)=6.01,FA > F0.01(2,18)=6.01,P < 0.01,FB 和 FC < F0.05(2,18)=3.55,P >0.05.A 因素对杏鲍菇多糖提取率影响非常显著,P<0.01,B和C因素对杏鲍菇多糖提取率影响不显著P>0.05,与直观分析法得到的影响顺序基本一致.
血糖升高是糖尿病最基本临床表现之一,糖尿病患者长期高血糖环境是糖尿病并发症形成的关键因素.肾上腺素是强有力的升高血糖的激素,给动物注射0.1%肾上腺素后血糖水平迅速升高,可持续数几小时.肾上腺素与肝脏和肌肉的细胞膜的β受体结合,通过G蛋白激活腺苷酸环化酶、增高细胞内cAMP浓度,抑制糖原合酶,从而加速糖原分解、抑制糖原合成[12-13].本文研究杏鲍菇对肾上腺素所致高血糖的影响,实验结果显示杏鲍菇多糖对0.1%肾上腺素所致高血糖有明显的对抗作用,于药后60 min开始起效持续到90 min.
葡萄糖作为最常用的刺激物在了解胰岛β细胞功能、平菇机体调节血糖能力中广泛应用.葡萄糖耐量实验可反应β细胞能否及时并且最大量释放胰岛素来缓冲外来葡萄糖负荷的能力[14],因此可用l来评价β细胞释放胰岛素的能力.本文糖耐量实验表明杏鲍菇多糖对葡萄糖所致高血糖有明显的对抗作用,于药后60 min开始起效持续到120 min.
[1] 孙靖轩,王延锋,王金贺,等.食用菌多糖提取技术研究概况[J].中国食用菌,2012,31(3):6-9.
[2] 孟庆虹,张守文.真菌多糖的研究进展[J].食品科技,2003(3):42-43.
[3] 盛伟,方晓阳,吴萍.白灵菇、杏鲍菇、阿魏菇多糖外抗氧化活性研究[J].食品工业科技,2008,29(5):103-109.
[4] 史亚丽,杨立红,蔡德华,等.杏鲍菇多糖对力竭小鼠抗氧化、抗损伤的作用[J].体育学刊,2005,12(1):56-58.
[5] 张丽,彭小列,张建锋,等.杏鲍菇多糖的提取及其抑菌作用[J].贵州农业科学,2010,38(9):90-92.
[6] 郑素玲,郭立英,范永山.杏鲍菇多糖对老龄小鼠抗疲劳能力的影响[J].食品科学,2010,31(7):269-271.
[7] 迟桂荣,徐琳,吴继卫,等.杏鲍菇多糖的抗病毒、抗肿瘤研究[J].莱阳农学院学报:自然科学版,2006,23(3):174-176.
[8] 张海容,韩伟珍.微波法与传统热水法提取香菇多糖的比较研究[J].食品研究与开发,2005,26(5):68-70.
[9] 徐勇勇.医学统计学[M].2版.北京:高等教育出版社,2003:162-182.
[10]张春华,周永昌,刘延福.数理统计方法[M].山东:山东大学出版社,1995:151-18
[11]张艳,刘杰,周静姝,等.超声波加酶法提取玉米须黄酮的工艺研究[J].西北药学杂志,2012,27(2):98-100.
[12]石鹤峰,刘霖.中医治疗糖尿病进展[J].中国中医药信息杂志,1998,8(4):75-77.
[13]张艳,李永哲,周鸿立,等.玉米须多糖对肾上腺素所致高血糖小鼠的影响[J].吉林化工学院学报,2011,28(7):27-29.
[14]张惠芬,迟家敏,王瑞萍.实用糖尿病学[M].2版,北京:人民卫生出版社,2004,152-164.
