过表达NADH激酶基因对酿酒酵母乙醇发酵的影响
2014-10-31王寒张梁石贵阳
王寒,张梁,石贵阳
江南大学 粮食发酵工艺与技术国家工程实验室 工业生物技术教育部重点实验室,江苏 无锡 214122
20世纪80年代,由于石油的禁运和缺乏,全球燃料危机在很多国家引起了极大的关注。而人们更为关心的是寻找一种可替代的燃料资源,乙醇首当其冲被列入其中[1]。乙醇作为可再生资源有诸多优势,能减少温室气体的排放,减少有毒废气的释放,提高全球能源效率,减少燃料成本等[2]。因此,清洁燃料乙醇的生产成为各国研究的热点。
甘油是乙醇生产过程中的主要副产物,在厌氧条件下大约 4%的碳源会流向生成甘油的代谢支路。而这些碳源在不增加成本的情况下每年将会多产生1.25亿L的乙醇[3]。因此,为了提高乙醇的产量,阻断或者削弱甘油的代谢通路是非常必要的。甘油在酿酒酵母细胞中起着调节胞内氧化还原平衡的作用,厌氧条件下有机酸和生物量生成过程产生的NADH只能通过甘油形成途径来氧化,甘油的合成是胞内NAD+再生的主要途径[4]。甘油的生成经过两步反应,第一步反应是甘油合成的限速步骤[5],磷酸二羟基丙酮在由GPD1和GPD2编码的3-磷酸甘油脱氢酶的作用下还原为 3-磷酸甘油,随后在 GPP1和 GPP2基因编码的 3-磷酸酯酶的作用下,脱去磷酸生成甘油[6]。
为维持细胞内的氧化还原平衡,生物合成反应中产生的过量的 NADH必须被氧化成NAD+,以维持一定的比例。酿酒酵母含有3种NADH激酶基因,分别是UTR1、YEF1和POS5。Pos5p定位于线粒体基质,将 NADH转化为NADPH,是线粒体 NADPH 的主要来源[7]。Strand等[8]通过对 Pos5p氨基末端分析,其前17个氨基酸为线粒体定位信号肽。NADH激酶在维持线粒体DNA的稳定性和氧化胁迫反应方面有很重要的作用[9]。Bro等[10]根据酿酒酵母代谢网络模型,预测了NADH激酶的表达可以使酿酒酵母乙醇产量提高,甘油产量降低。Hou等[11]在细胞质中超表达NADH激酶基因,明显改变了代谢流向,使代谢流从 CO2转向乙醇,提高了乙醇的产量,但同时却积累了木糖醇。故而,如何降低甘油的产量,同时又能将胞内过量的NADH氧化成NAD+,是对甘油途径改造的有效方案之一。
本文旨在对酿酒酵母敲除 GPD2的同时加强POS5基因的表达,以期达到降低甘油产量从而提高乙醇产量的目的。本实验通过去除POS5基因前17个氨基酸,使其在细胞质中过表达,从而改善由于 GPD2敲除引起的胞内氧化还原的失衡问题。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
工业酒精酵母单倍体菌株 S1 (MATa, 野生型,由工业酒精酵母CICIMY0086分离得到),S2 (MATa, gpd2Δ::HyBR)由本实验室前期构建[10],E. coli JM109 (recA1 supE44 endA1 hsdR17 gyrA96 relA1 thi (Lac-proAB)F'[traD36 proAB+lac1qlacZM15]),pMD18T-Simple (TaKaRa),质粒 pMGKR和 pSH47-HyBR为实验室前期构建[12],其他菌株和质粒均为本实验构建。
1.1.2 培养基
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,蒸馏水定容至1 L。固体培养基添加2%琼脂粉,用于大肠杆菌的培养,培养温度为37 ℃。
氨苄青霉素的工作浓度为100 μg/mL。
YEPD培养基:蛋白胨20 g,酵母膏10 g,葡萄糖20 g,蒸馏水定容至1 L。固体培养基添加2%琼脂粉,用于工业酒精酵母的培养,培养温度30 ℃。潮霉素B的工作浓度为200 μg/mL,300 μg/mL。
基础发酵培养基:葡萄糖150 g,(NH4)2SO47.5 g,KH2PO43.5 g,MgSO4·7H2O 0.75 g,酵母膏0.5 g,蒸馏水定容到1 L。开始发酵时加入过滤除菌后的消泡剂300 μL,吐温–80 420 mg,麦角甾醇10 mg。
1.2 引物
实验用引物合成订自上海生工生物工程有限公司。引物序列见表1。
1.3 方法
1.3.1 常规分子生物学操作
大肠杆菌感受态制备,质粒的提取、酶切、纯化,载体与DNA片段的连接,酵母基因组提取等方法参见分子克隆实验指南。
1.3.2 敲除 GPD2的同时整合表达 POS5质粒的构建
根据GenBank已知的序列,以工业酒精酵母染色体为模板,以G1F、G1R、G2F、G2R、POS5F、POS5R为引物,PCR分别扩增出GPD2基因两端的同源臂 450 bp、383 bp以及 POS5基因片段;以质粒pMGKR为模板,以PGK1F和PGK1R为引物,扩增得到PGK1P-PGK1T启动子和终止子;以质粒 pSH47-HyBR为模板,以HyrF和HyrR为引物,扩增得到HyBR抗性片段。利用重叠延伸PCR技术将GPD2两段同源臂拼接,并与 pMD18T-Simple连接,转化E. coli JM109,验证得到阳性转化子并提取质粒pMD-Δgpd2,经Hind /ⅢSacⅠ双酶切线性化,与经同样酶切的PGK1P-PGK1T片段连接得到质粒 pMD-Δgpd2-PGK1用 KpnⅠ/SacⅠ酶切,继而与经相同酶切的 HyBR抗性片段连接得到质粒 pDGPH。pDGPH质粒经 BamHⅠ/SalⅠ酶切与径同样酶切的POS5片段连接,最终得到重组质粒pDGPH-POS5。

表1 引物序列表Table 1 Primers sequence table
1.3.3 重组质粒pDGPH-POS5的转化
重组质粒pDGPH-POS5经NotⅠ和Nhe Ⅰ双酶切,得到4.5 kb左右含有GPD2上下游基因同源臂的敲除突变盒 gpd2Δ::PGK1PT-POS5-HyBR。利用醋酸锂转化法[13-14]将突变盒转入工业酒精酵母单倍体菌株S1 (MATa),涂布pH 8.5,潮霉素B浓度为200 μg/mL的YEPD抗性平板培养2−3 d,挑选转化子。将转化子点种到潮霉素B浓度300 μg/mL的YEPD平板上,排除假阳性转化子后,PCR验证。
1.3.4 NADH激酶酶活的测定方法
NADH激酶酶活测定方法按参考文献[15]进行。酶活定义1 IU为30 ℃ 1.0 mL 反应液1 min 内产生 1.0 μmol NADPH 的量[15]。
粗酶液中的蛋白含量用Bradford方法[16]测定,以BSA作为标准。
1.3.5 胞内NADH含量的测定方法
样品处理:取发酵液30 mL放置于液氮中60 s以达到快速冷却并阻断细胞的进一步代谢。为了提取NADH和NAD+,菌体真空冷冻干燥 24 h,在 50 mmol/L KOH、30%乙醇和22 mmol/L硼砂中解冻。提取的样品用3 mol/L HCl调 pH 至 9.0−9.4,放置在冰上 30 min。10 000 r/min离心 10 min,去除上清液,置于–70 ℃保存备用[17]。
分析时取出菌体,加入 4 ℃预冷的细胞破碎液 (50 mmol/L PBS),超声波处理10 min,4 ℃离心,上清液经0.45 μm膜过滤。
HPLC条件:色谱柱column stable-C18反相柱(250 mm×4.6 mm),流动相A:100% 100 mmol/L PBS (pH 7.0);流动相B:50% 100 mmol/L PBS(pH 7.0),50%甲醇。流速1 mL/min,柱温35 ℃,紫外检测器,检测波长254 nm,340 nm[18]。
其中,NAD+和NADP+在254 nm处有吸收峰,而NADH和NADPH在254 nm和340 nm处均有吸收峰,其中还原态辅酶 NADH和NADPH以340 nm处吸收峰积分。
1.3.6 乙醇发酵工艺
分别挑取原始菌株和重组菌株的单菌落接种到20 mL YEPD培养基中,培养24 h;以10%接种量转接到50 mL YEPD培养基中,培养12 h后OD达到10.0左右。以5%接种量将种子液接种到基础发酵培养基中,控制初始OD值在0.5左右。30 ℃恒温静置发酵。发酵过程中每隔4 h取样一次,测定相关的发酵性能参数。
1.3.7 发酵产物的检测
发酵液中葡萄糖、乙醇、甘油、乙酸和丙酮酸含量用HPLC检测。
HPLC条件:色谱柱Shodex SH1011,流动相0.01 mol/L H2SO4,流速0.8 mL/min,柱温50 ℃,示差折光检测器Shodex RI10。
菌体得率:取30 mL样品,6 000 r/min离心10 min收集菌体,用无菌的生理盐水洗涤菌体 2−3次,再次收集菌体,弃上清后将菌体置于105 ℃下烘至恒重后称重,计算菌体得率。
2 结果与分析
2.1 敲除GPD2的同时整合表达POS5质粒的构建
重组质粒 pMD-Δgpd2、pMD-Δgpd2-PGK1、pDGPH、pDGPH-POS5的酶切验证如图1所示。
2.2 重组菌 S3 (gpd2Δ::PGK1PT-POS5-HyBR)的验证
将含有 GPD2上下游基因同源臂的敲除突变盒 gpd2Δ::PGK1PT-POS5-HyBR (约 4.5 kb,如图2所示)转入原始菌S1中,在pH 8.5、潮霉素B浓度为200 μg/mL的YEPD抗性平板上筛选阳性转化子。
阳性转化子经PCR扩增验证,提取相应酵母染色体作为模板,以G1F和G2R为引物,如果PCR扩增得不到GPD2基因,证明重组菌的GPD2基因已经敲除,以原始菌作为阴性对照,原始菌可扩增得到1 323 bp大小的GPD2基因;以 HyrF和 HyrR为引物,重组菌可扩增得到1 335 bp大小的HyBR抗性片段,原始菌扩增得不到HyBR片段;以PGK1F和POS5R、POS5F和PGK1R分别作为两对引物,可扩增得到片段PGK1P-POS5和POS5-PGK1T,证明POS5基因已经整合到重组菌的染色体上。PCR验证结果如图3所示。

图1 不同质粒酶切的验证Fig. 1 Verification of the different plasimids digested by corresponding enzymes. M: 1 kb marker;2: pMD-Δgpd2 digested with NotⅠ and NheⅠ;3: pMD-Δgpd2 digested with Hind Ⅲ; 4: pDGPH digested with Hind Ⅲ, KpnⅠ and SacⅠ;5: pDGPH-POS5 digested with BamH Ⅰ and SalⅠ.
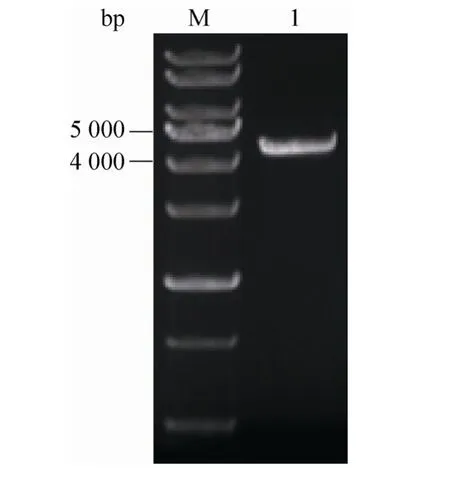
图2 敲除突变盒的验证Fig. 2 Verification of the cassette of gene deletion. M:1 kb marker; 1: a cassette gpd2Δ::PGK1PT-POS5-HyBR.

图3 重组菌S3 PCR验证Fig. 3 Verification of recombinant strain S3 PCR amplification. M: 1 kb marker; 1: the PCR product of GPD2 amplified from S3 with primers G1F and G2R; 2:negative control of GPD2 from S1; 3: the PCR product of HyBR amplified from S3 with primers HyrF and HyrR; 4: negative control of HyBR from S1; 5: the PCR product of PGK1P-POS5 amplified from S3 with primers PGK1F and POS5R; 6: the PCR product of POS5-PGK1T amplified from S3 with primers POS5F and PGK1R.
2.3 NADH激酶酶活的测定
按方法1.3.4所述对重组菌和原始菌株进行NADH激酶酶活的测定。
由表2可知,重组菌S3胞内的NADH激酶的酶活明显高于原始菌S1和突变菌S2,证明了NADH激酶基因 POS5在重组菌中得到了过量表达。
2.4 重组菌胞内NADH含量的测定
发酵12 h后取样,测定重组菌S3、S2和原始菌S1胞内的NADH浓度。
由表3可知,NADH激酶基因 POS5的超表达调节了重组菌S3胞内的NADH浓度,略高于原始菌S1的胞内NADH浓度,但却大大低于重组菌S2的NADH浓度。重组菌S2由于敲除了甘油合成途径的关键酶基因GPD2,使得甘油合成减少,导致胞内NADH浓度大量提高,而重组菌在敲除 GPD2的同时过表达了 POS5基因,不仅降低甘油产量,同时缓解了胞内NADH的高浓度。

表2 NADH激酶酶活比较Table 2 Enzyme assay of NADH kinase

表3 胞内NADH浓度比较Table 3 Intracellular NADH concentration
2.5 重组菌发酵性能研究
在 15%葡萄糖浓度的基础发酵培养基中,比较重组菌S3和S2与原始菌株S1的发酵性能的差异。
发酵过程中菌体生长曲线如图4A所示,重组菌 S3 (MATa, gpd2Δ::PGK1PT-POS5-HyBR)、S2 (MATa, gpd2Δ::HyBR)的生长速率均低于原始菌S1 (MATa),但S3的生长速率要快于S2,说明在GPD2基因缺失的情况下,NADH激酶的表达加快了菌体的生长速率。甘油途径的阻断不仅影响了菌体的生长速率,而且也影响了酵母的发酵性能。从图4B、4C看出,S3和S2的耗糖能力和初始产乙醇能力明显低于 S1。重组菌 S3和 S2的乙醇产量分别为 68.04 g/L和65.43 g/L,均高于原始菌 S1的 63.01 g/L,S3和S2的乙醇得率 (g ethanol/g glucose)分别提高了8%和3.86%。从图4D看出,重组菌S3和S2的甘油产量分别为4.29 g/L和5.10 g/L,分别低于原始菌的 6.47 g/L,S3和 S2的甘油得率(g glycerol/g glucose)分别降低了33.64%和21.11%。
由表 4可以证明在酿酒酵母中敲除 GPD2同时表达过量 POS5基因提高乙醇产量的策略是可行的。NADH激酶基因 POS5的表达,以ATP为磷酸供体,催化NADH生成 NADPH,通过降低甘油的产量使得乙醇的产量提高,证明了辅酶基因的表达会在一定程度上影响酵母的代谢过程,与前期的报道相符[19]。重组菌S2的乙酸和丙酮酸含量明显低于 S1,可能是由于酿酒酵母调整代谢途径来应对甘油产量降低的一种机制[4]。而重组菌S3的最大比生长速率、菌体得率以及副产物含量与原始菌株差异不大,证明整合表达POS5达到了预期的效果。
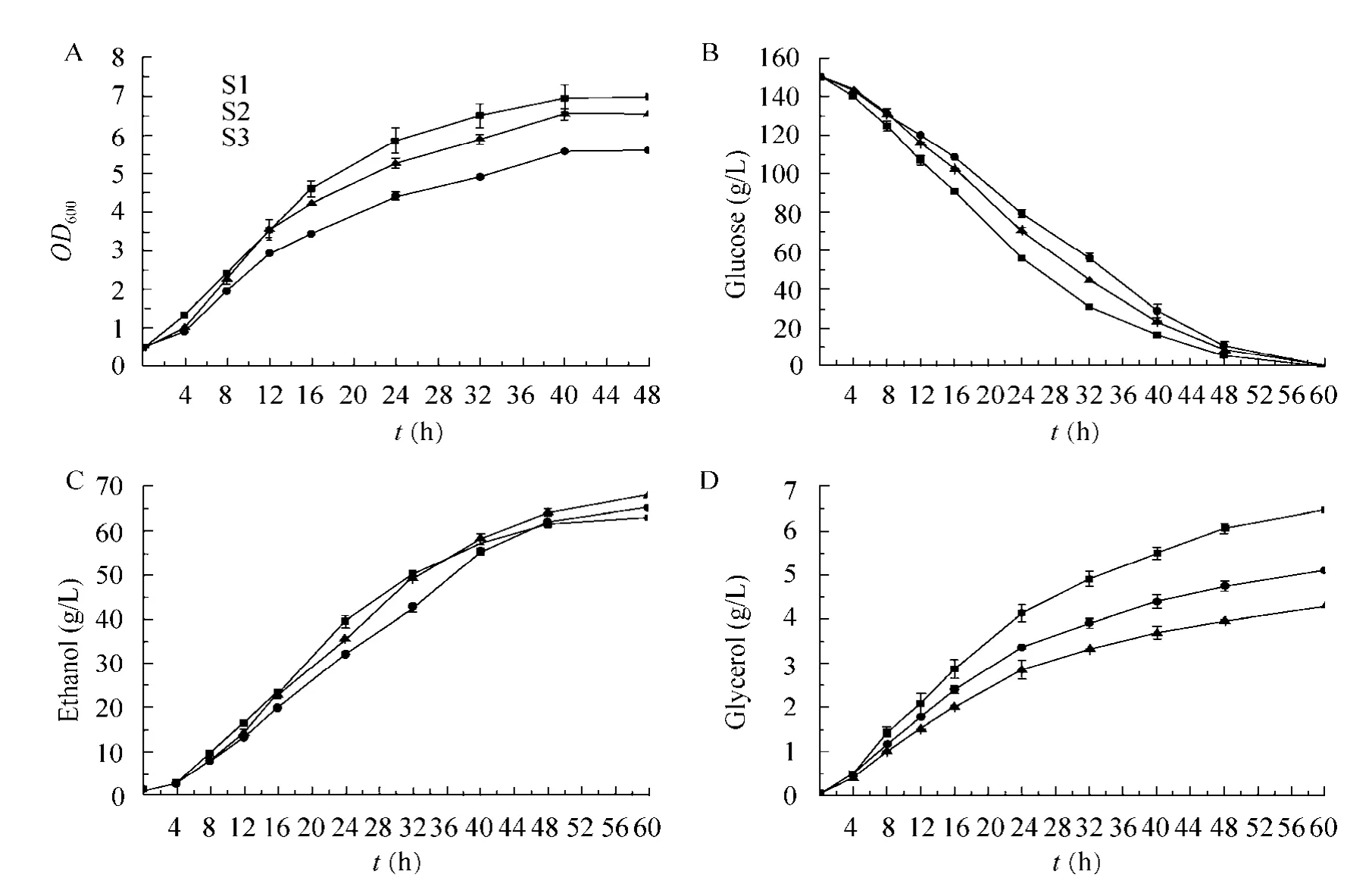
图4 重组菌S3、S2与原始菌S1的发酵性能比较Fig. 4 The performance of strains S3, S2 and S1 in ethanol fermentation. (A)OD600, optical density at 600 nm versus time. (B)the concentration of glucose versus time. (C)the concentration of ethanol versus time. (D)the concentration of glycerol versus time.

表4 重组菌S3、S2与S1在15%葡萄糖浓度的基础发酵培养基上的乙醇发酵情况Table 4 The performance of strains S3, S2 and S1 in ethanol fermentation on 15% glucose
3 讨论
甘油在酿酒酵母代谢过程中有着不可比拟的重要作用,甘油的合成不仅能调节细胞渗透压,而且厌氧条件下还用于维持胞内的氧化还原平衡[20]。甘油途径的阻断对乙醇的产量有一定程度的提高,然而单纯地阻断或者削弱甘油途径,并不能达到理想的结果[21]。因此,本实验设计了一种整合型质粒,在敲除 GPD2基因的基础上整合表达了 POS5基因,从而达到GPD2敲除能削弱甘油的合成,同时POS5的过量表达能调节胞内氧化还原平衡的效果,最终使得重组菌在不影响菌株生理特性的前提下降低甘油产量,在一定程度上提高乙醇的产量。结果表明,敲除突变盒 gpd2Δ::PGK1PT-POS5-HyBR的转入,使得工业酒精酵母在不影响最大比生长速率的前提下,乙醇得率提高了8%,甘油得率降低了33.64%。同时也调节了胞内的氧化还原平衡。
在酿酒酵母生成乙醇的代谢途径中,甘油是最主要的副产物,甘油途径包括甘油合成途径和甘油分解途径,而这两个途径的改变对乙醇的产量可能都会产生影响。因此,从甘油途径对酿酒酵母进行基因改造,一方面包括阻断或削弱甘油合成途径,另一方面包括加强甘油分解途径 (二羟丙酮途径)。甘油合成途径的关键酶基因是GPD2,本实验已经敲除了GPD2,达到了比较理想的效果。而甘油分解途径中存在两个关键酶,由 GCY1编码的甘油脱氢酶和由 DAK1编码的二羟丙酮激酶,这条途径用于转化甘油,来调节细胞的渗透压[22]。Yu等[23-24]以甘油为碳源,在酿酒酵母中同时过表达GCY1和 DAK1基因,得到的重组菌乙醇产量是野生菌株的2.4倍,证明了通过加强甘油分解途径来提高乙醇产量的策略是可行的。唐燕[25]以葡萄糖为碳源,在工业酒精酵母中,整合表达GCY1和 DAK1基因,重组菌比野生型酵母酒精得率提高了 2.9%,甘油产率降低了 24.9%。后期的实验可以将酿酒酵母的甘油合成和甘油分解途径相结合,同时选取最佳的辅酶代谢途径,即在敲除甘油合成关键酶基因 GPD2的基础上,加强表达甘油分解关键酶基因GCY1和DAK1,从而尽量减少甘油的生成量,同时在细胞质中过表达辅酶基因 POS5,使胞内的 NADH含量维持在合理的水平,最终使得乙醇的产量进一步提高。
[1]Hansen AC, Zhang Q, Lyne PW. Ethanol-diesel fuel blends-a review. Bioresour Technol, 2005,96(3): 277–285.
[2]Surisetty VR, Dalai AK, Kozinski J. Alcohols as alternative fuels: an overview. Appl Catal A, 2011,404(1/2): 1–11.
[3]Nissen TL, Kielland-Brandt MC, Nielsen J, et al.Optimization of ethanol production in Saccharomyces cerevisiae by metabolic engineering of the ammonium assimilation. Metab Eng, 2000, 2(1): 69–77.
[4]Valadi H, Larsson C, Gustafsson L. Improved ethanol production by glycerol-3-phosphate dehydrogenase mutants of Saccharomyces cerevisiae. Appl Microbiol Biotechnol, 1998,50(4): 434–439.
[5]Remize F, Barnavon L, Dequin S. Glycerol export and glycerol-3-phosphate dehydrogenase, but not glycerol phosphatase, are rate limiting for glycerol production in Saccharomyces cerevisiae. Metab Eng, 2001, 3(4): 301–312.
[6]Larsson K, Ansell R, Eriksson P, et al. A gene encoding sn-glycerol 3-phosphate dehydrogenase(NAD+)complements an osmosensitive mutant of Saccharomyces cerevisiae. Mol Microbiol, 1993,10(5): 1101–1111.
[7]Shianna KV, Marchuk DA, Srand MK. Genomic characterization of POS5, the Saccharomyces cerevisiae mitochondrial NADH kinase.Mitochondrion, 2006, 6(2): 99–106.
[8]Strand MK, Stuart GR, Longley MJ, et al. POS5 gene of Saccharomyces cerevisiae encodes a mitochondrial NADH kinase required for stability of mitochondrial DNA. Eukaryot Cell, 2003, 2(4):809–820.
[9]Stuart GR, Humble MM, Strand MK, et al.Transcriptional response to mitochondrial NADH kinase deficiency in Saccharomyces cerevisia.Mitochondrion, 2009, 9(3): 211–221.
[10]Bro C, Birgitte R, Jochen F, et al. In silico aided metabolic engineering of Saccharomyces cerevisiae for improved bioethanol production.Metab Eng, 2006, 8(2): 102–111.
[11]Hou J, Lages NF, Oldiges M, et al. Metabolic impact of redox cofactor perturbations in Saccharomyces cerevisiae. Metab Eng, 2009,11(4): 253–261.
[12]Guo ZP, Zhang L, Ding ZY, et al. Minimization of glycerol synthesis in industrial ethanol yeast without influencing its fermentation performance.Metab Eng, 2011, 13(1): 49–59.
[13]Gietz RD, Schiestl RH, Willems AR, et al. Studies on the transformation of intact yeast cells by the LiAc/SS-DNA/PEG procedure. Yeast, 1995, 11(4):355–360.
[14]Gietz RD, Schiestl RH. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nat Protoc, 2007, 2(1): 31–34.
[15]Shi F, Kawai S, Mori S, et al. Identification of ATP-NADH kinase isozymes and their contribution to supply of NADP(H)in Saccharomyces cerevisiae. FEBS J, 2005, 272(13):3337–3349.
[16]Wang JZ. The Technical Manuals of Protein.Beijing: Science Press, 2000: 42–47 (in Chinese).汪家政. 蛋白质技术手册. 北京: 科学出版社,2000: 42–47.
[17]Liu LM, Li Y, Du GC, et al. Redirection of the NADH oxidation pathway in Torulopsis glabrata leads to an enhanced pyruvate production. Appl Microbiol Biotechnol, 2006, 72(2): 377–385.
[18]Hong P, Liu HW, Jin GH, et al. Determination of ATP, ADP, AMP, NAD+, NADH in skeletal muscle by HPLC. Chin J Sports Med, 2002, 21(1): 57–60(in Chinese).洪平, 刘虎威, 靳光华, 等. 高效液相色谱法测定骨骼肌ATP, ADP, AMP, NAD+, NADH含量.中国运动医学杂志, 2002, 21(1): 57–60.
[19]Zhang L, Tang Y, Guo ZP, et al. Improving the ethanol yield by reducing glycerol formation using cofactor regulation in Saccharomyces cerevisiae.Biotechnol Lett, 2011, 33(7): 1375–1380.
[20]Nevoigt E, Stahl U. Osmoregulation and glycerol metabolism in the yeast Saccharomyces cerevisiae.FEMS Microbiol Rev, 1997, 21(3): 231–241.
[21]Guo ZP, Zhang L, Ding ZY, et al. Interruption of glycerol pathway in industrial alcoholic yeasts to improve the ethanol production. Appl Microbiol Biotechnol, 2009, 82(2): 187–292.
[22]Norbeck J, Blomberg A. Metabolic and Regulatory changes associated with growth of Saccharomyces cerevisiae in 1.4 M NaCl. J Biol Chem, 1996, 272(9): 5544–5554.
[23]Yu KO, Kim SW, Han SO. Engineering of glycerol utilization pathway for ethanol production by Saccharomyces cerevisiae. Bioresour Technol,2010, 101(11): 4157–4161.
[24]Yu KO, Kim SW, Han SO. Reduction of glycerol production to improve ethanol yield in an engineered Saccharomyces cerevisiae using glycerol as a substrate. J Biotechnol, 2010, 150(2):209–214.
[25]Tang Y. The expression strategy for glycerol decomposition based on endocellular redox equilibrium in Saccharomyces cerevisiae[D].Wuxi: Jiangnan University, 2012 (in Chinese).唐燕. 基于工业酒精酵母胞内氧化还原平衡的甘油分解表达策略[D]. 无锡: 江南大学, 2012.
