肠出血性大肠杆菌毒力因子Z1444的原核表达及其丝/苏氨酸激酶活性验证
2014-10-27李崭李涛陈芳红刘雄周育森王慧
李崭,李涛,陈芳红,刘雄,周育森,王慧
1.广西医科大学,广西 南宁 5300002;2.军事医学科学院 微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071
肠出血性大肠杆菌(enterohemorrhagic Esche⁃richia coli,EHEC)O157∶H7作为一种重要的食源性致病菌,其感染特点为世界流行性、高发病率与病死率,以及抗生素治疗会加剧病情等[1]。自美国1982年首次暴发流行以来,许多国家相继发生了EHEC O157∶H7的感染流行[2]。现今其感染已成为一个全球性的公共卫生问题,受到各国广泛关注[3]。对该菌致病机制的研究,已成为世界医学界的关注点[4-6]。
EHEC O157∶H7的致病机制与其基因组中某些特殊区域有关,这些区域可编码与EHEC致病性有关的毒力因子,而毒力岛就是这些特殊基因的编码区[7]。O157∶H7毒力岛包括编码eae基因的LEE岛、前噬菌体上编码志贺样毒素(Shiga-like toxin,SLT)的slt基因和大质粒(pO157)编码的hly、katP、espP、toxB、stcE基因等[8],目前对EHEC致病机制的研究主要集中在毒力岛编码系统上[9]。通过对毒力岛的研究发现了一些重要的毒力因子,但迄今所发现的毒力因子不足以解释0157∶H7的全部致病过程[10]。
我们通过对EHEC毒力岛编码序列的扫描,在毒力岛前噬菌体编码区志贺样毒素基因slt上游位置发现了功能未知的Z1444蛋白基因[11-13]。通过毒力因子基因同源比对,分析致病基因保守区域,预测EHEC染色体一段完整基因ORF Z1444具有潜在的致病性,该基因编码的蛋白很可能参与细菌与宿主的相互作用,并且可能是具有Ⅲ型分泌系统的致病菌重要的效应蛋白(毒力因子)。因此,研究0157∶H7 Z1444蛋白,对于进—步了解细菌与宿主的相互作用具有重要意义。
1 材料与方法
1.1 材料
EHEC O157∶H7 EDL933株和 pET-28a(+)载体为本室保存;大肠杆菌DH5α、BL21(DE3)感受态细胞,pEASY-T1载体,Taq酶,dNTP及DNA marker购自TransGen公司;质粒小提试剂盒和琼脂糖凝胶回收试剂盒购自北京博迈德公司;NdeⅠ、XhoⅠ限制性内切酶及T4DNA连接酶购自NEB公司;His抗体和磷酸丝氨酸/苏氨酸抗体分别购自CST与Ab⁃cam公司。
1.2 Z1444基因的扩增
根据 GenBank中的 Z1444基因序列(ID:959087)设计引物 Z1444(up)(5'-CATATGCTAACT CCATACAAAAG-3')和 Z1444(down)(5'-CTCGAG GTTATCCTTTAATAACCTATACTG-3'),分别在上下游引物中引入NdeⅠ、XhoⅠ酶切位点(下划线序列)。以EHEC O157∶H7全菌裂解液为模板,Z1444(up)、Z1444(down)为引物扩增目的基因。PCR条件:95℃预变性5 min;94℃变性30 s,53℃复性30 s,72℃延伸90 s,30个循环;72℃延伸10 min,4℃停止。取25 μL PCR产物于10 g/L琼脂糖凝胶中电泳(116 V),20 min后在紫外灯下观察结果并拍照。
胶回收PCR产物,与pEasy-T1载体连接,转入大肠杆菌DH5α感受态细胞,在LB培养基中过夜培养(37℃、200 r/min),次日从转化平板上挑取单克隆菌落,以 Z1444(up)、Z1444(down)为引物进行 PCR筛选鉴定阳性菌株,阳性克隆送生工生物工程有限公司测序。
1.3 表达菌株pET-28a(+)-Z1444/BL21的构建
1.3.1 表达质粒pET-28a(+)-Z1444的构建 将测序正确的克隆质粒pEasy-T1-Z1444用NdeⅠ、XhoⅠ双酶切,得到目的片段Z1444,胶回收,用T4DNA连接酶连接经同样双酶切处理的pET-28a(+)载体,连接产物转化大肠杆菌DH5α感受态细胞,在LB培养基中过夜培养(37℃、200 r/min),次日从转化平板上挑取单克隆菌落,以Z1444(up)、Z1444(down)为引物进行PCR初筛,NdeⅠ、XhoⅠ双酶切复检,鉴定阳性菌株,阳性克隆送生工生物工程有限公司测序。
1.3.2 表达菌株的构建 将测序正确的重组质粒pET-28a(+)-Z1444转化大肠杆菌BL21(DE3)感受态细胞,在LB培养基中过夜培养(37℃、200 r/min),次日挑取单克隆,以Z1444(up)、Z1444(down)为引物进行PCR鉴定。
1.4 目的蛋白的表达与纯化
1.4.1 蛋白表达 鉴定为阳性的单克隆菌株和转入空载体的阴性对照菌接入新鲜LB培养基,37℃培养至对数生长期前期时(D600nm约为0.4),加入IPTG至终浓度为1 mmol/L,25℃、200 r/min条件下诱导6 h,5000 r/min离心20 min收集菌体,用1/5体积的PBS重悬菌体,400W功率超声4个循环(工作3 s,间隔5 s,循环99次),破碎菌体细胞,5000 r/min离心15 min,分离上清、沉淀,各取20 μL样品进行SDSPAGE(5%浓缩胶和15%分离胶;恒压110 V,浓缩15 min;恒压180 V,分离1 h)。
1.4.2 蛋白纯化 超声裂解后上清过镍柱(His⁃Trap FF crude 5 mL)纯化,用400 mmol/L咪唑洗脱液洗脱,取纯化后蛋白20 μL进行SDS-PAGE。
1.5 纯化蛋白的功能初步验证
1.5.1 His标签蛋白的Western印迹 收集纯化的蛋白,进行15%SDS-PAGE鉴定,并电转移到醋酸纤维素(PVDF)膜上,用3%BSA封闭(37℃、2 h),加入1∶1000稀释的兔源抗His抗体(一抗),4℃过夜,再加入1∶1000稀释的HRP酶标二抗(抗兔),室温轻摇1 h,用TBST洗膜后,在BIO-RAD凝胶成像系统中化学发光显影。
1.5.2 纯化蛋白的体外酶活实验 GenBank中Z1444的蛋白功能注释为丝/苏氨酸蛋白激酶,因此选取丝/苏氨酸通用底物髓鞘碱性蛋白(myelin ba⁃sic protein,MBP)进行测定[14]。首先将 MBP溶于酶活实验低渗缓冲液[20 mmol/L Hepes(pH7.4),150 mmol/L NaCl,10 mmol/L MgCl2]中,然后加入Z1444蛋白,补加50 μmol/L ATP,于30℃反应30 min后收集产物,进行15%SDS-PAGE后电转移至PVDF膜上,用3%BSA封闭(37℃、2 h),加入1∶1000稀释的鼠源磷酸丝氨酸/苏氨酸抗体(一抗),4℃过夜,再加入1∶1000稀释的HRP酶标二抗(抗鼠),室温轻摇1 h,用TBST洗膜后,在BIO-RAD凝胶成像系统中化学发光显影。
2 结果
2.1 pET-28a(+)-Z1444原核表达质粒的构建与鉴定
以EHEC O157∶H7全菌裂解液为模板,Z1444(up)、Z1444(down)为引物PCR扩增Z1444基因,经琼脂糖凝胶电泳,获得约1047 bp的DNA片段,与预期一致(图1)。将pET-28a(+)载体与PCR鉴定阳性的质粒pEasy-T1-Z1444同时经NdeⅠ/XhoⅠ双酶切,各自胶回收产物用T4DNA连接酶连接,转入大肠杆菌DH5α,涂板后挑取克隆酶切鉴定,可切出2条片段,分别为长度约5000 bp的空载体pET-28a(+)和1047 bp的Z1444条带,重组质粒pET-28a(+)-Z1444作为双酶切前对照,符合预期结果(图2)。完成后质粒送生工生物工程有限公司测序,测序结果与NCBI数据库收录的相应碱基序列的一致率为100%(序列略)。
2.2 重组Z1444的表达和纯化
重组菌pET-28a(+)-Z1444/BL21经IPTG诱导表达后制备全菌裂解液,分离沉淀和上清,取样品进行SDS-PAGE鉴定,可见上清中在相对分子质量约38×103处有明显的蛋白条带,与预期相符(图3),而沉淀中对应位置并无显著条带。转入空载体的菌体裂解液作为阴性对照,经相同处理后,对应位置无目的条带。因此,可以判断获得了原核表达的目的蛋白,且以可溶性形式存在。将重组菌全菌裂解液上清经镍柱纯化,去除大量杂蛋白,得到较纯的蛋白条带(图4),所得蛋白溶液经反复冻融后没有出现沉淀,可供后续试验使用。

图1 PCR扩增Z1444基因

图2 重组质粒pET-28a(+)-Z1444的酶切鉴定
2.3 重组Z1444的丝/苏氨酸激酶活性初步验证
将纯化的Z1444蛋白进行Western印迹,检测His-Z1444蛋白表达,结果见图5。同时将丝/苏氨酸激酶通用磷酸化底物MBP与Z1444蛋白混合后补加ATP,30℃孵育30 min,完成酶促反应,用磷酸丝/苏氨酸抗体进行Western印迹检测,可见Z1444蛋白不仅可以磷酸化通用底物MBP,且Z1444蛋白本身发生了自磷酸化现象(图6)。
3 讨论

图3 重组菌pET-28a(+)-Z1444/BL21的蛋白表达
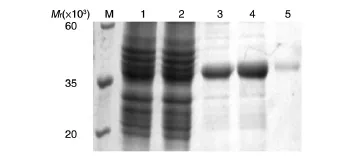
图4 重组Z1444蛋白的纯化

图5 Western印迹检测His-Z1444蛋白的表达

图6 纯化的Z1444蛋白的丝/苏氨酸激酶活性验证
我们通过寡核苷酸互补原理双向设计引物,从大肠杆菌O157∶H7 EDLL933全基因组中钓取出Z1444基因,利用PCR扩增目的基因,选用带有His标签的pET载体系统构建了重组表达质粒,然后以大肠杆菌BL21(DE3)作为宿主菌进行蛋白表达。我们希望得到高水平表达的重组蛋白,且最好为可溶性形式,以利于蛋白纯化及后续活性验证。为此,我们进行了表达条件的优化。在较高温度如常规37℃诱导表达时发现重组蛋白大多形成包涵体,于是进行了温度梯度诱导实验,发现25℃诱导时重组蛋白为可溶性表达,产物表达量占上清总蛋白的40%左右。后续采用亲和层析NTA His结合树脂纯化蛋白,配制6种浓度的咪唑洗脱液进行蛋白梯度洗脱纯化,发现400 mmol/L咪唑洗脱液具有优势,可除去大部分杂蛋白,特异性较好,可获得纯度较高的蛋白。Z1444蛋白在原核系统中的高效可溶性表达,为后续蛋白活性研究提供了良好的实验材料。
O157∶H7是EHEC的主要血清型,能引起人的出血性结肠炎和溶血性尿路综合征[15]。EHEC可以产生毒力极强的志贺毒素,且具有黏附上皮细胞的能力,感染人或动物时黏附到肠黏膜上皮细胞,然后在此定居,释放外毒素,从而引起疾病[16-17]。毒力岛是与细菌致病性和毒力因子密切相关的基因簇[18-19],获得EHEC O157:H7毒力岛上某些基因的可溶性原核表达,为研究该基因的功能奠定了基础,同时有助于探索基因与菌株致病性之间的相互关联。
综上所述,我们构建了pET-28a(+)-Z1444重组表达载体,并筛选获得了高效原核表达工程菌,建立了简便可行的蛋白纯化工艺,获得了浓度纯度在90%以上的Z1444蛋白,为进一步研究Z1444蛋白在大肠杆菌与宿主相互作用时所起的功能奠定了基础。我们还通过Western印迹验证了GenBank对Z1444蛋白的功能注释,发现该蛋白不仅可以磷酸化通用底物MBP,而且蛋白本身也发生自磷酸化现象。考虑到这些特殊的酶活效应,对其蛋白生物学活性的进一步验证显得尤为重要,这将有助于了解功能未知毒力因子在细菌感染时的作用机制。
[1]Orskov F,Orskov I.Escherichia coli serotyping and disease in man and animals[J].Can J Microbiol,1992,38(7):699-704.
[2]乌全明.肠出血性大肠杆菌O157感染防治研究进展[J].微生物学杂志,2004,5:96-98.
[3]Hacker J,Kaper J B.Pathogenicity islands and the evolution of microbe[J].Annu Rev Microbiol,2000,54:614-719.
[4]陈素良,郭逸秀,李胜奎,等.O157感染死亡病例的流行病学调查报告[J].现代预防医学,2001,28:169-174.
[5]Hedberg C.Food-related illness and death in the United States[J].Emerg Infect Dis,1999,5(6):840-842.
[6]McDaniel T K,Jarvis K G,Donnenberg M S,et al.A genet⁃ic locus of enterocyte effacement conserved among diverse en⁃terobacterial pathogens[J].Proc Natl Acad Sci USA,1995,92:1664-1668.
[7]杨琴,阎有功,曹军皓.肠出血性大肠杆菌三型分泌系统及转位效应器蛋白的研究进展[J].预防医学,2008,12(2):112-233.
[8]周勇,万成松.大肠杆菌O157:H7的毒力岛与毒力因子的研究进展[J].微生物学免疫学进展,2006,34(2):58-62.
[9]Hacker J,Blum-Oehler G,Mühldorfer I,et al.Pathogenicity islands of virulent bacteria:structure,function and impact on microbial evolution[J].Mol Microbiol,1997,23:1089-1097.
[10]Johansen B K,Wasteson Y,Granum P E,et al.Mosaic struc⁃ture of Shiga-toxin-2-encoding phages isolated from Esche⁃richia coliO157:H7 indicatesfrequentgene exchange be⁃tween lambdoid phage genomes[J].Microbiology,2001,147:1929-1936.
[11]Campbell A,Botstein D.Evolution of the lambdoid phages[M]//Hendrix R W,Roberts J W,Stahl F W.Lambda II:vol II.New York:Cold Spring Harbor,1983:365-380.
[12]Datz M,Janetzki-Mittmann C,Franke S,et al.Analysis of the enterohemorrhagic Escherichia coli O157 DNA region con⁃taining lambdoid phage gene p and Shiga-like toxin structur⁃al genes[J].Appl Environ Microbiol,1996,62(3):791-797.
[13]Plunkett G 3rd,Rose D J,Durfee T J,et al.Sequence of Shiga toxin 2 phage 933W from Escherichia coli O157:H7:Shiga toxin as a phage late-gene product[J].J Bacteriol,1999,181(6):1767-1778.
[14]Hanks S K,Quinn A M,Hunter T,et al.The protein kinase family:conserved features and deduced phylogeny of the cata⁃lytic domains[J].Science,1988,241(4861):42-52.
[15]Karmali M A,Steele B T,Petric M,et al.Sporadic cases of haemolytic-uraemic syndrome associated with faecal cytotoxin and cytotoxin-producing Escherichia coli in stools[J].Lancet,1983,1(8325):619-620.
[16]蒋小平,邓思敏,钟巍,等.大肠埃希菌O157:H7致病因素的研究进展[J].病原生物学,2012,40(11):6531-6533.
[17]王斌,叶冬青.耶尔森菌强毒力岛[J].微生物学通报,2003,3(30):99-103.
[18]徐建国.病原性细菌的III型分泌系统、毒力岛和基因组学[J].国外医学微生物学分册,1999,2(19):169-172.
[19]Elliott S J,Wainwright L A,McDaniel T K,et al.The com⁃plete sequence ofthe locusforenterocyte effacement(LEE)from enteropathogenic Escherichia coli E2348/69[J].Mol Micro⁃biol,1998,28:1-4.
