炎症因子IL-23对黑色素瘤B16F10细胞增殖和侵袭能力的影响
2014-10-22马跃美刘艳荣房东亮赵秀兰
田 原,马跃美,刘艳荣,房东亮,赵秀兰
(天津医科大学1.外科手术学教研室;2.病理学教研室,天津300070)
白细胞介素-23(IL-23)在炎症和自身免疫性疾病中具有重要的调节作用,目前研究表明IL-23可通过调控肿瘤微环境中的炎症反应[1],从而促进肿瘤的发生与侵袭迁移[2]。有关炎症因子IL-23对黑色素瘤细胞增殖和侵袭力的直接影响少见报道。本研究在前期研究慢性炎症与肿瘤关系的基础上,通过体外实验探讨IL-23对黑色素瘤B16细胞增殖和侵袭能力的影响,为进一步研究IL-23在慢性炎症与肿瘤发生发展中所发挥的作用提供一定理论依据。
1 材料与方法
1.1 材料 小鼠黑色素瘤细胞株B16F10由天津医科大学病理学教研室冻存。重组鼠IL-23购自美国PeproTech公司,Transwell小室(直径为 8μm)购自Invitrogen公司,MTT购自美国Sigma公司,Matrigel胶购自美国BD公司,细胞培养板购自美国Costar公司,胎牛血清(FBS)购自美国Hyclone公司。兔抗鼠NF-κB磷酸化P65一抗购自美国Santa Cruze公司,兔抗鼠β-actin一抗、山羊抗兔二抗购自北京中杉金桥生物公司。
1.2 方法
1.2.1 细胞培养 小鼠黑色素瘤细胞B16F10,接种于含10%胎牛血清的RPMI-1640培养基中(加入青霉素、链霉素各100 U/m L),置于37℃、5%CO2培养箱中培养,以0.25%胰蛋白酶消化传代。所有实验均用对数生长期的细胞。
1.2.2 MTT法检测B16细胞的增殖能力 将B16细胞制备成1×104/mL单细胞悬液,按每孔200μL接种于96孔培养板,培养24 h后在培养液中加入终浓度为10 ng/mL的IL-23,并设空白对照组,在培养箱中分别放置24、48、72、96 h后,加入MTT 100 μL培养4 h,吸弃液体,每孔加入100μLDMSO充分溶解15min。用酶标仪于490 nm处测吸光度值(A值),结果为5复孔的平均值。
1.2.3 Transwell侵袭实验检测B16细胞的侵袭能力 用 50 mg/LMatrigel胶 1∶8稀释液包被 Transwell小室的上室面,37℃孵育过夜。实验前细胞用无血清培养基培养过夜,次日消化重悬细胞,于下室加入含10%胎牛血清的培养基、上室中加入无血清和浓度为10 ng/mL IL-23的B16细胞悬液各200 μL,并设空白对照组,在培养箱中培养48 h后取出小室,PBS淋洗,擦去上室中细胞,95%酒精固定10 min,4 g/L结晶紫染色,PBS清洗,200倍倒置显微镜下拍照穿膜细胞,随机选10个视野,计算平均数。实验重复3次,每组各设3复孔。
1.2.4 明胶酶谱检测B16细胞MMP-2和MMP-9的表达活性 将无血清的B16细胞接种到24孔板,每孔500μL,培养24 h后,在培养液中加入10 ng/mL IL-23,培养48 h后,收集上清液,12 000 r/min,离心10min,进一步取上清液进行明胶酶谱检测。以含0.1%明胶的10%聚丙烯酰胺凝胶进行电泳至溴酚兰进入阳极缓冲液为止,分离凝胶,2.5%Triton-X100洗胶4次,每次30min。将胶完全浸入明胶酶孵育液(50mmol/L pH7.5Tris-HCl、10mmol/L CaCl2、200mol/LNaCl、1 μmol/LZnCl2)中,37 ℃孵育42 h,常规考马斯亮蓝染色,脱色液脱色至复染带清晰,图像分析系统测定凝胶中MMPs活性条带活性水平,应用Gel-pro analyzer分析软件测定条带平均灰度值。
1.2.5 Western blot检测 加入细胞裂解液裂解细胞,提取细胞总蛋白,加样行10%聚丙烯酰胺凝胶电泳。将蛋白从SDS-PAGE胶转膜至PVDF膜,利用5%脱脂奶粉封闭,然后分别加入兔抗鼠NF-κB磷酸化 P65 一抗(1∶200)、β-actin 一抗(1∶200),在37℃下作用2 h;用TBST漂洗3次,每次10min后与山羊抗兔 IgG 抗体(1∶2 000)反应,37℃作用 2 h;然后用TBST漂洗,10min/次,洗涤3次;在暗室避光X光胶片曝光,进行显影、定影、拍照。
1.3 统计学处理 实验数据以均数±标准差 (x±s)表示,采用SPSS 17.0软件做统计分析,两独立样本比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 IL-23对B16细胞增殖能力的影响 MTT法检测结果显示,10 ng/mL IL-23作用于B16细胞24、48、72和96 h时,实验组与对照组相比,细胞活力均无显著变化,IL-23对细胞的增殖无影响,差异无统计学意义(P>0.05)(图 1)。
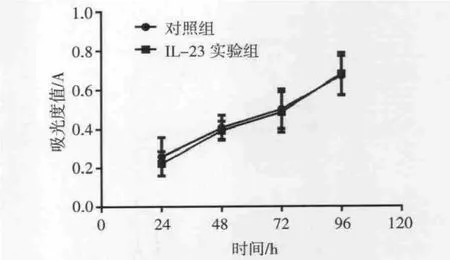
图1 IL-23对B16细胞增殖能力的影响Fig 1 Theeffectof IL-23 on proliferation ability of B16 cells
2.2 IL-23对B16细胞侵袭能力的影响 Transwell侵袭实验显示,10 ng/mL IL-23作用于B16细胞24 h后,与对照组相比,穿过基底膜的数目明显增多,差异有统计学意义(P<0.01)(表 1)。

表1 IL-23对B16细胞侵袭能力的影响(x±s)Tab1 Effectof IL-23 on invision ability of B16 cells(x±s)
2.3 IL-23对B16细胞MMP-2和MMP-9表达活性的影响 与对照组相比,10 ng/mL IL-23作用于B16细胞48 h后,可明显增强肿瘤细胞MMP-9活性,差异有统计学意义(P<0.01),MMP-2活性未见显著变化(P>0.05)(图 2)。
2.4 IL-23对B16细胞磷酸化NF-κB P65表达水平的影响 Western blot结果与对照组相比,IL-23处理组肿瘤细胞磷酸化P65蛋白表达水平显著升高(P<0.01),见图 3。

图2 IL-23对B16细胞MMP-9和MMP-2表达活性的影响Fig 2 Effectsof IL-23 on MMP-9 and MMP-2 expression activitiesof B16 cells

图3 IL-23处理组肿瘤细胞磷酸化P65蛋白的表达Fig 3 The expression of phosphorylated P65 in IL-23 treated B16 cells
3 讨论
慢性炎症在多种肿瘤的启动、进展及转移潜能中起着致病因子作用,炎症性细胞因子的异常表达,可以在体内募集单核巨噬细胞、中性粒细胞等到达肿瘤临近的部位,形成有利于肿瘤生长和侵袭的微环境,诱导肿瘤血管生成促进肿瘤发展进程。IL-23是近年来发现的一种同时参与慢性炎症形成和肿瘤发生的细胞因子,研究表明IL-23可促进局部环境中炎症介质的释放,抑制机体特异性免疫监视,促进黑色素瘤的发生与生长[3];IL-23可激活Stat3信号通路,在肺癌细胞的增殖过程中发挥重要作用,并呈现其浓度依赖性[4];IL-23也可在肝癌的发展过程中激活NF-κB信号通路加速其转移和侵袭[5]。因此针对IL-23与肿瘤细胞关系的研究对肿瘤的防治、免疫应答及调节都有重要意义。
Langowski[3]发现IL-23p19缺失的小鼠能够抵抗肿瘤发生,同时阻断IL-23信号通路也能抑制肿瘤生长。本文前期建立荷瘤小鼠-慢性炎症复合模型[6]研究中,进一步证实了IL-23对肿瘤的生长具有调节作用。最近研究表明低浓度外源性IL-23可直接促进肺癌肿瘤细胞的增殖,并参与肿瘤微环境的形成;高浓度IL-23则抑制肿瘤细胞增殖[4]。而本实验体外IL-23刺激B16细胞,肿瘤细胞增殖活性却未见明显提升,提示IL-23在不同肿瘤疾病中作用机制可能存在差异,不同IL-23浓度下肿瘤细胞的增殖效应也不尽相同。综合前期体内模型结果[6],实验组血清检测IL-23表达升高的同时,移植瘤微血管密度(MVD)等指标显著增加,本文推测在黑色素瘤发生发展的过程中,IL-23可能通过诱导黑色素瘤细胞或基质细胞分泌MMPs、VEGF等介质,促进肿瘤血管生成进而促进肿瘤生长。
IL-23促进肿瘤微环境中Th0细胞分化为Th17细胞,Th17细胞产生IL-17A,IL-17A可以通过NF-κB上调基质金属蛋白酶的表达来促进肝癌细胞的侵袭和迁移[7],但IL-23对肿瘤的侵袭是否有直接的作用少见报道。本文侵袭实验结果显示,IL-23处理后B16细胞穿膜细胞数明显增多,上述增殖实验提示穿膜数的增加并非由增殖引起,说明IL-23促进了B16细胞的体外侵袭。MMPs是一类与肿瘤侵袭相关的锌依赖性肽链内切酶家族,其相关的信号传导通路参与了肿瘤细胞的生长、肿瘤侵袭及肿瘤血管的形成[8],目前发现的MMPs有23种,MMP-2、MMP-9等与肿瘤的侵袭和迁移相关,本文明胶酶谱分析IL-23处理B16细胞的MMP-9活性明显增强,说明IL-23可通过上调MMP-9的活性促进B16细胞的侵袭。Western blot分析显示IL-23促进了磷酸化P65的表达,从而激活NF-κB信号通路,说明NF-κB是MMP-9表达的关键转录因子,印证了NF-κB通路是炎症与肿瘤相联系的关键点[9],NF-κB信号通路的活化参与了恶性肿瘤发生发展的多个环节[10]。
综上所述,IL-23对黑色素瘤B16细胞的增殖无明显的刺激作用,可通过提高MMP-9的活性而增强细胞的体外侵袭能力,这一促进作用与肿瘤细胞NF-κB信号通路的上调有关。本文研究IL-23在慢性炎症与肿瘤进展中的调节作用,并为以IL-23作为新的生物治疗靶点应用于临床提供了一定的实验依据。
[1]KortylewskiM,Xin H,KujawskiM,etal.Regulation of the IL-23 and IL-12 balance by Stat3 signaling in the tumormicroenvironment[J].Cancer Cell,2009,15(2):114
[2]Teng MW,von Scheidt B,Duret H,etal.Anti-IL-23 monoclonal antibody synergizes in combination with targeted therapies or IL-2 tosuppress tumorgrowth andmetastases[J].CancerRes,2011,71(6):2077
[3]Langowski JL,Zhang X,Wu L,etal.IL-23 promotes tumour incidenceand growth[J].Nature,2006,442(7101):461
[4]Li J,Zhang L,Zhang J,etal.Interleukin 23 regulatesproliferation of lung cancer cells in a concentration-dependentway in association with the interleukin-23 receptor[J].Carcinogenesis,2013,34(3):658
[5]Li J,Lau G,Chen L,etal.Interleukin 23 promotes hepatocellular carcinomametastasis via NF-kappa B induced matrixmetalloproteinase9 expression[J].PLoSOne,2012,7(9):e46264
[6]房东亮,马跃美,赵秀兰,等.慢性炎症对小鼠黑色素瘤血管生成的影响[J].天津医药,2013,3:230
[7]Kessenbrock K,Plaks V,Werb Z.Matrixmetalloproteinases:regulatorsof the tumormicroenvironment[J].Cell,2010,141(1):52
[8]Li J,Lau GK,Chen L,etal.Interleukin 17A promoteshepatocellular carcinoma metastasis via NF-kB induced matrix metalloproteinases2 and 9 expression[J].PloSOne,2011,6(7):e21816
[9]Colotta F,Allavena P,Sica A,etal.Cancer-related inflammation,the seventh hallmark of cancer:links to genetic instability[J].Carcinogenesis,2009,30(7):1073
[10]Grivennikov S I,Karin M.Dangerous liaisons:STAT3 and NF-κB collaboration and crosstalk in cancer[J].Cytokine Growth Factor Rev,2010,21(1):11
