强壮前沟藻生消过程中水色组分吸收特性*
2014-10-08姜玲玲杨建洪赵冬至
王 林,姜玲玲,2,杨建洪,赵冬至
(1.国家海洋环境监测中心,辽宁 大连 116023;2.大连海事大学 环境科学与工程学院,辽宁 大连 116026)
近年来,中国近海赤潮发生的频率、强度和范围呈现上升趋势,危害也越来越严重。对赤潮爆发的机理、预测预报和防治研究是具有全局性和紧迫性的重大科学问题[1-3]。水色组分包括浮游植物、非色素颗粒物以及有色可溶性有机物(CDOM),其吸收系数是水体的固有光学量之一,是建立水色遥感反演模型的前提和基础。赤潮发生时,浮游植物细胞密度急剧升高,其它水色组分亦随之变化,导致水体光学特性发生改变,最终引起海水变色[4-7]。国内外学者对赤潮水体生物光学特性已开展的大量研究工作[8-19]表明,赤潮生消过程中,浮游植物、非色素颗粒物及CDOM对总吸收的贡献不断变化;浮游植物吸收系数与叶绿素质量浓度的时间序列变化趋势一致;此外,赤潮时各水色组分的吸收系数均远大于正常水体的。
强壮前沟藻是一种能产生溶血性毒素的有害赤潮藻种,主要分布于热带和温带海域,为世界性分布种。我们依据2011-07藻种培养实验期间的实测数据,分析强壮前沟藻生消过程中水色组分的吸收特性,为赤潮卫星遥感探测及藻种识别提供科学依据。
1 材料与方法
1.1 实验藻的培养
2011-07 将预培养至对数生长期的强壮前沟藻细胞,接种至白色塑料培养桶内,同时注入经过滤、煮沸处理的消毒海水(海水取自大连海域自然海水,经处理后其本底的水色组分吸收系数较低,可忽略不计),并定量初始藻液的叶绿素质量浓度ρ(Chl)为15mg·m-3,体积80dm3左右。实验藻的培养基采用F/2培养基[20],一次性加入充足的营养盐,培养过程中不再添加任何物质,培养室内温度为(23±1)℃,光源为白色冷日光灯管,光暗比为12h∶12h。
强壮前沟藻生长状态分析[7]表明,培养周期内第1~15天叶绿素a质量浓度ρ(Chl-a)不断增大,确定为生长期,第16~21天叶绿素a质量浓度逐渐减小,确定为消亡期。
1.2 水色组分吸收系数获取
水体总吸收系数可表示为水体各成分的线性加和:

式(1)中,aw(λ)是水分子的吸收常数,ag(λ)和ap(λ)分别表示CDOM 和总颗粒物的吸收系数。总颗粒物的吸收系数ap(λ):

式(2)中,aph(λ)和ad(λ)分别是浮游植物和非色素颗粒物的吸收系数。
水色组分吸收系数样品每天下午13:00采集。样品采集前,通过曝气方式使藻液混合均匀,并采集藻液样品300mL。颗粒物样品吸收系数采用定量滤膜技术,样品制备采用Whatman GF/F玻璃纤维滤纸(直径25mm,孔径0.7μm)。而CDOM吸收系数样品制备采用 Whatman聚碳酸酯滤膜(直径25mm,孔径0.2 μm)。样品测量使用岛津公司生产的UV2550型紫外-可见光分光光度计(波段范围为190~900nm,杂散光小于0.000 3%,分辨率0.1nm,波谱带宽0.1~5nm)。测量得到光学密度后,分别计算可得总颗粒物吸收系数ap、非色素颗粒物吸收系数ad、浮游植物吸收系数aph以及CDOM吸收系数ag。样品制备与测量过程均按照《海洋行业标准》[21]进行。
1.3 色素浓度数据获取
色素浓度样品与吸收系数样品同步采集。样品制备采用Whatman GF/F玻璃纤维滤纸(直径25mm,孔径0.7μm),过滤一定体积的藻液。由于色素样品需等整个实验结束才能测量,所以样品膜对折后用锡箔纸包装,并保存于液氮生物容器中。
色素浓度测量采用荧光法[22],测量时使用Turner Design TD-700实验室荧光仪(灵敏度为20pg/cm3)。测量前用10mL丙酮萃(体积分数为90%)取样品膜24h,离心分离15min后取上清液测量荧光强度(Fb),再加入1滴盐酸(体积分数为10%),1min后测其酸化后荧光强度(Fa),通过酸化前后荧光差值和标准Chl-a酸化因子计算叶绿素a(Chl-a)质量浓度、脱镁叶绿素质量浓度(Pheo)。这里将2质量浓度之和作为叶绿素质量浓度(Chl)。荧光仪定标采用Sigma Chl-a标准样品。
2 结果与讨论
2.1 强壮前沟藻生消过程中各水色组分的吸收比例变化
浮游植物、非色素颗粒物以及CDOM的吸收贡献(以440nm为特征波段)如图1所示(图1中at-w为除纯海水之外的水体吸收系数,ax为不同水色组分的吸收系数),可发现强壮前沟藻生消过程中不同水色组分的吸收贡献存在较大差别。整个培养周期的始末阶段(第1天,第20天,第21天),CDOM的吸收贡献最大,可达50%以上;第2~5天,第19天时,非色素颗粒物的吸收贡献最大,基本在40%以上;而中间阶段时,浮游植物的吸收贡献最大,基本在60%左右。此外,还发现在整个生消过程中,CDOM的吸收贡献总体呈现先减小,之后相对平稳,然后再增大的趋势,除始末阶段外,吸收贡献相对较小,约为15%;非色素颗粒物的吸收贡献整体呈波浪状分布,约为35%;而浮游植物吸收贡献的分布情况与CDOM基本相反,先逐渐增大,之后相对平稳,后期迅速减小,总体看来,约为50%。
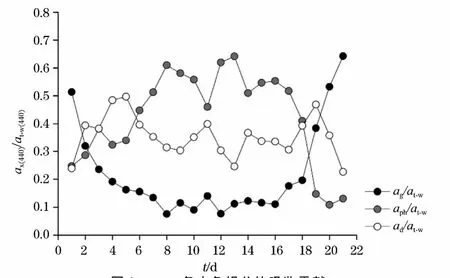
图1 λ440nm各水色组分的吸收贡献Fig.1 Absorption contribution of sea water color constituents atλ440nm
2.2 浮游植物吸收特性
2.2.1 吸收光谱特征
浮游植物吸收光谱(图2)表明,生长期时随着培养时间的增长,吸收系数不断增大,440nm波段(λ440nm)、675nm波段(λ675nm)的叶绿素a吸收峰更为明显;此外,在λ440nm吸收峰两侧各存在1个肩峰,其中,λ412nm肩峰由脱镁叶绿素造成,λ460nm肩峰则由叶绿素b导致。而消亡期时,随着培养时间的增长,吸收系数逐渐减小,λ440nm,λ675nm的吸收峰逐渐消弱;到第18天时,λ440nm吸收峰消失,λ412nm出现吸收峰,这与该阶段藻种细胞衰亡严重,已生成大量脱镁叶绿素有关;而最后2d时,所有吸收峰都已消失,说明此时藻种已全部消亡。
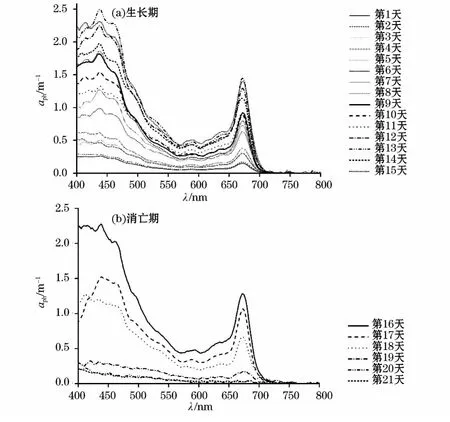
图2 生长期(a)和消亡期(b)强壮前沟藻吸收光谱Fig.2 Absorption spectral curves of phytoplankton in growing(a)and dying(b)periods
2.2.2 浮游植物吸收系数与叶绿素质量浓度的关系
研究表明,浮游植物在λ440nm,λ675nm的吸收系数与叶绿素质量浓度存在共变趋势,但并非简单的线性关系,更多是非线性的。选择乘幂函数进行拟合分析[23]:

式中,p0和p1为经验系数;λ0为参考波长。
拟合曲线(图3)表明,生长期和消亡期时,λ440nm,λ675nm强壮前沟藻的吸收系数与叶绿素质量浓度拟合曲线的相关性良好,决定系数R2均在0.80以上。aph(440),aph(675)与ρ(Chl)拟合时,消亡期的拟合曲线明显高于生长期,主要是因为拟合时的ρ(Chl)为叶绿素a与脱镁叶绿素质量浓度之和,而消亡期时脱镁叶绿素质量浓度较高,尤其是最后3d时,脱镁叶绿素质量浓度远高于叶绿素a质量浓度,研究表明[24]λ440nm,λ675nm处脱镁叶绿素的比吸收系数要小于叶绿素a,尤其是λ675nm波段相差几乎3倍,这样消亡期时λ440nm,λ675nm处叶绿素质量浓度的比吸收系数自然就小于生长期,即叶绿素质量浓度相同时,消亡期的吸收系数要低于生长期,与拟合结果一致。
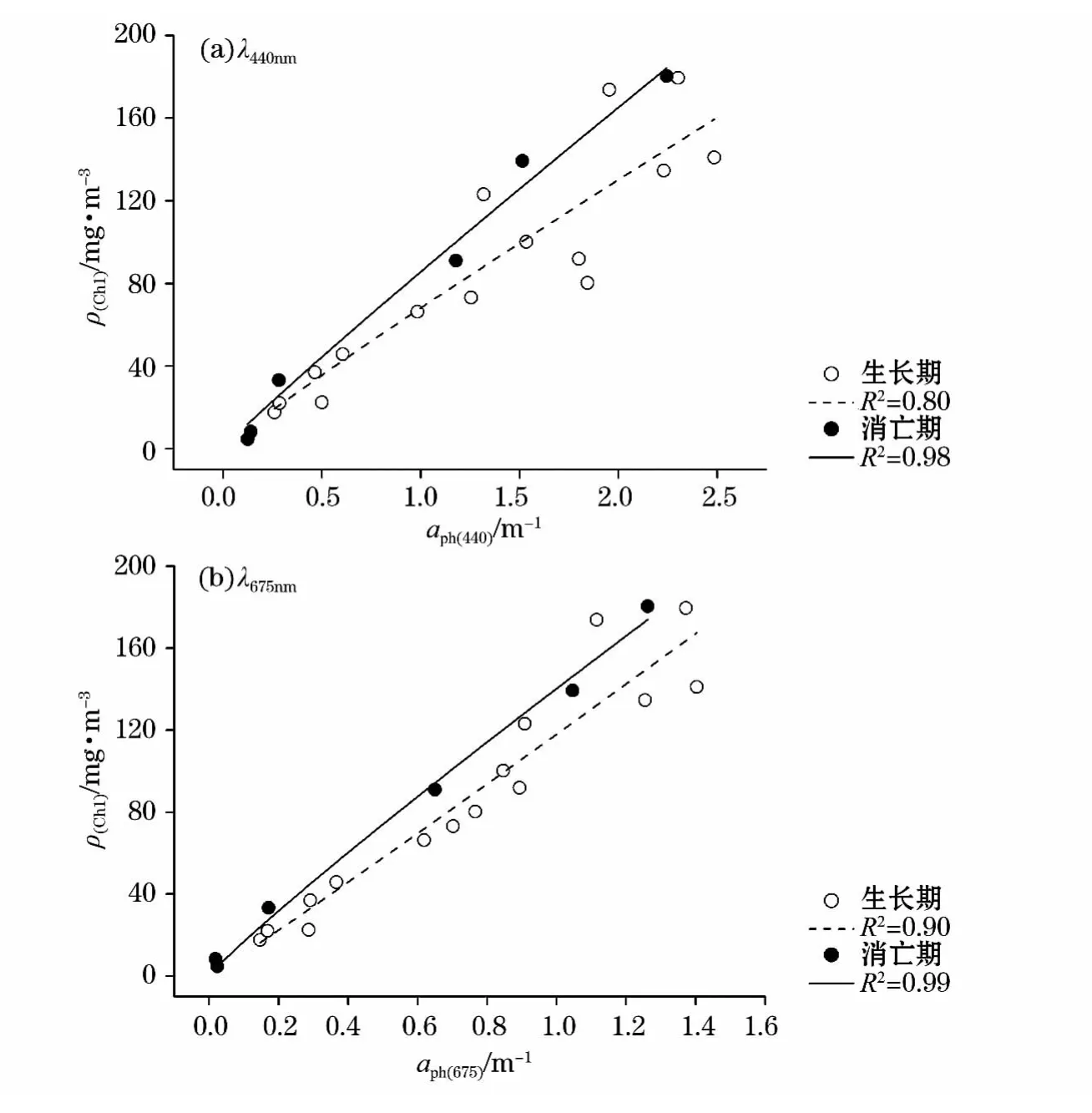
图3 λ440nm和λ675nm浮游藻类吸收系数与叶绿素质量浓度的拟合曲线Fig.3 Regression curves of chlorophyll concentration as a function of phytoplankton absorption coefficients atλ440nmandλ675nm
2.3 非色素颗粒物吸收特性
2.3.1 吸收光谱特征
非色素颗粒物吸收光谱随波长增加呈指数衰减趋势(图4)所示。生长期时,随着培养时间的增长,非色素颗粒物吸收系数整体呈增大趋势,出现这一现象与藻生长过程中活性较差或死亡的细胞含量不断增加有关。而消亡期时,这一现象恰恰相反,这似乎与“消亡时间越长,死亡藻细胞(大部分为非色素颗粒物)析出越多”矛盾,其实不然,分析整个培养过程会发现,在生长期时,虽然非色素颗粒物含量不断增加,但并未见颗粒态物质析出,而消亡期时,发现培养桶底部不断析出大量的颗粒态物质,这样培养液中所含的颗粒物减小,非色素颗粒物吸收系数自然越来越低。
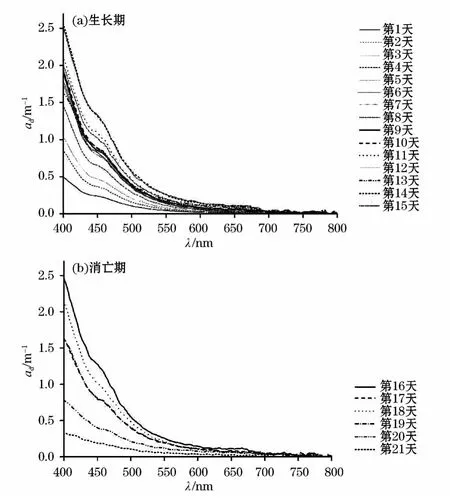
图4 生长期(a)和消亡期(b)非色素颗粒物吸收光谱Fig.4 Absorption spectral curves of de-pigmented particles in algagrowing(a)and dying(b)periods
2.3.2 非色素颗粒物吸收系数与叶绿素质量浓度的关系
非色素颗粒物吸收系数与叶绿素质量浓度存在正相关关系(图5)。生长期和消亡期的拟合曲线几乎重合,说明整个生消过程中,非色素颗粒物与藻种细胞的变化特征不仅一致,而且两者的比例关系基本相同。
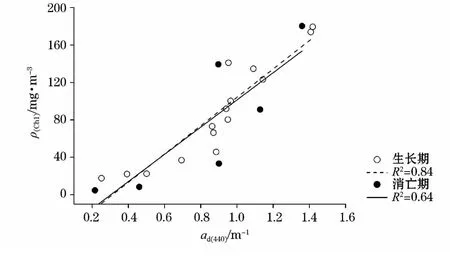
图5 λ440nm的非色素颗粒物吸收系数与叶绿素质量浓度的拟合曲线Fig.5 Regression curves of chlorophyll concentration as a function of de-pigmented particles absorption coefficients atλ440nm
2.4 CDOM吸收特性
2.4.1 吸收光谱特征
与非色素颗粒物相似,CDOM吸收光谱随波长增加也呈指数衰减趋势(图6)。生长期时,随着培养时间的增长,CDOM吸收光谱曲线高低变化规律并不一致,第1天时最高,之后高低变化较复杂。消亡期时,变化规律也并不完全一致,且最后3d的光谱曲线在λ400nm附近出现吸收肩峰,但由何种物质引起尚需进一步研究确定。
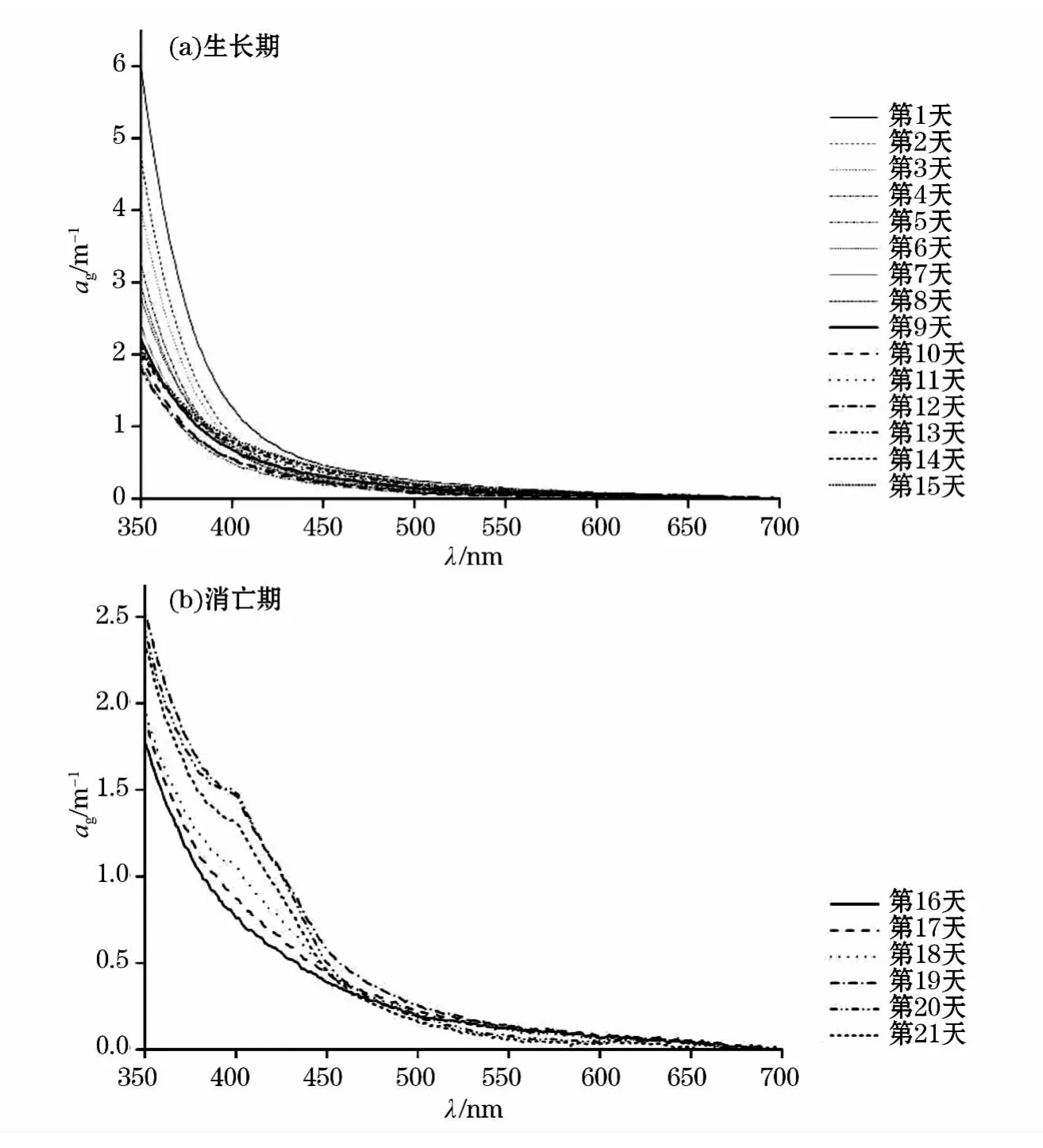
图6 生长期(a)和消亡期(b)CDOM吸收光谱Fig.6 Absorption spectral curves of CDOM in algagrowing(a)and dying(b)periods
2.4.2 CDOM吸收系数与叶绿素质量浓度的关系
研究表明,某些自然水体中CDOM吸收系数与叶绿素质量浓度存在正相关关系,即CDOM主要由浮游植物代谢产生。这里分别将生长期和消亡期的ag(440)与叶绿素质量浓度进行线性拟合分析(图7),发现生长期时两者存在正相关关系,而消亡期时则相反。生长期时,随着叶绿素质量浓度的增大,藻种细胞代谢产生的CDOM越来越多,两者存在正相关关系,然而,需要说明的是CDOM的光漂白作用是同时存在的,参与拟合的数据点表现为正相关说明此过程中藻种细胞代谢产生CDOM的速率大于光漂白分解CDOM的速率。消亡期时,随着叶绿素质量浓度的减小,藻种细胞不断消亡,死亡的藻种细胞会释放出大量的CDOM,因此,两者存在负相关关系,此时光漂白作用的影响小于代谢作用。
生长期时,第1~3天的数据未参与拟合,其中第1天时叶绿素质量浓度最低,而CDOM吸收系数最高,表明用于接种的预培养的藻液中含有极高质量浓度的CDOM,此阶段光漂白作用对CDOM的影响远大于藻种细胞代谢作用,这造成前3dCDOM含量与叶绿素质量浓度没有相关性。消亡期时,第20天和第21天的数据未参与拟合,此时,藻种细胞已基本全部消亡,不再代谢产生CDOM,仅存在光漂白作用分解CDOM,因此,最后2d时CDOM含量逐渐减小。
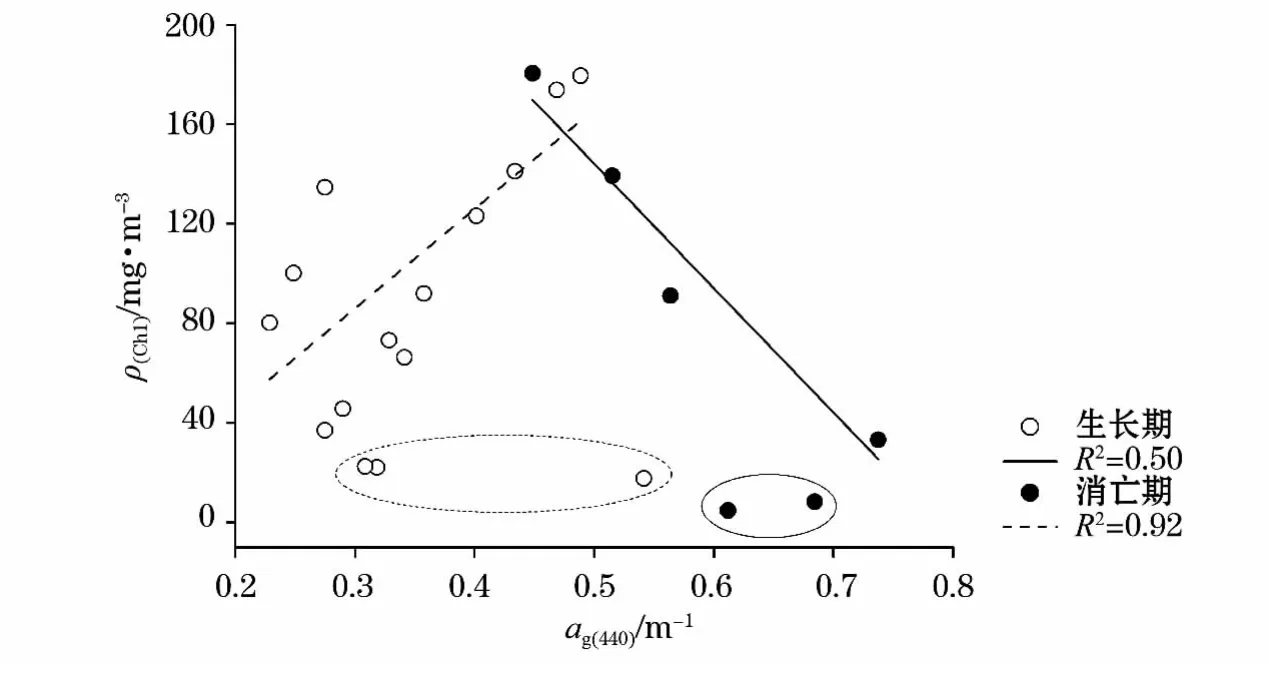
图7 λ440nm的CDOM吸收系数与叶绿素质量浓度的拟合曲线(椭圆内数据点未参与拟合)Fig.7 Regression curves of chlorophyll concentration as a function of CDOM absorption coefficients atλ440nm
3 结 论
1)在强壮前沟藻的整个生消过程中,各水色组分的吸收贡献有着显著的差异,在始末阶段,以CDOM和非色素颗粒物吸收为主,尤以CDOM吸收贡献最大;但在中间阶段,则以浮游植物吸收为主,约占总吸收的50%,非色素颗粒物次之,约占35%,CDOM最小,仅占15%。
2)在整个生消周期内,浮游植物吸收光谱幅高先增后减,大部分在λ440nm,λ675nm存在2个显著的叶绿素a吸收峰,消亡末期时,藻种细胞内叶绿素a转化为脱镁叶绿素,导致λ440nm吸收峰消失,λ412nm波段出现脱镁叶绿素吸收峰;无论生长期或消亡期,aph(440)和aph(675)与ρ(Chl)均存在正相关关系,但消亡期的拟合曲线高于生长期,所以建立赤潮水体叶绿素质量浓度遥感算法必须考虑生消阶段的差异性问题,从而提高反演精度。
3)非色素颗粒物吸收光谱随波长增加呈现指数衰减趋势,在整个生消周期内,光谱幅高先增后减,ad(440)与ρ(Chl)存在正相关关系,而且生长期和消亡期的拟合曲线非常接近,说明非色素颗粒物吸收与叶绿素质量浓度间关系稳定,且受生消阶段的影响较小,该特征对于叶绿素反演和赤潮判别时非色素颗粒物干扰的有效去除具有重要作用。
4)CDOM吸收光谱随波长增加也呈指数衰减趋势,在整个生消周期内,光谱幅高变化无规律,ag(440)与ρ(Chl)在生长期存在正相关关系,但在消亡期变为负相关关系。因此,基于这一变化规律,利用卫星数据反演CDOM和叶绿素质量浓度后,还可进一步判别赤潮的生消阶段。
(References):
[1] ZHAO D Z.Occurrence regularity of harmful algal blooms in typical ocean of China[M].Beijing:Ocean Press,2010:1-414.赵冬至.中国典型海域赤潮灾害发生规律[M].北京:海洋出版社,2010:1-414.
[2] ZHOU M J,ZHU M Y,ZHANG J.Status of harmful algal blooms and related research activities in China[J].Chinese Bulletin of Life Sciences,2005,13(2):54-61.周名江,朱明远,张经.中国赤潮的发生趋势和研究进展 [J].生命科学,2005,13(2):54-61.
[3] ZHOU M J,YU R C.Mechanisms and impacts of harmful algal blooms and the countmeasures[J].Chinese Journal of Nature,2006,29(2):72-77.周名江,于仁成.有害赤潮的形成机制、危害效应与防治对策 [J].自然杂志,2006,29(2):72-77.
[4] CLEMENTSON L A,PARSLOW J S,TURNBULL A R,et al.Properties of light absorption in a highly coloured estuarine system in south-east Australia which is prone to blooms of the toxic dinoflagellateGymnodiniumcatenatum[J].Estuarine,Coastal and Shelf Science,2004,60:101-112.
[5] ETHERIDGE S M,ROESLER C S.Temporal variations in phytoplankton,particulates,and colored dissolved organic material based on optical properties during a Long Island brown tide compared to an adjacent embayment[J].Harmful Algae,2004,3:331-342.
[6] BAROCIO-LEONÓA,MILLAN-NUÑEZ R,SANTAMARIA-DEL-ÁNGEL E,et al.Bio-optical characteristics of a phytoplankton bloom event off Baja California Peninsula(30°~31°N)[J].Continental Shelf Research,2008,28:672-681.
[7] WANG L,ZHAO D Z,JIANG L L,et al.Scattering characteristics of algaAmphidiniumcareraeHulburt in the cycle of growth and decay[J].Acta Scientiae Circumstantiae,2013,33(1):111-116.王林,赵冬至,姜玲玲,等.强壮前沟藻生消过程中水体的散射特性[J].环境科学学报,2013,33(1):111-116.
[8] WANG G F,CAO W X,YANG Y Z,et al.Variations of absorption coefficient of seawater in the Pearl River Estuary and a hyperspectral retrieval model for an algal bloom[J].Journal of Tropical Oceanography,2010,29(2):52-58.王桂芬,曹文熙,杨跃忠,等.珠江口藻华水体总吸收系数的变化特性及高光谱反演模式[J].热带海洋学报,2010,29(2):52-58.
[9] WANG L,ZHAO D Z,YANG J H,et al.Effects of harmful algal bloom on bio-optical properties of coastal water[J].Environmental Science,2011,32(10):2855-2860.王林,赵冬至,杨建洪,等.赤潮对近岸水体生物光学特性的影响[J].环境科学,2011,32(10):2855-2860.
[10] GALLEGOS C L,JORDAN T.Impact of the spring 2000phytoplankton bloom in Chesapeake Bay on optical properties and light penetration in the Rhode River,Maryland[J].Estuary,2002,25(4A):508-518.
[11] GALLEGOS C L,BERGSTROM P W.Effects of aProrocentrumminimumbloom on light availability for and potential impacts on submersed aquatic vegetation in upper Chesapeake Bay[J].Harmful Algae,2005,4:553-574.
[12] WU J Y.On light absorption properties of southeastern China[D].Xiamen:Xiamen University,2006:1-118.吴璟瑜.中国东南近海光吸收特性研究[D].厦门:厦门大学,2006:1-118.
[13] WU S C,ZHANG Y L,CHEN W M.On the absorptive characteristics ofMicrocystisandScenedesmus[J].Chinese Journal of Ecology,2005,24(7):768-772.吴生才,张运林,陈伟民.微囊藻和栅列藻光吸收特性的实验研究 [J].生态学杂志,2005,24(7):768-772.
[14] HUANG C C,LI Y M,WANG Q,et al.Bio-optical model ofMicrocystisaentginosaandScenedesmusObliquus[J].Journal of Lake Sciences,2010,22(3):357-366.黄昌春,李云梅,王桥,等.铜绿微囊藻和斜生栅藻生物光学模型 [J].湖泊科学,2010,22(3):357-366.
[15] ZHOU H L,ZHU J H,HAN B,et al.Comparison of spectral absorption characteristics of several typical algae[J].Ocean Technology,2010,29(3):78-81.周虹丽,朱建华,韩冰,等.几种典型藻种吸收光谱特性的比较 [J].海洋技术,2010,29(3):78-81.
[16] ZHOU H L,ZHU J H,YANG A A,et al.Analysis ofProrocentrumDonghaienseLu absorb spectral characteristic[J].Ocean Technology,2011,30(1):65-77.周虹丽,朱建华,杨安安,等.东海原甲藻吸收光谱特性分析[J].海洋技术,2011,30(1):65-77.
[17] LIU T Y,KUANG D B,YIN Q.The spectrum experiments of algae and studies on retrieval quantitative imformation from its spectra[J].Journal of Infrared and Millimeter Waves,2002,21(3):213-217.刘堂友,匡定波,尹球.藻类光谱试验及其光谱定量信息提取研究 [J].红外与毫米波学报,2002,21(3):213-217.
[18] MILLIE D F,SCHOFIELD O M,KIEKPATRICK G J,et al.Detection of harmful algal blooms using photopigments and absorption signatures:a case study of the Florida red tide dinoflagellate,Gymnodiniumbreve[J].Limnology and Oceanography,1997,42(5):1240-1251.
[19] WANG L,ZHAO D Z,YANG J H,et al.Total absorption characteristics of algaAmphidiniumcareraeHulburt in growth and decay periods[J].Journal of Tropical Oceanography,2013,32(2):88-93.王林,赵冬至,杨建洪,等.强壮前沟藻AmphidiniumcareraeHulburt生消过程中水体总吸收特性研究[J].热带海洋学报,2013,32(2):88-93.
[20] GUILLARD R R L ,RYTHER J H.Studies of marine planktonic diatoms.—I.CyclotellananaHustedt andDetonulaconfervaceae(Cleve)Gran[J].Can.J.Microbiol.,1962,8:229-239.
[21] HY/T 133-2010Marine industry standards—Determination of spectral absorption coefficient of particles and dissolved material for seawater-Spectrophotometry[S].Beijing:China Standard Press,2010.HY/T 133-2010海洋行业标准—海水中颗粒物和黄色物质光谱吸收系数测量-分光光度法 [S].北京:中国标准出版社,2010.
[22] TREES C C,BIDIGARE R R,KARL D M,et al.Fluorometric chlorophyll a:Sampling,laboratory methods,and data analysis protocols[M].Ocean Optics Protocols for Satellite Ocean Color Sensor Validation,Rev.5,Greenbelt,MD.:NASA Goddard Space Flight Center,2003,5:15-26.
[23] BRICAUD A,BABIN M,MOREL A,et al.Variability in the chlorophyll-specific absorption coefficients of natural phytoplankton:A-nalysis and parameterization[J].J.Geophys.Res.,1995,100(C7):13321-13332.
[24] WANG L,ZHAO D Z,XING X G,et al.The effects of pheophytin on absorption characteristics of phytoplankton[J].Oceanologia Et limnologia Sinica,2009,40(5):596-602.王林,赵冬至,邢小罡,等.脱镁叶绿素对浮游植物吸收特性的影响 [J].海洋与湖沼,2009,40(5):596-602.
