副干酪乳酸菌L1产淀粉酶条件优化及温度、pH对淀粉酶酶活力的影响
2014-09-20,,
,,
(辽宁医学院食品科学与工程学院,辽宁锦州 121000)
副干酪乳酸菌L1产淀粉酶条件优化及温度、pH对淀粉酶酶活力的影响
孙竹萍,张莉力*,王玉田
(辽宁医学院食品科学与工程学院,辽宁锦州 121000)
从酸浆中分离得到的副干酪乳酸菌L1能够与淀粉结合,产生淀粉酶,分解淀粉。本实验研究不同培养条件对副干酪乳酸菌产淀粉酶量以及温度、pH对淀粉酶活力的影响。通过单因素和正交实验对产酶条件进行优化。结果表明:培养基初始pH为4.0、培养温度为42℃、以6%马铃薯淀粉作为碳源、接种量为8%、培养96h时副干酪乳酸菌L1产淀粉酶量最高。副干酪乳酸菌L1产生的淀粉酶在酸性条件下具有较高活性,在pH4.0时淀粉酶活力最高,淀粉酶最适反应温度为40℃,在此条件下淀粉酶活力最高可达102.95U/mL。其中副干酪乳酸菌L1利用不经过糊化淀粉比利用经过糊化淀粉产淀粉酶量高,说明副干酪乳酸菌L1能利用生淀粉产淀粉酶。
副干酪乳酸菌L1,温度,pH,淀粉酶
分解淀粉的乳酸菌是指能够产生淀粉酶,从而分解淀粉的乳酸菌。这类乳酸菌可以直接利用淀粉产生乳酸,现在发现的淀粉分解乳酸细菌主要是从淀粉质原料(谷物和木薯)的发酵食品中分离得到的,包括:食淀粉乳杆菌,嗜淀粉乳杆菌、发酵乳杆菌、植物乳杆菌等[1]。张莉力[2]等从自然发酵的甘薯酸浆中,分离筛选得到一株能够絮凝淀粉的菌株,经鉴定为乳酸菌,并命名为副干酪乳酸菌L1。该菌株能够特异性的结合到淀粉颗粒表面,产生淀粉酶,利用淀粉,使发酵液pH下降。Reddy[3]研究组研究了L.amylophilusGV6的淀粉酶活性,用嗜淀粉乳酸菌GV6发酵麦糠,研究GV6产生的直链淀粉酶和支链淀粉酶活力,研究表明在pH6.5,温度37℃时淀粉酶活性最大,直链淀粉酶和支链淀粉酶的活性分别为0.439U/(g·min)和0.18U/(g·min)。Basa Janakiram Naveena[4]研究L.amylophilusGV6在生的小麦淀粉作碳源的半固体培养基中发酵产淀粉酶,在pH6.5,温度37℃发酵130h,产生淀粉酶最多。乳酸是一种应用非常广泛的有机酸,传统乳酸生产方法称为两步法,首先用淀粉酶将淀粉水解成葡萄糖,再利用乳酸菌发酵葡萄糖产生乳酸。随着乳酸使用量的增大,传统的两步法生产乳酸因成本较高且工艺复杂,逐渐不能满足市场的供应。所以国内外学者开始研究一步法生产乳酸,即将淀粉酶水解和葡萄糖发酵耦合。在一步法发酵乳酸过程中,淀粉酶活力是一个重要的指标。由于一步法发酵乳酸的研究比较少,只有国外的研究者针对嗜淀粉乳酸菌进行了研究,本文对副干酪乳酸菌L1菌株产淀粉酶的条件优化以及酶活与pH、温度的关系进行研究,为一步法发酵乳酸提供实验依据。
1 材料与方法
1.1材料与仪器
副干酪乳酸菌L1 辽宁医学院食品科学与工程学院微生物实验室提供;改良TJA培养基 番茄汁50mL,酵母浸出物5g,牛肉膏10g,乳糖20g,可溶性淀粉2g,K2HPO42g,吐温80 1g,乙酸钠5g,水加至1000mL,pH6.00±0.20;淀粉培养基 可溶性淀粉1g,蛋白胨1g,葡萄糖0.5g,NaCl 0.5g,牛肉膏0.5g,琼脂粉0.8g;产酶培养基 将改良TJA培养基中的乳糖换为马铃薯淀粉,发酵过程中加入少量CaCO3。
高压灭菌锅 BKFI-HJK型北京中西远大科技有限公司;电子分析天平M4-AL204型 兰州中西仪器;恒温培养箱DHP-9082型 金坛市鑫鑫实验仪器厂;水浴锅DK-98-l型 天津泰斯特仪器公司;超净工作台JB-VS-1300型 苏州佳宝净化工程设备有限公司;pH测定计DHP-9052型 上海一恒科技有限公司;数码生物显微镜 ME2I OLYMPUS;722可见光分光光度计 上海精密科学仪器有限公司。
1.2发酵方法
将副干酪乳酸菌L1由试管斜面接种于TJA培养基中进行活化,35℃培养48h,至菌体密度为108个/mL。
1.3产酶初检
将活化的副干酪乳酸菌L1用滴种法接种在淀粉培养基上,35℃培养48h,采用碘液染色[5],若在菌落周围有透明圈产生,证明副干酪乳酸菌L1能够产淀粉酶。
1.4淀粉酶活力测定
1.4.1 粗酶液的制取 将活化的菌按7%的接种量接种于产酶培养基中培养。离心5000r/min,15min,收集上清液,为待测粗酶液。
1.4.2 酶活测定方法[6]1%底物溶液:称取马铃薯淀粉1.0g,用25mL 0.4mol/L的NaOH溶液溶解,在沸水浴中加热10min,待其冷却后加入25mL 0.4mol/L的CH3COOH溶液,调节pH至7.0,然后定容在100mL容量瓶中。
取10mL底物溶液于试管中,40℃水浴预热10min后,取1mL发酵液加入其中,摇匀,然后40℃精确保温10min。吸取1mL于盛有10mL 0.1mol/L HCl的试管中,再取0.5mL混合液于盛有10mL 0.005%碘液的试管中,摇匀,并立即用分光光度计测其在660nm处吸光度。用同样方法测定空白值D0,用以1.0mL的不含菌的培养基代替发酵液,其余步骤同上。用蒸馏水作为参比。
酶活定义:将淀粉酶单位定义为在上述测定条件下,反应1min使1%马铃薯淀粉溶液的显蓝强度降低1%所需的酶量为1个单位。
酶活=(D0-D)×100×发酵液稀释倍数/(D0×10)
式中,D0为空白值吸光度,D为样品吸光度,100为系数(%),10为反应时间(min)。每个单因素实验中,以酶活最高值为100%,计算相对酶活。
1.5单因素实验
1.5.1 培养基pH对菌株产淀粉酶的影响 以不同pH的缓冲溶液配制pH分别为2、3、4、5、6、7、8、9、10产酶培养基,115℃灭菌15min,冷却后按7%接种量接种后,放在40℃培养箱中培养96h后,取样测定淀粉酶活力。
1.5.2 培养温度对菌株产淀粉酶的影响 将以灭菌含有等量产酶培养基的三角瓶按7%的接种量接种后,放在温度分别为35、40、45、50℃的条件下培养96h后,取样测定淀粉酶活力。
1.5.3 不同碳源及是否糊化对菌株产淀粉酶的影响 分别用可溶性淀粉、玉米淀粉、甘薯淀粉、马铃薯淀粉作为碳源配制产酶培养基,分装于三角瓶中灭菌,冷却后,按7%的接种量接种,放在40℃培养箱中培养96h,取样测定淀粉酶活力。称取不同种类淀粉于105℃的干燥培养箱中灭菌24h后,在无菌条件下加入到不含碳源的已灭菌的产酶培养基中,按7%的接种量接种后,放在40℃培养箱中培养96h后,取样测定淀粉酶活力。
1.5.4 含碳量对菌株产淀粉酶的影响 称取不同质量的马铃薯淀粉配制成淀粉含量分别为1%、2%、4%、6%、8%的产酶培养基,分装于三角瓶中灭菌,冷却后,按7%的接种量接种,放在40℃培养箱中培养96h后,取样测定淀粉酶活力。
1.5.5 接种量对菌株产淀粉酶的影响 将以灭菌含有等量产酶培养基的三角瓶,按5%、7%、9%、11%接种量接种后,放在40℃培养箱中培养96h,取样测定淀粉酶活力。
1.5.6 培养时间与菌株产淀粉酶的关系 将以灭菌含有等量产酶培养基的三角瓶按7%的接种量接种后,放在40℃培养箱中培养,每隔24h取样测淀粉酶活力。
1.6产酶条件的优化
根据单因素实验结果,选取温度、pH、接种量,进行正交实验。选取温度分别为37、40、42、45℃,pH分别3.5、4.0、4.5、5.0,接种量分别为6.0%、7.0%、8.0%、9.0%,以副干酪乳酸菌L1产淀粉酶活力为指标,确定产酶量最高时的温度、pH以及接种量(v/v)。
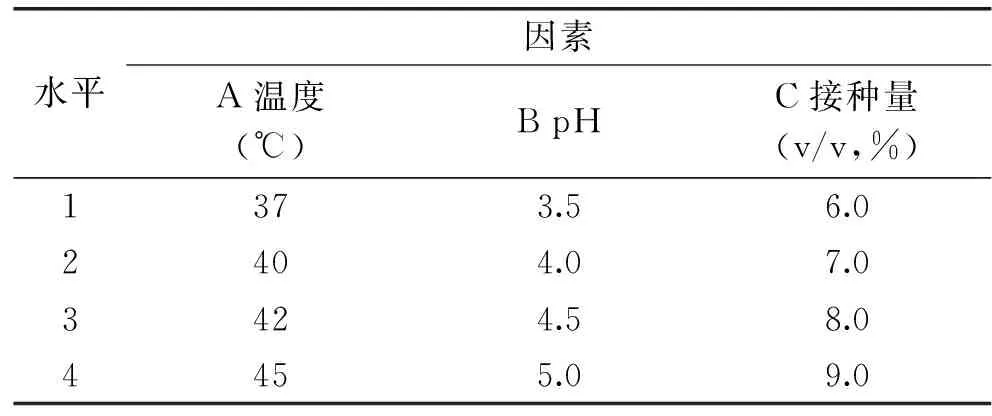
表1 L16(4×3)正交实验因素水平表
1.7酶学性质的研究
1.7.1 最适反应温度 将粗酶液于不同温度下测其淀粉酶活力,将淀粉酶活力最高的定义为相对酶活100%。
1.7.2 最适反应pH 用1mol/L盐酸和1mol/L NaOH调节粗酶液的pH,测不同pH条件下淀粉酶活力。
1.8数据分析
每个条件做3个平行样,每个样品测定3次,取平均值。用SPSS13.0进行数据分析,Excel 2003作图。
2 结果与分析
2.1副干酪乳酸菌L1产淀粉酶初检
由图1可知经碘液染色法初检,副干酪乳酸菌L1菌落周围有透明圈产生,说明副干酪乳酸菌L1能产生淀粉酶分解淀粉。
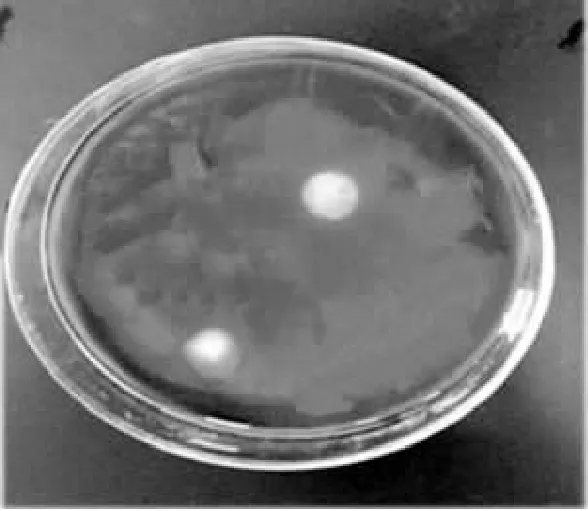
图1 碘液染色初检
2.2单因素实验结果
2.2.1 培养基pH对菌株产淀粉酶的影响 由图2可知,副干酪乳酸菌L1在不同pH条件下都能产淀粉酶,产酶量较高集中在pH为3.0、4.0、5.0。当培养基初始pH为4.0时相对酶活为100%,其次为pH为3.0时,相对酶活为85.41%。当pH为10.0时产酶量最低,相对酶活为15.26%。当初始培养基pH大于6.0时,随pH变大,酶活迅速降低。培养基pH对副干酪乳酸菌L1产淀粉酶的影响呈现单峰现象,大多数文献记载微生物发酵无论产生酸性、中性还是碱性淀粉酶,培养基的初始pH与微生物产淀粉酶的量都呈单峰型[7-8]。副干酪乳酸菌L1在pH4.0时产酶量达到峰值。

图2 培养基初始pH对L1菌株产淀粉酶的影响
2.2.2 培养温度对菌株产淀粉酶的影响 由图3可知,副干酪乳酸菌L1菌株在不同培养温度下培养,低于40℃时,随温度升高产酶量升高,以40℃相对酶活为100%,高于40℃温度,产酶量下降。35℃的相对酶活比40℃低28.8%,差异极显著(p<0.01)。
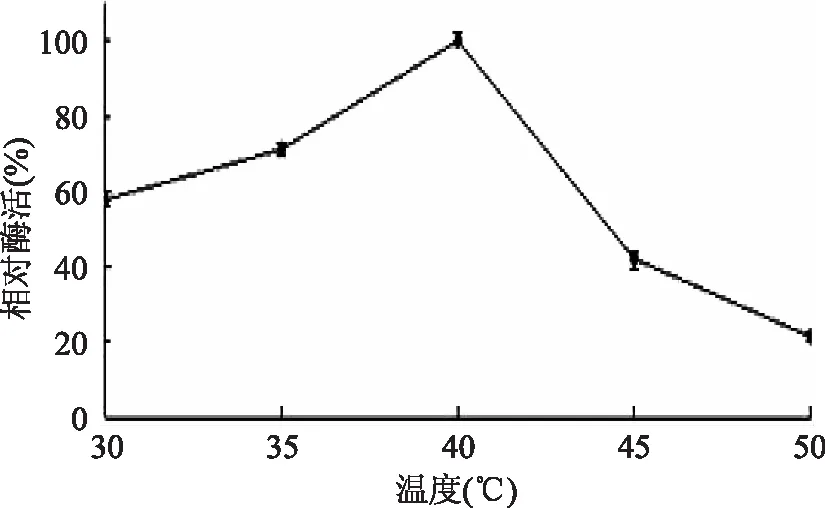
图3 培养温度对L1菌株产淀粉酶的影响
2.2.3 不同碳源及是否糊化对菌株产淀粉酶的影响 由图4可知,当淀粉被糊化时,以甘薯淀粉为碳源,副干酪乳酸菌L1产酶量最高,可溶性淀粉,玉米淀粉,马铃薯淀粉都可作为有效碳源刺激副干酪乳酸菌L1产淀粉酶,马铃薯淀粉作为碳源产酶量最低。当淀粉不被糊化,以马铃薯淀粉为碳源产酶量最高,酶活为69.56U/mL,其次是甘薯淀粉、可溶性淀粉、玉米淀粉。结果表明:除可溶性淀粉外,同一种类淀粉未糊化比淀粉糊化酶活高,证明了副干酪乳酸菌L1能利用生淀粉产淀粉酶。选择马铃薯淀粉作为碳源,副干酪乳酸菌L1产酶量最高。

图4 淀粉种类和糊化度对L1菌株产淀粉酶的影响
2.2.4 淀粉含量对菌株产淀粉酶的影响 以马铃薯淀粉作为碳源,不同淀粉含量对副干酪乳酸菌L1产淀粉酶量的影响如图5所示。随淀粉含量升高,副干酪乳酸菌L1产淀粉酶量升高,当淀粉添加量为6%时,测得相对酶活为100%,当淀粉含量超过6%时,产酶量降低,淀粉含量8%时,相对酶活为76.55%。结果证明:较高的淀粉含量不但不会促进副干酪乳酸菌L1菌产淀粉酶,反而抑制L1产淀粉酶,这可能是由于菌利用淀粉的效率被积累的糊精所限制,因而不能进一步发酵,因此菌的生长和淀粉酶的合成受到限制[9]。

图5 淀粉含量对L1菌株产淀粉酶的影响
2.2.5 接种量v/v对菌株产淀粉酶的影响 由图6可知,当接种量7%为时,副干酪乳酸菌L1产淀粉酶相对酶活为100%。当接种量超过7%,随接种量的升高,相对酶活下降。结果证明:较大接种量可以缩短微生物前期的发酵时间,但是如果接种量过大则会引起菌丝的大量繁殖,使菌生长所需的养料和氧气不足,干扰菌的正常代谢[10]。也可能因为菌丝生长过快产生的代谢产物过多从而影响产淀粉酶。接种量过低,则发酵时,菌株生长需较长时间才能进入平稳期,所以发酵培养96h淀粉酶的累积不能达到最大值。

图6 接种量对L1菌株产淀粉酶的影响
2.2.6 培养时间与菌株产淀粉酶的关系 由图7可知,副干酪乳酸菌L1在40℃培养条件下,培养96h,淀粉酶活力为98.78U/mL,淀粉酶相对酶活100%,培养超过96h,随培养时间淀粉酶活力降低。培养到72h时,酶活略有下降,发酵液的pH由6.00下降到4.34,可能是发酵液pH下降,抑制了淀粉酶活力,而发酵到96h,由于CaCO3的加入中和掉一部分酸,使发酵液pH升高,淀粉酶活力增加。研究发现其他分解淀粉的乳酸菌[11-12]的产酶活力范围在6~21U/mL,副干酪乳酸菌L1产淀粉酶活力明显高于其他菌株。

图7 培养时间对L1菌株产淀粉酶的影响
2.3正交实验结果分析
为了优化副干酪乳酸菌L1产淀粉酶的培养条件,根据表1进行正交实验。测定不同处理组L1产淀粉酶活力,结果如表2所示。比较三种因素的R值大小可知,RA>RC>RB,即培养温度是主要因素,其次是接种量,pH对L1产淀粉酶影响最小。由极差分析结果得出最优条件为,A3B2C3即温度42℃,pH4.0,接种量8%。并由此条件培养副干酪乳酸菌L1测淀粉酶活力为102.95U/mL。为确定各因素对实验结果的影响,对正交实验结果进行方差分析,结果如表4所示:温度、接种量对产淀粉酶量的影响显著(p<0.05)。pH对副干酪乳酸菌L1产淀粉酶量的影响不显著(p>0.05)。
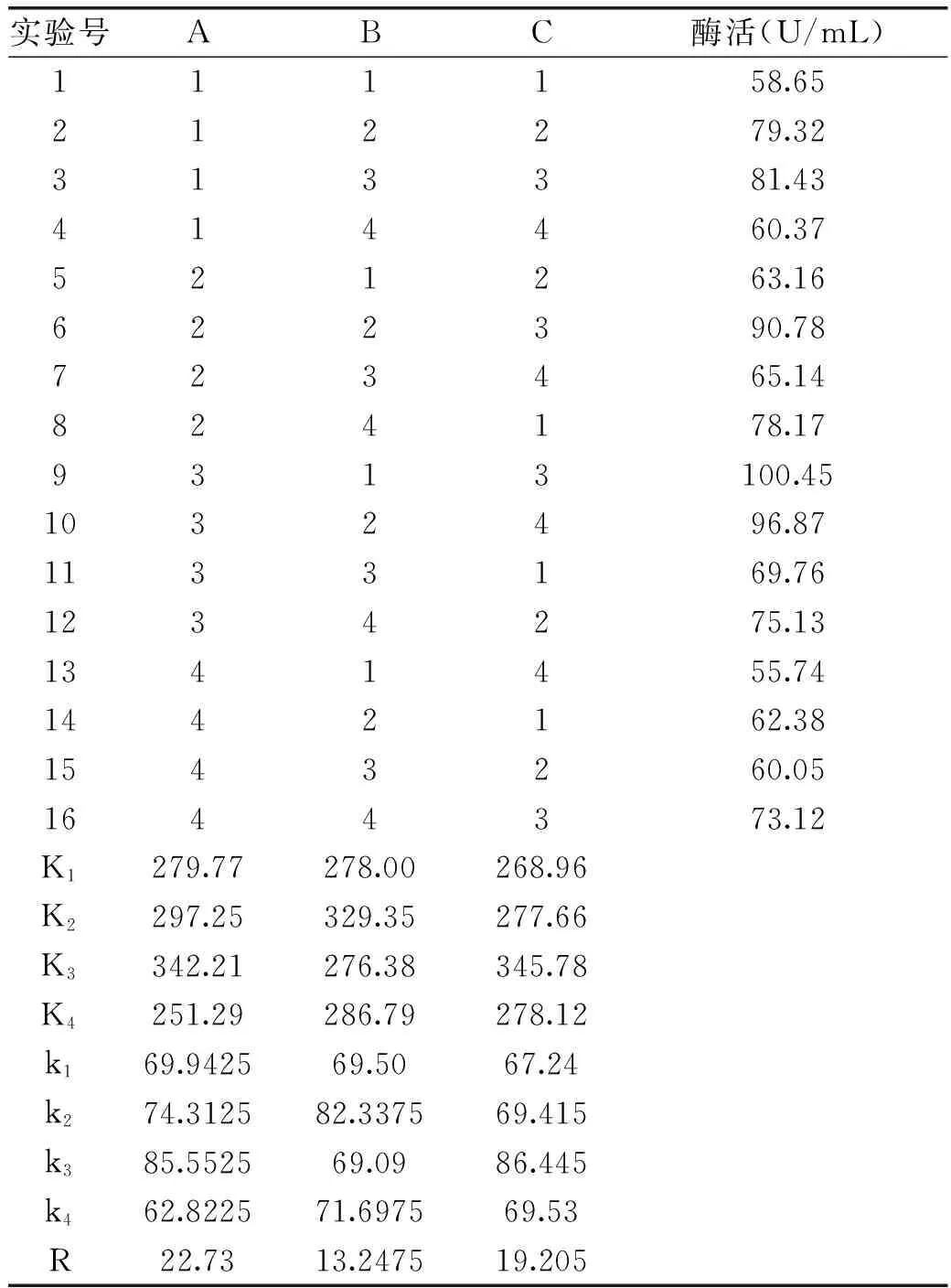
表2 不同条件下酶活正交实验结果

表3 主效应的方差分析
注:R2=0.867(调整后R2=0.667);p<0.05,差异显著。
2.4酶学性质
2.4.1 温度对淀粉酶活力的影响 以pH7的缓冲溶液配制的副干酪乳酸菌L1产淀粉酶的粗酶液,在不同温度下测淀粉酶活力,结果如图8所示:温度在30~40℃时,副干酪乳酸菌L1产生的淀粉酶活力随温度升高而升高,40℃淀粉酶相对酶活达到100%,温度超过40℃随温度升高,淀粉酶活力下降,45℃相对酶活为97.51%,差异性不显著(p<0.01)。30℃和50℃时相对酶活较低,分别为39.01%,53.09%。结果表明:副干酪乳酸菌L1产生的淀粉酶为中性淀粉酶,高温会使酶活降低。Penka Petrova[13]在实验中测得副干酪乳杆菌B41淀粉酶活力在45℃最高,37℃时相对酶活为83.33%,高于56℃相对酶活降到61.67%。M. Hujanen[14]研究干酪乳杆菌NRRL B-441产淀粉酶最适温度为35℃。
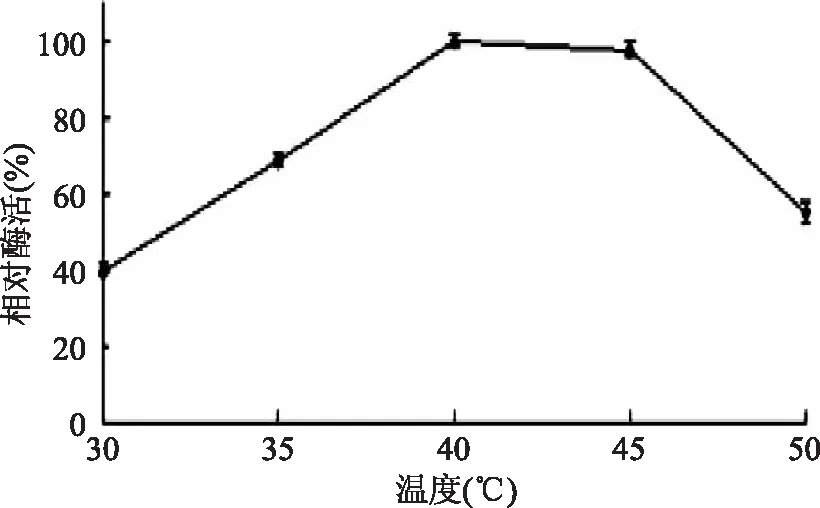
图8 反应温度对淀粉酶活力的影响
2.4.2 pH对淀粉酶活力的影响 不同pH粗酶液测得淀粉酶活力,如图9所示:在pH为4.0时淀粉酶相对酶活为100%,当pH高于4.0时淀粉酶活力下降,当pH为10.0时淀粉酶活力最低,相对酶活为32.34%。副干酪乳酸菌L1产生的淀粉酶活性在酸性条件下较高,pH为3.0时相对酶活为88.34%,与pH4时差异性极显著(p<0.01)。结果表明:副干酪乳酸菌L1产生的淀粉酶在酸性条件下酶活力较好。多数文献报道微生物产淀粉酶也多为酸性淀粉酶,最适pH4.0~5.0[15-16],陈波等[17]分离得到产酸性α-淀粉酶的菌株,该淀粉酶最适pH为4.4,pH大于7,淀粉酶活力迅速降低,与本实验测得结果基本相同。
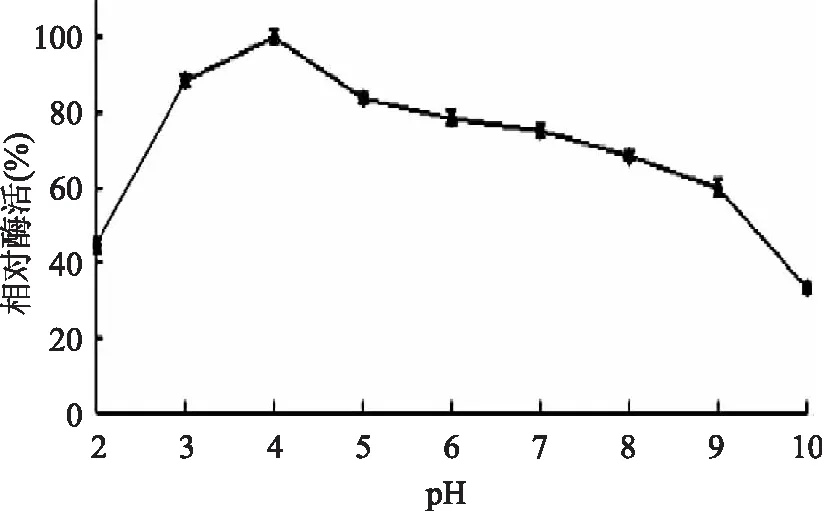
图9 反应pH对淀粉酶活力的影响
3 结论
副干酪乳酸菌L1在改良TJA培养基中,淀粉作为唯一碳源,发酵产生淀粉酶。产淀粉酶最佳条件为发酵培养基初始pH4.0,淀粉含量6%,以浓度为108个/mL菌悬液接种,接种量为8%,42℃条件下培养,96h产酶量最大,淀粉酶活性最高为102.95U/mL。
副干酪乳酸菌L1产生的淀粉酶为低温淀粉酶,酶活最适反应温度为40℃,L1产生的淀粉酶不耐高温,可能因为产生的β-淀粉酶较多。淀粉酶反应最适pH为4.0,属于酸性淀粉酶。
副干酪乳酸菌L1能产生淀粉酶,分解利用淀粉,产生还原糖,为分解淀粉乳酸细菌(Amylolyticlactic acid bacteria,ALAB)发酵一步法发酵产乳酸提供可能性。研究发现L.amylophilusGV6是最有潜力利用淀粉质原料一步法发酵乳酸的菌。C.Vishnu[18]计算L.amylophilusGV6在以甘薯淀粉为碳源的液态培养基中产生胞外淀粉水解酶,包括直链淀粉酶和支链淀粉酶,直链淀粉酶和支链淀粉酶的活性分别为0.59U/(g·min)和340U/(mL·min),最高酶活时温度为37℃,pH6.5。与L.amylophilusGV6相比,副干酪乳酸菌L1有较高的产淀粉酶酶活力,所以该菌株可能会利用淀粉一步发酵产乳酸。
[1]郭兴华.益生乳酸细菌-分子生物学及生物技术(应用生物技术大系)[M].北京:科学出版社,2008:68.
[2]张莉力,许云贺,李新华.对甘薯淀粉具有絮凝活性的乳酸菌的分离鉴定及其特性研究[J].食品科学,2010(7):228-231.
[3]Altaf M,Naveena B J,Reddy G. Use of inexpensive nitrogen sources and starch for L(+)lactic acid production in anaerobic submerged fermentation[J]. Bioresource Technology,2007,98(3):498-503.
[4]Naveena B J,Altaf M,Bhadrayya K,etal. Production of L(+)lactic acid byLactobacillusamylophilus GV6 in semi-solid state fermentation using wheat bran[J]. Food Technology and Biotechnology,2004,42(3):147-152.
[5]刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006:190-191.
[6]张丽苹,徐岩.酸性α-淀粉酶生产菌株的选育的初步研究[J].工业微生物,2002,32(4):11-14.
[7]张金伟,曾润颖.产复合酶菌株Pseudomonassp.NJ197产酶发酵条件的研究[J].台湾海峡,2005,24(4):520-525.
[8]赵建,兰小君,苏俊,等. 一株碱性淀粉酶产生菌Bacillusflexus XJU-3的分离鉴定及酶学特性分析(英文)[J]. 微生物学报,2008,06:750-756.
[9]Calderon Santoyo M,Loiseau G,Rodriguez Sanoja R,etal. Study of starch fermentation at low pH byLactobacillusfermentum Ogi E1 reveals uncoupling between growth and α-amylase production at pH 4.0[J]. International Tournal of Food Microbiology,2003,80(1):77-87.
[10]邵伟,谈玉,唐明,等.红曲霉产淀粉酶特性研究[J].中国酿造,2006,(7):25-27.
[11]Agati V,Guyot J P,Morlon‐Guyot J,etal. Isolation and characterization of new amylolytic strains ofLactobacillusfermentum from fermented maize doughs(mawe and ogi)from Benin[J]. Journal of Applied Microbiology,1998,85(3):512-520.
[12]Petrova P,Emanuilova M,Petrov K. Amylolytic Lactobacillus strains from Bulgarian fermented beverage boza[J]. Zeitschrift für Naturforschung. C,Journal of biosciences,2010,65(3-4):218.
[13]Diaz-Ruiz G,Guyot J P,Ruiz-Teran F,etal. Microbial and physiological characterization of weakly amylolytic but fast-growing lactic acid bacteria:a functional role in supporting microbial diversity in pozol,a Mexican fermented maize beverage[J]. Applied and Environmental Microbiology,2003,69(8):4367-4374.
[14]Songré-Ouattara L T,Mouquet-Rivier C,Icard-Vernière C,etal. Enzyme activities of lactic acid bacteria from a pearl millet fermented gruel of functional interest in nutrition[J]. International Journal of Food Microbiology,2008,128(2):395-400.
[15]Petrova P,Petrov K. Direct starch conversion into L-(+)-lactic acid by a novel amylolytic strain ofLactobacillusparacaseiB41[J]. Starch-Stärke,2012,64(1):10-17.
[16]Hujanen M,Linko S,Linko Y Y,etal. Optimisation of media and cultivation conditions for L(+)(S)-lactic acid production byLactobacilluscaseiNRRL B-441[J]. Applied Microbiology and biotechnology,2001,56(1-2):126-130.
[17]新迎,高梅莹,韩丹,等.耐酸性α-淀粉酶产生菌筛选及培养基优化[J].中国酿造,2010(4):85-88.
[18]胜英,岑晓江,闫丽娟,等. 白曲霉产中温酸性α-淀粉酶固体发酵条件及粗酶酶学性质的研究[J]. 食品科技,2010(5):6-10.
[19]陈波,李大力,杨树林,等.酸性α-淀粉酶生产菌株的筛选和酶的纯化及酶的性质研究[J].食品科学,2005,26(5):119-122.
[20]C Vishnu,B J Naveena,Md Altaf,et al. Amylopullulanase-A novel enzyme of L. amylophilus GV6 in direct fermentation of starch to L(+)lactic acid[J].Enzyme and Microbial Technology,2006,38(3-4):545-550.
Amylase fromLactobacillusparacaseiL1:Optimization of its fermentation condition and reaction temperature and pH
SUNZhu-ping,ZHANGLi-li*,WANGYu-tian
(Food Science and Engineering College,Liaoning Medical University,Jinzhou 121000,China)
LactobacillusparacaseiL1 which isolated from the sweet potato acid steeping liquor could combine with the starch to produce amylase and resolve the starch. This experiment was to study the effect of different culture condition on the production of amylase and the effect of temperature and pH to the activity of amylase. Through single factor and orthogonal experiments,the condition of enzyme production was optimized. The results showed that theLactobacillusparacaseiL1 could produce the highest amount of amylase when the initial culture medium pH was 4.0,culture temperature was 42℃,6% of potato starch was taken as carbon resource and when it was cultured 96h. The amylase produced byLactobacillusparacasiL1 has relevant high activity under acidic conditions. The amylase activity was highest when the pH was 4.0,and the optimum reaction temperature for the amylase was 40℃.Under this conditions,the highest activity of amylase could reach 102.95U/mL.LactobacillusparacaseiL1 which used starch without gelatinizing could produce more amylase than which of using starch with gelatinizing. That meansLactobacillusparacaseiL1 could use raw starch to produce amylase.
LactobacillusparacaseiL1;temperature;pH;amylase activity
2013-06-14 *通讯联系人
孙竹萍(1988-),女,硕士,研究方向:食品微生物。
国家自然科学基金项目(31301499);辽宁医学院博士教师科研启动基金项目(2011B11)。
TS201.3
:A
:1002-0306(2014)01-0144-06
