林蛙油蛋白中性蛋白酶水解物促进脾细胞和巨噬细胞功能
2014-09-20,,,,,,*,
, ,,, ,,*,
(1.北京林业大学生物科学与技术学院食品科学与工程系,北京100083; 2.林业食品加工与安全北京市重点实验室(北京林业大学),北京 100083)
林蛙油蛋白中性蛋白酶水解物促进脾细胞和巨噬细胞功能
郭淼1,2,崔犁1,2,翟梦新1,2,张世欣1,2,汪涛1,2,许美玉1,2,*,翁强1,2
(1.北京林业大学生物科学与技术学院食品科学与工程系,北京100083; 2.林业食品加工与安全北京市重点实验室(北京林业大学),北京 100083)
用盐析法结合超声波破碎细胞处理技术,从林蛙油中提取蛋白,并用中性蛋白酶制备林蛙油蛋白酶水解物。通过小鼠脾淋巴细胞增殖实验、脾淋巴细胞分泌白细胞介素-2水平、巨噬细胞吞噬中性红实验及巨噬细胞体外释放NO实验,研究林蛙油、林蛙油蛋白及其中性蛋白酶水解物对脾细胞和巨噬细胞功能的影响。研究结果发现,林蛙油、林蛙油蛋白及其中性蛋白酶水解物均对脾淋巴细胞及巨噬细胞的免疫功能具有不同程度的促进作用,其中林蛙油蛋白中性蛋白酶水解物显示较显著的促进作用(p<0.01)。其中性蛋白酶水解物可分别增强脾淋巴细胞增殖、脾淋巴细胞分泌白细胞介素-2、巨噬细胞吞噬功能及巨噬细胞产生NO功能达19.3%、104.8%、109.1%及34.9%。以上结果表明,林蛙油蛋白的中性蛋白酶水解物可显著提高脾淋巴细胞和巨噬细胞功能(p<0.01)。
林蛙油蛋白,中性蛋白酶水解物,脾淋巴细胞,巨噬细胞,免疫功能
林蛙油(Oviductus Ranae),是我国特有的保健食品,为中国林蛙雌性输卵管的干制品,其外观呈淡黄色半透明状,并带有一定的油质性[1-2]。有研究表明,林蛙油可调节机体免疫功能,例如增强小鼠的迟发型变态反应,增加免疫器官重量,提高单核巨噬细胞的吞噬功能和淋巴细胞增殖能力等[2-3]。然而,林蛙油中具有调节免疫功能的活性成分,尚不清楚。近年来的研究表明,食物蛋白或蛋白酶水解物具有调节免疫功能生物活性,如云芝中的TVC蛋白,乳蛋白的酶解产物等[4-5]。林蛙油富含蛋白质,其含量高达50%以上[6]。林蛙油蛋白是否也具有免疫调节功能,是一个非常值得探讨的课题。因机体免疫是由免疫器官和组织、免疫细胞和免疫分子组成的一个复杂的功能整体[7]。本项研究选择机体重要的免疫细胞,脾淋巴细胞和巨噬细胞,主要在体外层面研究林蛙油蛋白及其酶水解物对免疫细胞功能的影响。该研究结果,对阐明林蛙油免疫调节功能的活性成分,将提供重要的科学依据,对林蛙油的有效利用及深加工具有重要的意义。
1 材料与方法
1.1材料与仪器
林蛙油 吉林,冷冻样品;中性蛋白酶 Sigma公司产品,美国;清洁级昆明小鼠 8周龄,雄性,北京大学医学部实验动物科学部;小鼠巨噬细胞RAW 264.7系 中国医学科学院基础医学研究所细胞资源中心;小鼠白介素2(IL-2)酶联免疫试剂盒 CUSABIO;一氧化氮检测试剂盒 上海碧云天生物技术研究所。
酶标仪 BIO-RAD。
1.2实验方法
1.2.1 林蛙油蛋白提取 将林蛙油剪碎,按1∶10的比例加入0.01mol/L的PBS缓冲液,用超声波破碎细胞15min,在冰浴下进行间隙冷却(30s∶30s),于4℃、8000r/min离心20min,吸取上清液。缓慢加入固体硫酸铵,至其饱和度达到95%(25℃),静置一段时间,以确保沉淀完全,于4℃、8000r/min离心20min,收集沉淀,透析并真空冷冻干燥。蛋白质提取率(%)=所提取的蛋白质量(g)/林蛙油中蛋白质含量(g)×100。
1.2.2 林蛙油蛋白中性蛋白酶水解物制备 将林蛙油蛋白按1∶10的比例溶于水中,90℃保温10min,调节至中性蛋白酶的最适温度55℃和pH7.5条件下,加入蛋白酶酶解3h,然后调节pH至中性,95℃下加热10min灭活酶,离心取上清液,真空冷冻干燥得到林蛙油蛋白的中性蛋白酶水解物[8]。
1.2.3 脾淋巴细胞增殖实验 小鼠眼球放血,脱颈处死,于无菌状态下取脾,制备脾淋巴细胞悬浮液[9-10]。台酚蓝染色法计数细胞,存活率为90%以上。RPMI1640完全培养基调节细胞浓度为5×106cells/mL铺板,向96孔板中加入脾淋巴细胞悬液100μL/well,37℃、5%的CO2培养箱适应性培养4h。每孔加入100μL溶于完全培养基的待测样品(林蛙油、林蛙油蛋白及其中性蛋白酶水解物,浓度500μg/mL),每个待测样品设置4个复孔,培养48h。每孔加入10μL的噻唑兰(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)溶液(5mg/mL),继续培养4h。小心吸弃每孔上清液150μL。每孔加入150μL的二甲基亚砜(DMSO)溶液,摇板20min。酶联免疫检测仪570nm测定各孔吸光值OD[11-12]。以常用丝裂原Con A(10μg/mL)作为阳性对照。
1.2.4 小鼠脾细胞分泌白细胞介素2(IL-2)水平测定 按1.2.2方法制备小鼠脾淋巴细胞悬浮液,调节细胞浓度为1×106cells/mL,向96孔板中加入脾淋巴细胞悬液100μL/well,培养4h。每孔加入100μL待测样品,每个待测样品设置4个复孔,培养48h。吸取上清液100μL,-20℃保存待测[12]。按小鼠IL-2酶联免疫试剂盒说明书方法测定上清液中IL-2含量,以Con A作为阳性对照。
1.2.5 巨噬细胞吞噬中性红实验 用DEME-高糖完全培养基调节细胞浓度为3×105cells/mL铺板,向96孔板中加RAW264.7细胞悬液100μL/well,培养3h。吸弃上清液,每孔加入100μL溶于完全培养基的待测物,培养48h。加入100μL中性红溶液(浓度为0.075%,溶解在10mmol/L的PBS中,使用前用0.22μm滤膜过滤)并培养3h。弃去上清液,用PBS洗板2次,以除去没有被巨噬细胞吞噬的中性红。接着加入100μL细胞裂解液(乙醇和0.01%的乙酸比例为1∶1配制)以裂解细胞,室温下过夜。用酶标仪在540nm处测定吸光度值[12-13]。
1.2.6 巨噬细胞体外NO释放实验 RAW 264.7小鼠巨噬细胞以5×105cells/well接于96孔板中,37℃培养4h。吸弃上清液,每孔中加入含有2μg/mL的脂多糖(LPS)和样品蛋白的完全培养基100μL/well,在37℃下培养20h[4]。收集上清液按照一氧化氮检测试剂盒说明书测定。
1.2.7 统计学分析 所有数据均以平均值±标准偏差表示,用t检验法比较差异,p<0.05为统计学上显著性差异,p<0.01为极显著性差异。
2 结果与分析
2.1林蛙油蛋白及其中性蛋白酶水解物对脾淋巴细胞增殖的影响
淋巴细胞是机体最重要的免疫细胞,脾脏是机体最大的免疫器官,占全身淋巴组织总量的25%,储存大量的T淋巴细胞和B淋巴细胞,通过检测待测物对脾淋巴细胞增殖的影响,可最直接的反映其对免疫功能的影响[14]。本研究首先以PBS缓冲液为提取剂,用盐析法从林蛙油中提取蛋白,提取率为35.13%(用凯氏定氮法测定干燥的林蛙油中蛋白含量为56.15%)。通过MTT细胞增殖分析实验,在500μg/mL浓度水平,研究林蛙油、林蛙油蛋白及林蛙油蛋白中性蛋白酶水解物对小鼠脾淋巴细胞增殖的影响,结果三者均具有一定促进增殖作用(见图1)。与空白对照相比,林蛙油、林蛙油蛋白及林蛙油蛋白酶水解物,可分别提高脾淋巴细胞的活细胞数量达5.7%、9.1%及19.3%,其中林蛙油蛋白及其蛋白酶水解物的促进效果显著(见图1,p<0.05)。以上结果表明,林蛙油蛋白中性蛋白酶水解物较显著促进脾淋巴细胞增殖。
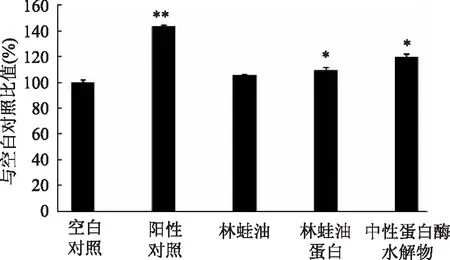
图1 林蛙油蛋白及其中性蛋白酶水解物 对小鼠脾淋巴细胞增殖的影响
2.2林蛙油蛋白及其中性蛋白酶水解物对脾淋巴细胞分泌IL-2的影响
淋巴细胞除了本身发挥免疫功能之外,还分泌免疫分子白细胞介素-2(IL-2)。IL-2是T淋巴细胞的生长因子,并可促进活化B淋巴细胞增殖,是机体免疫调节网络中的核心物质[6]。检测林蛙油、林蛙油蛋白及其中性蛋白酶水解物,对小鼠脾细胞分泌IL-2的影响,结果表明均具有一定促进作用(见图2)。用不含实验样品的培养基培养的脾淋巴细胞(对照组)分泌IL-2含量为21.23pg/mL,用分别含500μg/mL的林蛙油、林蛙油及其酶水解物的培养基培养的脾淋巴细胞,分泌IL-2含量分别为32.35、40.60和43.48pg/mL。林蛙油对小鼠脾细胞分泌IL-2具有一定的促进作用,但效果并不显著,林蛙油蛋白具有显著的促进效果(p<0.05),林蛙油蛋白的中性蛋白酶水解物的促进作用极显著(p<0.01),与对照组相比增加104.8%(见图2)。以上结果表明,林蛙油蛋白中性蛋白酶水解物具有较显著促进脾细胞分泌IL-2作用。
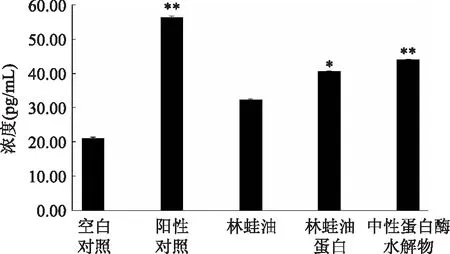
图2 林蛙油蛋白及其中性蛋白酶水解物 对小鼠脾细胞分泌IL-2水平的影响
2.3林蛙油蛋白及其中性蛋白酶水解物对巨噬细胞吞噬功能的影响
巨噬细胞分布最为广泛,是重要的机体免疫系统的细胞,具有吞噬、杀伤、分泌生物活性物质及抑制肿瘤等多方面功能,其吞噬功能是免疫系统维持自身内环境稳定的重要手段[15]。RAW264.7细胞系是小鼠单核巨噬细胞白血病细胞,可通过细胞对中性红的吞噬量来反映吞噬能力的。用含林蛙油、林蛙油蛋白及其中性蛋白酶酶水解物(浓度为500μg/mL)的完全培养基,培养小鼠巨噬细胞48h后,测定巨噬细胞吞噬中性红染液的能力,结果表明三者均促进巨噬细胞吞噬功能(见图3)。与空白对照组相比,林蛙油、林蛙油蛋白及其中性蛋白酶酶水解物,可提高巨噬细胞吞噬能力分别达24.7%、46.2%和109.1%,表明林蛙油可促进巨噬细胞吞噬功能,但效果不显著,林蛙油蛋白的促进作用显著(p<0.05),林蛙油蛋白中性蛋白酶水解物的促进作用极显著(p<0.01)。以上结果表明,林蛙油蛋白中性蛋白酶水解物较显著促进巨噬细胞吞噬功能。
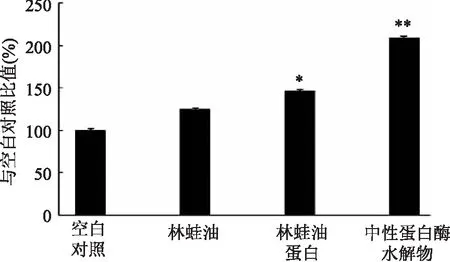
图3 林蛙油蛋白及其中性蛋白酶水解物 对RAW264.7细胞的吞噬能力的影响
2.4林蛙油蛋白及其中性蛋白酶水解物对巨噬细胞产生NO能力的影响
巨噬细胞通过反应性氮中间物作用系统产生NO,进而发挥杀菌和抗肿瘤作用,巨噬细胞产生的NO的量与其杀伤功能强弱具有密切关系[16]。检测林蛙油、林蛙油蛋白及其中性蛋白酶水解物,对RAW264.7巨噬细胞产生NO的影响,结果表明林蛙油无明显促进作用,而林蛙油蛋白质提高NO产量10.1%,具有显著的促进效果(p<0.05),林蛙油蛋白的中性蛋白酶水解物提高NO产量34.9%,具有极显著的促进效果(p<0.01)。以上结果表明,虽然林蛙油对巨噬细胞杀伤功能没有显示明显的促进作用,然而林蛙油蛋白却显示明显的促进作用,当林蛙油蛋白被中性蛋白酶水解后较显著促进巨噬细胞杀伤功能。
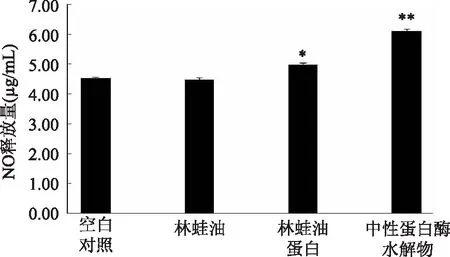
图4 林蛙油蛋白及其中性蛋白酶水解物 对RAW264.7细胞释放NO能力的影响
3 结论
体外检测脾淋巴细胞增殖和分泌IL-2含量、巨噬细胞吞噬功能及巨噬细胞产NO含量实验结果表明,林蛙油具有一定促进脾淋巴细胞和巨噬细胞功能作用,然而林蛙油组成成分之一的林蛙油蛋白的促进作用更显著,表明林蛙油免疫调节作用的活性成分存在于蛋白质。当林蛙油蛋白被中性蛋白酶水解后,更显著提高脾淋巴细胞和巨噬细胞功能,说明以特定形式存在的肽类是林蛙油促进免疫细胞功能的活性成分之一。中性蛋白酶可水解疏水性氨基酸亮氨酸和苯丙氨酸的氨基端及其它肽键[17],林蛙油蛋白中性蛋白酶水解物中促进免疫细胞功能的活性成分也可能是末端为疏水性氨基酸的肽类。通过本项研究,虽然不能完全阐明林蛙油免疫调节功能的活性成分,但本项研究结果为进一步深入研究林蛙油免疫调节功能的活性成分及作用机理,提供了重要的科学依据。
[1]王殿夫.即食林蛙油罐头中污染菌的分离鉴定[J].中国酿造,2008,14:84.
[2]高峰,张海英,张琨,等.林蛙油类保健食品保健功能研究[J].中国公共卫生,2005,21(9):1056.
[3]韩铁锁,王亚军,王新,等.东北林蛙油化学成分和药理作用的研究进展[J].黑龙江畜牧兽医,2008(4):17-18.
[4]Li F,Wen HA,Zhang YJ,etal.Purification and characterization of a novel immunomodulatory protein from the medicinal mushroomTrametesversicolor[J].Science China,2011,54(4):379-385.
[5]田刚,陈代文.免疫调节肽研究进展[J].饲料营养研究进展,2006:195-209.
[6]陈晓平,崔敬爱,胡耀辉.林蛙油主要营养成分的研究[J].食品科学,2005,26(8):361-363.
[7]李曦,尤欢,杨严峻.鸡胚蛋提取物对体外培养的脾淋巴细胞和巨噬细胞的影响[J].食品工业科技,2012(12):368-370.
[8]Nagaoka S,Futamura Y,Miwa K,etal.Identification of novel
hypocholesterolemic peptides derived from bovine milk β-lactobulin[J]. Biochem Biophys Res Commun,2001,281(1):11-17.
[9]Fabian B,Maria CC,Felix CC.Invivoandinvitroimmunomodulatory activities ofTrichiliaglabraaqueousleaf extracts[J].Journal of Ethnopharmacology,2000,69:199-205.
[10]Sun HX,Qin F,Pan YJ.Invitroandinvivoimmunosuppressive activity ofSpicaPrunellaeethanolextract on the immune responses in mice[J].Journal of Ethnopharmacology,2005,101:31-36.
[11]Gomes A,Giri B,Alama A,etal.Anticancer activity of a low immunogenic protein toxin(BMP1)from Indian toad(Bufomelanostictus,Schneider)skin extract[J].Toxicon,2011,58:85-92.
[12]Xi L,Yujie S,Jun S,etal.Chicken embryo extracts enhance spleen lymphocyte and peritoneal macrophages function[J]. Journal of Ethnopharmacology,2012,144(2):255-260.
[13]Chen WX,Zhang WY,Shen WB,etal.Effects of the acid polysaccharide fraction isolated from a cultivated Cordycepssinensison macrophagesinvitro[J].Cellular Immunology,2010,262:69-74.
[14]李伟,陈青森.酪蛋白糖巨肽对小鼠肠道免疫系统的影响[J].食品科学,2010,31(15):240-243.
[15]田维毅,王文佳,李海峰,等.中性红法检测巨噬细胞吞噬功能的实验条件的优化[J].贵阳中医学院学报,2009,31(2):23-26.
[16]陈娜,陈兴平. 华蟾素对小鼠脾淋巴细胞分泌白细胞介素-2水平的影响[J]. 医药导报,2007,26(1):14-16.
[17]刘欣.食品酶学[M].北京:中国轻工业出版社,2007:51-64.
Promotion of spleen lymphocyte and macrophage functions induced by neutral protease hydrolysate of Oviductus Ranae protein
GUOMiao1,2,CUILi1,2,ZHAIMeng-xin1,2,ZHANGShi-xin1,2,WANGTao1,2,XUMei-yu1,2,*,WENGQiang1,2
(1.Department of Food Science and Engineering,College of Biological Sciences and Technology, Beijing Forestry University,Beijing 100083,China; 2. Beijing Key Laboratory of Forest Food Processing and Safety,Beijing Forestry University,Beijing 100083,China)
Protein was extracted from fresh frozen Oviductus Ranae by ammonium sulfate grade precipitation combined with ultrasonic treatment. Oviductus Ranae protein hydrolysate was prepared with neutral protease. Effect of Oviductus Ranae,Oviductus Ranae protein and neutral protease hydrolysate of Oviductus Ranae protein on functions of spleen lymphocyte and macrophage were investigated by testing proliferation of spleen lymphocyte,Interleukin-2(IL-2)secretion of spleen lymphocyte,phagocytic function of macrophage and NO production. These results showed Oviductus Ranae,Oviductus Ranae protein and neutral protease hydrolysate of Oviductus Ranae protein promoted immune functions of spleen lymphocyte and macrophage,and the neutral protease hydrolysate of Oviductus Ranae protein showed the most significant effect to improve immunefunctions(increased the proliferation of spleen lymphocyte,IL-2 secretion by spleen lymphocyte,macrophage phagocytosis and NO production by macrophages to 19.3%,104.8%,109.1% and 34.9%,respectively). These results suggested that neutral protease hydrolyzate of Oviductus Ranae protein could promote the immune functions of spleen lymphocyte and macrophage significantly(p<0.01).
Oviductus Ranae protein,neutral protease hydrolysate,spleen lymphocyte,macrophage,immunefunction
2013-05-31 *通讯联系人
郭淼(1988-),女,硕士研究生,研究方向:营养与功能食品。
国家自然科学基金资助子项目(J1103516-2D26);北京市科委科技创新基地培育与发展工程项目(Z121106002812037)。
TS201.4
:A
:1002-0306(2014)01-0345-04
