食源性沙门氏菌第Ⅰ类整合子检测及其耐药基因盒分析
2014-09-20,,,,
, ,, ,
(华南理工大学轻工与食品学院,广东广州 510640)
食源性沙门氏菌第Ⅰ类整合子检测及其耐药基因盒分析
周蓉,李琳,苏健裕*,李冰,徐振波
(华南理工大学轻工与食品学院,广东广州 510640)
目的:了解食源性沙门氏菌的耐药性、Ⅰ类整合子分布及其耐药基因盒的结构序列,为Ⅰ类整合子的分子进化提供理论基础。方法:采用K-B纸片法检测食源性沙门氏菌对14种抗生素的敏感性;利用聚合酶链式反应(PCR)扩增整合酶基因intI1检测食源性沙门氏菌中Ⅰ类整合子携带率及可变区耐药基因盒。结果:食源性沙门氏菌对β-内酰胺类、氨基糖苷类、喹诺酮类和磺胺类的最高耐药率分别为18.75%、12.5%、6.25%和25%。59.4%(19/32)的食源性沙门氏菌检测出第Ⅰ类整合子。PCR 扩增Ⅰ类整合子耐药基因盒,扩增产物大小为1009和1664bp,携带aadA5、dfr17和aadA2耐药基因,可分别介导对氨基糖苷类抗生素壮观霉素、链霉素和磺胺类药物甲氧苄氨嘧啶的耐药。结论:食源性沙门氏菌中也检测到较高的耐药率及整合子携带率,提示我们应该从基因水平上对食源性致病菌耐药及其传播进行监测。
沙门氏菌,第Ⅰ类整合子,耐药基因盒,耐药性
沙门氏菌(Salmonella)广泛分布于自然界,能够引起食源性感染,是对人类和动物健康有极大危害的一类致病菌。沙门氏菌是引起腹泻的重要病原微生物之一,据统计,我国细菌性食物中毒中,有70%~80%是由沙门氏菌引起的[1]。近年来,世界各国都加强了食品安全工作,但是食品安全问题还是层出不穷。一方面食品生产是一个时间长、环节多的复杂过程,在整个过程中存在着许许多多被致病性微生物污染的可能性;另一方面,随着越来越多食品生产者在生产源头上滥用各种抗菌药物,造成了致病性微生物耐药菌株的大量出现,使得致病性微生物耐药性不断增强,并广泛传播。不断蔓延的细菌耐药(Bacterial Resistance)问题已成为食品安全重大隐患之一,对人类的生命和健康构成了巨大的威胁。因此,系统地分析食源性细菌的耐药性,对了解和解决细菌感染等食品安全事件具有重要作用。在对细菌耐药机制的探讨中,整合子系统介导的细菌耐药调控机制引起了广泛的关注[2]。整合子是细菌基因组中一种介导耐药基因转移的转座元件,其功能与耐药基因的产生密切相关[3-4]。典型的整合子结构由保守区和可变区组成,保守区是整合酶编码基因的所在区域,可变区是由耐药基因盒组成;其中最常见的整合子为Ⅰ类整合子。关于Ⅰ类整合子结构、耐药基因盒的捕获及表达,相关的研究报道较多[5-8]。相关研究结果表明,Ⅰ类整合子可以携带至少数十种耐药基因盒,所含耐药基因几乎覆盖了临床上所有使用的抗生素[9]。然而,前期的研究多集中在临床菌株的研究,对食源性致病菌的报道较少。本研究对从超市食品样品中分离得到32株食源性沙门氏菌中第Ⅰ类整合子的分布及其整合的耐药基因盒进行了检测并分析其耐药基因,进一步探讨了整合子在食源性致病菌耐药中的介导作用,从基因角度研究了这些菌株的耐药性,为食源性致病菌安全控制技术的实施提供理论依据和基础数据。
1 材料与方法
1.1材料与仪器
沙门氏菌 均分离于广州地区超市零售食物中,菌株来源见表1;第Ⅰ类整合子阳性对照菌株PseudomonasaeruginosaPAH15 本实验室保藏;第Ⅰ类整合子阴性对照菌株为对利福平耐药的含有pET196质粒大肠杆菌RG488 本实验室保藏;药敏实验质控菌株大肠杆菌ATCC25922 本实验室保存;药敏实验质控菌株铜绿假单胞菌ATCC27853 本实验室保存;OMEGA Kits 试剂盒 飞扬生物公司;DNA Marker DGL5000,10×Loading Buffer,2×Taq Master Mix NEW ENGLAND BioLabs;14种抗生素分别为头孢唑啉、头孢呋辛、头孢曲松、头孢吡肟、亚胺培南、美罗培南、庆大霉素、阿米卡星、复方新诺明、环丙沙星、左氧氟沙星、哌拉西林/他唑巴坦、阿莫西林/克拉维酸、头孢哌酮/舒巴坦 北京天坛药物生物技术开发公司。
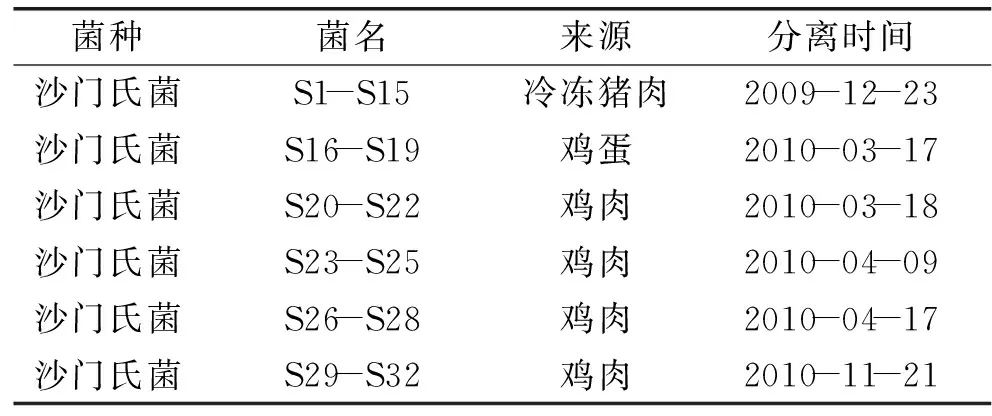
表1 实验菌株来源
注:本实验研究的沙门氏菌(S1-S32)均由广东检验检疫技术中心惠赠。
磁珠提取DNA系统RS-232C Thermo公司;PCR仪、凝胶成像分析系统UNIVERSAL HOOD Ⅱ 美国BIO-RAD仪器有限公司;琼脂糖凝胶电泳系统GE-100 HANGZHOU BIOER公司。
1.2药敏检测
采用选取的14种抗生素对食源性沙门氏菌进行药敏实验,实验步骤参照美国临床实验室标准委员会(NCCLS)纸片扩散法(K-B纸片法)标准,实验结果判断采用美国临床实验室标准化协会(CLSI)标准[10]。
1.3聚合酶链式反应(PCR)筛选第Ⅰ类整合子阳性沙门氏菌
1.3.1 DNA模板的制备和引物的设计
1.3.1.1 沙门氏菌DNA的提取 参考文献[11]的方法。
1.3.1.2 引物设计 参考文献[6]的方法。分别用来扩增整合酶基因intI1、耐药基因盒和3′CS。引物序列见表2。
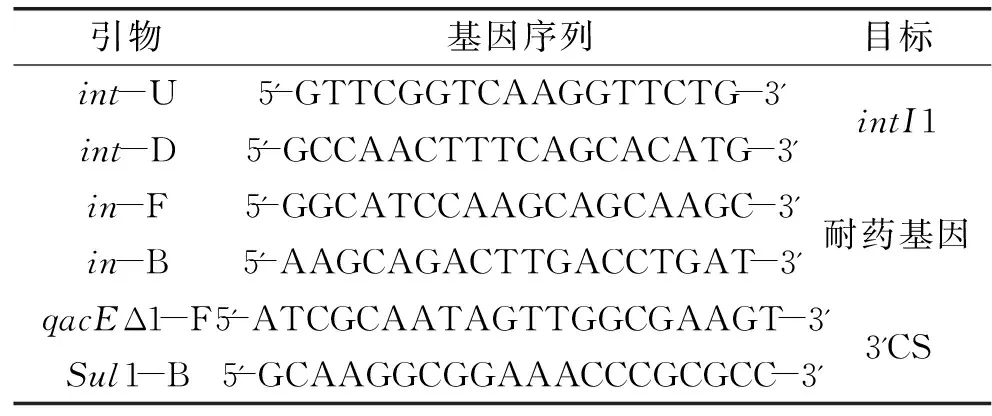
表2 引物序列
注:引物由invitrogen公司合成。
1.3.2 PCR反应检测第Ⅰ类整合子阳性沙门氏菌 用PCR仪检测第Ⅰ类整合子,登陆国际生物信息库GenBank,50μL PCR反应体系,扩增程序参照文献[6],产物分析采用含有EB(溴化乙锭)的琼脂-糖凝胶电泳方法,凝胶成像系统成像检测。以铜绿假单胞菌 PAH15为第Ⅰ类整合子阳性对照菌,以对利福平耐药且含有pET196质粒的大肠杆菌RG488为第Ⅰ类整合子阴性对照菌,对食源性沙门氏菌进行第Ⅰ类整合酶基因intI1扩增,出现阳性结果则判为第Ⅰ类整合子阳性菌株。
1.4耐药基因盒扩增产物的纯化、测序和序列分析
以第Ⅰ类整合子阳性沙门氏菌作为实验菌株,制备DNA 模板和设计引物[6],PCR 反应体系和PCR扩增程序均与1.3.1相同,上海美吉公司完成PCR扩增产物的测序过程。应用DNAMAN软件对耐药基因盒PCR扩增产物的DNA序列进行开放读码框(ORF)分析,登陆美国国家生物技术信息中心DNA数据库GenBank,进行DNA序列同源性比对分析。
1.5限制性内切酶酶切反应
利用DNASIS软件确定限制性内切酶,对特异性引物in-F、in-B扩增出的相同片段进行酶切反应。酶切反应体系组成为8μL的PCR扩增产物,2μL酶缓冲液,1μL内切酶,10μL无菌去离子水,将其置于37℃恒温条件下反应,1h后加入3μL 10×Loading Buffer终止反应,用3%琼脂糖凝胶电泳检测产物[12]。
2 结果与分析
2.1菌株药敏检测结果
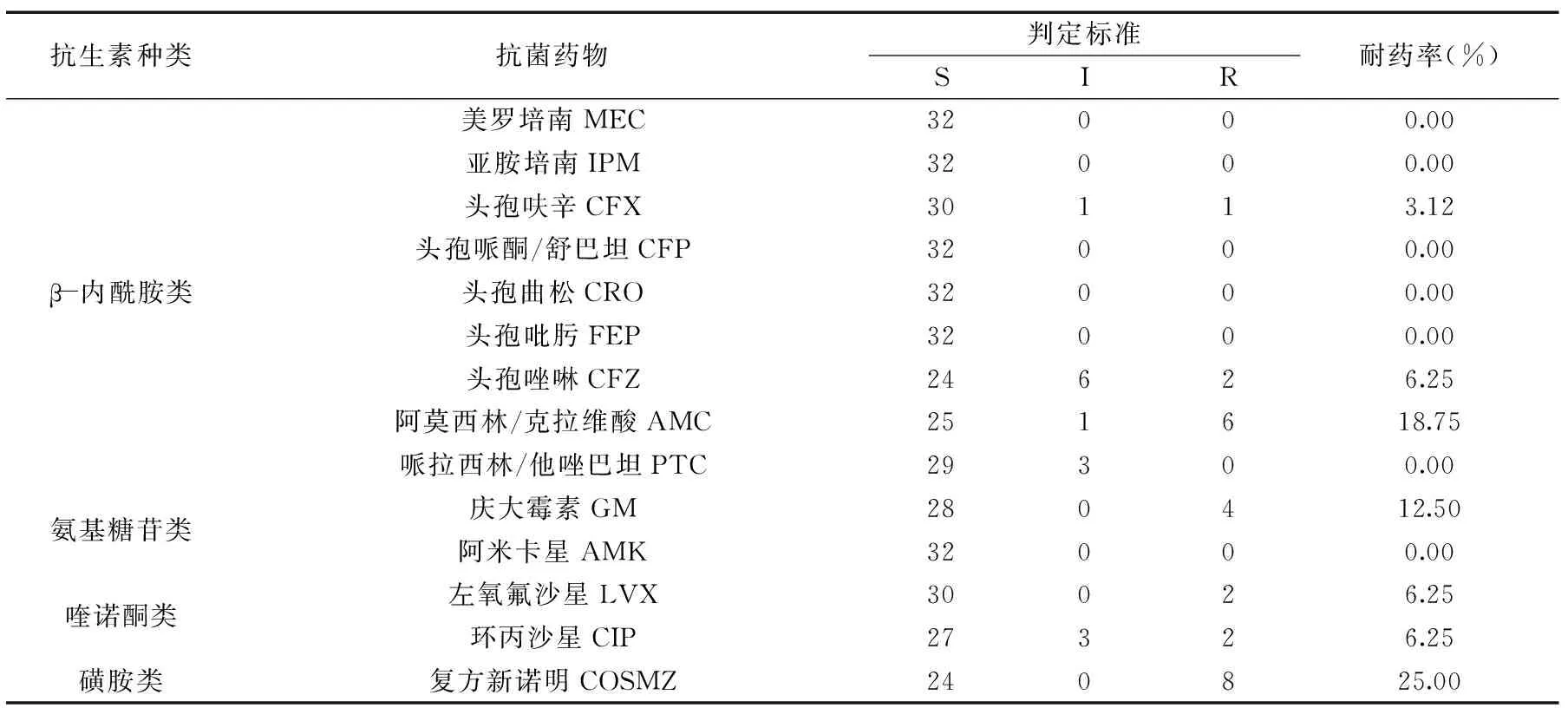
表3 食源性沙门氏菌药敏检测结果
注:S表示敏感,I表示中度敏感,R表示耐药。
根据NCCLS推荐的标准,检测了32株食源性沙门氏菌对14种抗生素的敏感性。本实验所检测的食源性沙门氏菌对头孢曲松、头孢吡肟、亚胺培南、美罗培南、头孢哌酮/舒巴坦、阿米卡星都敏感;对磺胺类药物复方新诺明的耐药率最高,达到25.00%;对β-内酰胺类、氨基糖苷类和喹诺酮类都有部分耐药性。结果表明,食源性沙门氏菌对临床使用的抗菌药物具有一定的多重耐药性,且细菌的多重耐药性一般与Ⅰ类整合子密切相关[4]。32株食源性沙门氏菌对检测的14种抗生素的耐药性见表3。
由表3可知,食源性沙门氏菌对检测的14种抗生素耐药率相对较低,均低于30%,但是对四大类抗生素均有耐药。β-内酰胺类最高耐药率达到18.75%,氨基糖苷类达到12.50%,喹诺酮类达到6.25%,磺胺类达到25.00%。
2.2第Ⅰ类整合子阳性沙门氏菌检测结果
阳性沙门氏菌PCR扩增产物凝胶成像见图1。由图1可知,32株食源性沙门氏菌中,用上游引物int-U、下游引物int-D扩增整合酶基因intI1,共有19株沙门氏菌得到了923bp的扩增产物,和预测扩增产物片断大小相符,推测可能为第Ⅰ类整合子阳性菌株,同时对其片断进行纯化,测序分析结果表明与923bp大小intI1(Y18050)100%同源,确认为intI1。沙门氏菌第Ⅰ类整合子阳性菌:S1、S3、S4、S6、S7、S8、S9、S10、S11、S13、S15、S17、S19、S20、S21、S27、S28、S29、S30;第Ⅰ类整合子阳性检出率为59.4%。
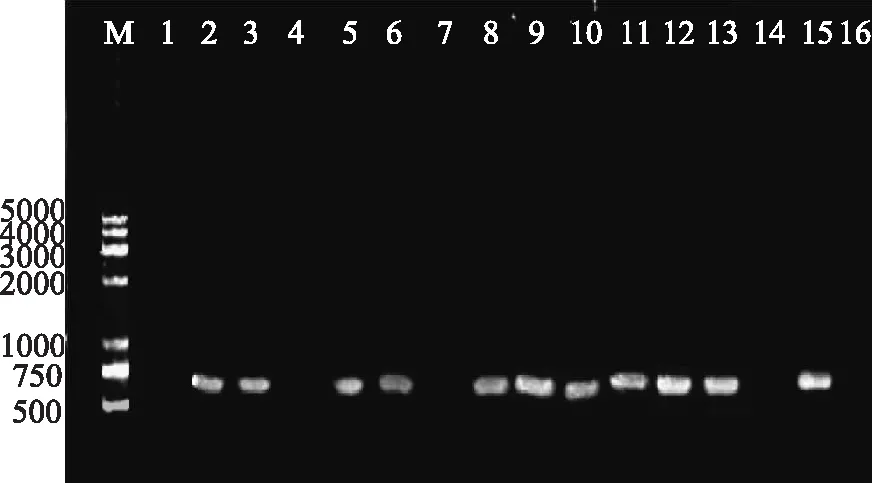
图1 特异性引物int-U和int-D 扩增整合酶基因intI1 PCR产物部分电泳结果
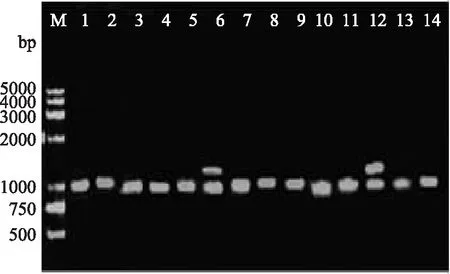
图2 特异性引物in-F和in-B 扩增第Ⅰ类整合子阳性菌PCR产物部分电泳结果
2.3耐药基因盒扩增序列分析
用in-F和in-B特异性引物扩增第Ⅰ类整合子阳性菌整合的耐药基因盒,结果表明,共有14株(74%)有扩增产物,分别是S1、S3、S4、S6、S7、S8、S13、S15、S17、S19、S20、S21、S27、S30;其余5株沙门氏菌未见有扩增产物,可能是并未捕获耐药基因或者耐药基因未表达。PCR扩增结果见图2,扩增产物大小为1009bp和1664bp。2株菌S6和S15扩增得到1664bp PCR产物,对其一片段进行测序,序列分析表明该片段(AB189264)含有2个开放阅读框,大小分别为474bp和789bp,与耐药基因盒aadA5和dfr17 100%同源,分别对氨基糖苷类抗生素壮观霉素、链霉素和磺胺类药物甲氧苄氨嘧啶产生耐药。所有菌株扩增得到1009bp PCR产物,对其一片段进行测序,序列分析表明该片段(FJ594765.1)与耐药基因盒aadA2 100%同源,介导对氨基糖苷类抗生素、链霉素产生耐药。另外,从2株菌S6和S15同时扩增出1664bp和1009bp的PCR产物,其序列分析与前述相同。
2.4耐药基因盒长度多态性分析结果
用特异性内切酶对1664bp和1009bp耐药基因盒进行酶切,特异性引物in-F、in-B扩增结果表明,2个1664bp片段都含有aadA5和dfr17耐药基因,所有1009bp片段都含有aadA2耐药基因,酶切结果见表4。用qacEΔ1-F和Sul1-B扩增以上19株第Ⅰ类整合子阳性沙门氏菌的3′CS,扩增产物均为800bp,和文献[13]一致。说明19株阳性沙门氏菌的3′CS是完整的。耐药基因盒结构示意图见图3。
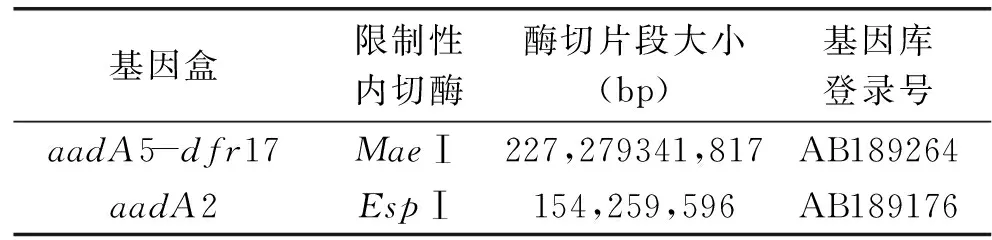
表4 耐药基因盒酶切结果
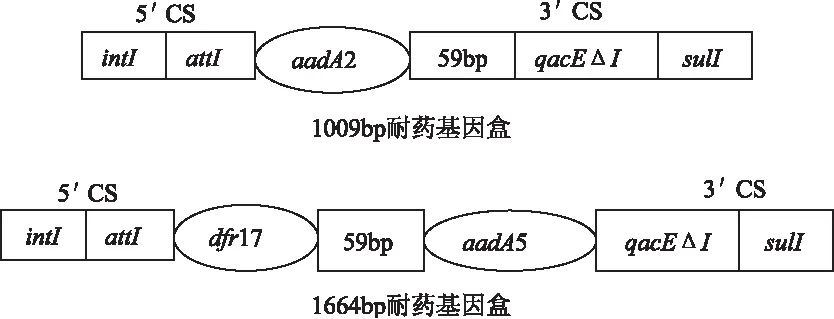
图3 耐药基因盒结构示意图
3 讨论
近年来,整合子介导的细菌耐药成为国内外学者研究的热点。然而,目前整合子研究报道主要集中在临床菌株[14-15]。本实验从基因角度研究分离自食品的沙门氏菌其整合子介导的细菌耐药性。检测到第Ⅰ类整合子阳性菌株所占比例为59.4%。PCR特异性扩增第Ⅰ类整合子阳性菌株的耐药基因盒,14株均有扩增产物且片段大小分别为1009bp和1664bp。2株中PCR扩增产物片段大小为1664bp,携带aadA5和dfr17基因,编码介导氨基糖苷类抗生素壮观霉素、链霉素和磺胺类药物甲氧氨苄嘧啶耐药的基因。14株中PCR扩增产物片段大小为1009bp,携带aadA2基因,编码介导氨基糖苷类抗生素壮观霉素、链霉素耐药的基因。2株菌同时扩增得到1009和1664bp的扩增产物,分析可能含有2个拷贝数的整合子,一个含有aadA5和dfr17耐药基因盒,另一个含有aadA2耐药基因盒,同时编码介导对氨基糖苷类抗生素壮观霉素、链霉素和磺胺类药物甲氧氨苄嘧啶耐药的基因。以上2种结构的3′CS都含有sulI,是对磺胺类药物的耐药基因,这与药敏检测结果一致,对磺胺类抗生素复方新诺明有较高的耐药性,达到25%。药敏检测结果中有18.75%对β-内酰胺类耐药,但是在耐药基因盒中并未检测出对β-内酰胺类耐药的基因,可能是因为本次实验只检测了第Ⅰ类整合子及其携带的基因盒,并未对其他类型的整合子进行检测,分析其耐药基因。
整合子耐药系统对于监测细菌耐药性的传播具有重要意义[17]。整合子可以作为转座子的组成部分参与耐药基因的转移,也可存在于染色体上,随DNA的复制进入到子代中。多数整合子并不只是捕获1个耐药基因盒,它可以同时捕获多个耐药基因盒,介导对多种抗生素的耐药性。多重耐药菌株的出现,加大了临床治疗细菌感染的难度,而在食品中由于多重耐药菌株的存在,导致了新的食品安全问题。本文从食源性细菌中检测出了整合子及耐药基因盒的存在,提示要从基因角度研究食品安全问题,为食源性致病菌安全控制技术的实施提供理论依据和基础数据。
[1]World Health Organization. Overcoming Antimicrobial Resistance,World Health Organization Report on Infectious Diseases. Publication Code:WHO/CDS/2000.
[2]Mazel D,Davies J. Antibiotic resistance in microbes[J]. CMLS,Cellular and Molecular Life Sciences,1999,56(11):742-754.
[3]Veen E L,Schilder A G M,Timmers T K,etal. Effect of long-term trimethoprim/sulfamethoxazole treatment on resistance and integron prevalence in the intestinal flora:a randomized,double-blind,placebo-controlled trial in children[J]. Journal of Antimicrobial Chemotherapy,2009,63(5):1011-1016.
[4]王欢,包其郁,孙爱华,等. 肠道杆菌耐药性及其耐药相关Ⅰ类整合子可变区结构与进化[J].浙江大学学报:医学版,2013,42(2):150-155.
[5]张宏梅,石磊,李琳. 细菌耐药机制的研究热点-整合子系统[J]. 中华微生物学和免疫学杂志,2003,23(10):831-832.
[6]张宏梅,石磊,李琳,等. 沙门菌中第Ⅰ类整合子的鉴定及特性分析[J]. 中华微生物学和免疫学杂志,2004,24(3):214-217.
[7]冯银,陈体,袁金玲,等. 铜绿假单胞菌可变区长度对intI1基因表达的影响[M].中华医院感染学杂志,2013,23(8):1745-1748.
[8]杨保伟,曲东,申进玲,等.陕西食源性沙门氏菌耐药性及相关基因[J].微生物学,2010,50(6):788-796.
[9]Khan AA,Nawaz SM,Khan SA. Detection of multidrug-resistant Salmonella typhimurium DT104 by multiplex polymerase chain reaction[J]. FEMS Microbiology Letters,2000,182(2):355-360.
[10]Lee. Margie D,Sanchez Susan,Zimmer Martha,etal. Class 1 Integron-Associated Tobramycin-Gentamicin Resistance in Campylobacter jejuni Isolated from the Broiler Chicken House Environment[J]. Antimicrobial Agents and Chemotherapy,2002,46(11):3660-3664.
[11]Sambrook J,Frishch EF,Maniatis T. Molecular Cloning:A Laboratory Manual[M]. 2ed. New York:Cold Spring Harbor Laboratory Press,1989:39.
[12]苏健裕,石磊,杨连生. 临床大肠埃希菌第Ⅰ类整合子检测及耐药基因盒分析[J]. 检验医学与临床,2008,5(7):385-387.
[13]Dalsgaard A,Forslund A,Serichantalergs O,etal. Distribution and content of class 1 integrons in different Vibrio cholera O-serotype strains isolated in Thailand[J]. Antimicrob Agents Chemother,2000,44(5):1315-1321.
[14]张霖,薛盛东,周宗爱,等. 铜绿假单胞菌第Ⅰ类整合子遗传标记及耐药基因研究[J]. 中华医院感染学杂志,2007,17(5):496-498.
[15]石磊,郑美萍,肖增璜,等. 临床致病菌整合子检测及耐药基因盒序列分析[J]. 中华检验医学杂志,2005,28(11):1204-1206.
[16]杨维青,贾文祥,殷长甫,等. 铜绿假单胞菌第I类整合子相关基因的解析和定位[J]. 中国抗生素杂志,2007,32(12):730-732.
[17]Roe MT,Vega E,Pillai SD. Antimicrobial resistance markers of Class 1 and Class 2 integron-bearing Escherichia from irrigation water and sediments[J]. Emerging Infectious Diseases,2003,9(7):822-826.
Detection of classⅠintegron from foodbornesalmonellaand analysis on the drug resistance gene cassettes
ZHOURong,LILin,SUJian-yu*,LIBing,XUZhen-bo
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
Objective:To investigate the drug resistance,the distribution of class Ⅰintegron and drug resistance gene cassette of foodbornesalmonella. Methods:K-B assay was applied to measure the drug resistance of foodbornesalmonellaisolated against fourteen antibiotics. The class Ⅰintegron and drug resistance gene cassette were detected by PCR sequencing of amplification products. Results:The highest drug resistance rate to β-lactams,aminoglycosides,quinonones and sulfa in foodbornesalmonellawas 18.75%,12.5%,6.25% and 25%. 59.4%(19/32)of foodbornesalmonellawere positive for classⅠintegron. The product by PCR amplifying of classⅠintegron was 1009bp and 1664bp. In the drug resistance cassettes of variable regions of classⅠintegrons there were 3 types drug resistance genes,includingaadA5,dfr17 andaadA2,which induced the resistance to aminoglycosides antibiotics spectinomycin,streptomycin and sulfonamides drugs trimethoprim. Conclusion:High multidrug resistance and class I integron carrying had been identified among the foodbornesalmonella. The result stressed the need for continued surveillance of foodborne antibiotic resistance bacteria in the molecular level.
Salmonella;class Ⅰintegron;resistance gene cassette;drug resistance
2013-05-29 *通讯联系人
周蓉(1990-),女,硕士研究生,研究方向:病原微生物及功能抗菌剂制备。
教育部博士点基金新教师基金项目(20110172120033);国家自然科学基金(31101278和31201362)资助。
TS201.1
:A
:1002-0306(2014)01-0279-05
