家禽肠道屏障功能及其营养调控
2014-09-20呙于明张炳坤
呙于明 刘 丹 张炳坤
(中国农业大学动物科技学院,动物营养学国家重点实验室,北京 100193)
肠道具有双重功能,既作为消化和吸收营养物质的重要器官,又是保持机体内环境稳定的先天性屏障。肠道屏障是指肠道能够防止肠腔内的有害物质(如细菌和各种毒素)穿过肠黏膜进入体内其他组织器官和血液循环的结构和功能的总和。当肠道屏障被破坏时,肠道微生物和毒素等便可进入血液循环,从而引起细菌和毒素的移位,易引发肠原性感染,甚至导致全身性炎症反应或多器官功能的衰竭[1]。家禽生长(尤其是早期生长)由于受环境和营养应激等因素的影响,很容易损伤肠道屏障,降低免疫机能,造成的肠道菌群失衡紊乱进而引发各种疾病进而降低其生产性能,甚至导致死亡。
1 家禽肠道屏障组成及其作用
肠道屏障是由机械屏障、化学屏障、微生物屏障和免疫屏障组成的(图1)。4种屏障通过各自不同的分子调控机制、生物学功能以及信号通路进行有机结合从而来共同对抗体外抗原物质对机体的侵袭。
1.1 机械屏障
机械屏障又称物理屏障,在肠道屏障中尤为重要,它是由肠黏膜上皮细胞及其紧密连接等组成的完整的彼此紧密连接的肠道上皮结构[2]。家禽肠道上皮为单层柱状上皮,包括吸收细胞、杯状细胞和未分化细胞。吸收细胞成高柱状排列,数量最多,相邻细胞间有由紧密连接(tight junction)、黏着连接(adhesion junction)和桥粒(desmosome)等组成的连接复合体(图2),起着主要的机械屏障作用。紧密连接位于肠上皮细胞膜外侧的顶部,为一狭窄的带状结构(焊接线或嵴线),其作用为封闭细胞间的间隙,阻止肠腔有毒物质进入周围组织,还可起到调节肠上皮细胞旁路的流量速度及将细胞顶部与基侧膜分开的作用[3]。细胞间紧密连接的通透性决定着整个肠上皮细胞的屏障功能[4]。黏着连接位于紧密连接下方,起着细胞与细胞之间的黏附和细胞内信号传递的作用[5]。黏着连接和紧密连接(合称为顶端连接复合体)与肌动蛋白细胞骨架相连[5-7]。桥粒起到铆接相邻细胞的作用[8]。
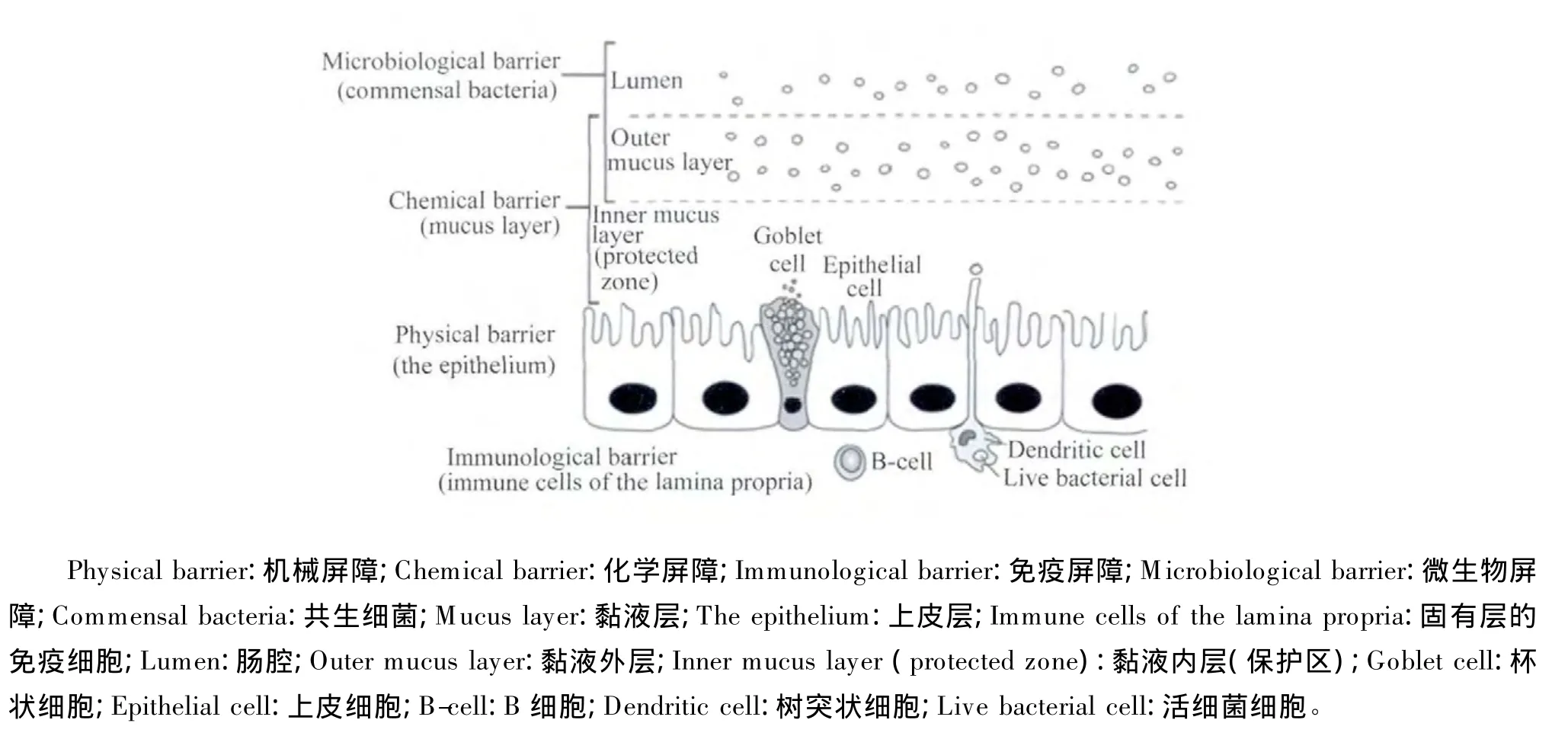
图1 肠道屏障的组成Fig.1 Components of the intestinal barrier[9]
大约有50种蛋白质参与紧密连接的形成,主要为闭锁蛋白(occludin)、闭合蛋白(claudins)和连接黏附分子(junctional adhesion molecule,JAM)3种完整的跨膜蛋白和闭合小环蛋白(zonula occludens,ZO)等外周胞浆蛋白。这些跨膜蛋白(occludin、claudins和JAM)的胞外域与相邻细胞构成选择性屏障,参与调节细胞间黏附、移动及细胞的通透性,而胞内域则与细胞质内的ZO(ZO-1、ZO-2和ZO-3)相连[10]。ZO是紧密连接支持结构的基础,主要作用为连接跨膜蛋白与细胞骨架及传递信号分子,调节细胞物质的转运,维持上皮的极性等[11]。claudins蛋白为紧密连接的结构骨架,目前在哺乳动物的claudin家族中已经发现24个成员,其中 claudin-1、-3、-4、-5、-8、-9、-11、-14 可使紧密连接变紧从而减小细胞旁通透性,claudin-2、-7、-12和-15则与细胞旁孔道形成相关,会使细胞旁通透性增加[12]。而在家禽中,仅见关于 claudin-1、-2、-3、-5和-16,ZO-1和-2以及occludin等紧密连接蛋白的研究报道[13-16]。此外,紧密连接与肌动蛋白细胞骨架的交互作用对紧密连接结构和功能的维护也是极其重要的。
紧密连接蛋白分子具有高度动态的结构,其密闭程度会因外界刺激、生理和病理条件而发生改变[3]。为保持高度动态状态,紧密连接持续地受细胞内外信号的监控和调节。细胞内外信号通过磷酸化和脱磷酸化作用来控制紧密连接的装配和拆卸,参与信号分子包括肌球蛋白轻链激酶(myosin light chain kinase,MLCK)、Rho 家族鸟苷三磷酸酶(Rho GTPases)、蛋白激酶C(protein kinase C,PKC)和丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)[17]。
1.2 化学屏障
肠道化学屏障主要是由覆盖在肠上皮细胞上的含一定数量微生物的疏松黏液外层和含少量微生物的黏液内层组成。杯状细胞分泌的黏液中含有细菌黏附受体的类似物——糖蛋白和糖脂,它们可改变细菌的进攻位点,使细菌与糖蛋白和糖脂结合后随粪便排出[20]。肠黏膜黏液的分泌、组成以及基因表达会受肠道微生物和宿主炎症介质的影响[21]。此外,肠道分泌的各种物质,如胃酸、胆汁、消化酶、溶菌酶、糖蛋白、黏多糖和糖脂等也起到一定的化学屏障作用。胃酸能杀灭进入胃肠道的细菌,抑制细菌在胃肠道上皮的黏附和定植。胆汁中的胆盐和胆酸能与细菌内毒素结合或直接降解内毒素。溶菌酶可以使细菌细胞壁中的肽聚糖骨架结构断裂,导致细菌裂解。肠道分泌的大量消化液通过稀释毒素和冲洗肠腔使潜在的条件性致病菌难以黏附到肠上皮上。

图2 肉鸡肠上皮连接复合体Fig.2 Junctional complexes between intestinal epithelial cells of chickens
1.3 微生物屏障
肠道微生物屏障是肠道屏障的重要组成部分,可影响肠上皮的代谢和增殖。肠道微生物屏障是一个由肠道共生菌与宿主的微空间结构形成的微生态系统。当这个微生态系统的稳定性遭到破坏时,就会导致肠道中潜在性病原体(包括条件致病菌)的定植和入侵。肠道常驻菌群通过竞争肠黏膜上的黏附、分泌抗菌物质、增加黏液分泌来抑制致病菌的定植和生长[22];也可分泌乳酸和短链脂肪酸(如乙酸、丙酸和丁酸等)来降低肠道pH与氧化还原电势;其中,丁酸作为上皮细胞的主要能量物质会影响肠上皮细胞的增殖和分化,有助于加强肠道紧密连接[23]。
1.4 肠道免疫屏障
肠道作为动物体中最大的免疫器官承担着耐受饲粮抗原和免疫防御的双重任务。肠道的免疫防御系统主要由肠道相关淋巴组织(gut-associated lymphatic tissue,GALT)构成,是机体最大的淋巴器官和重要的黏膜相关淋巴组织,是饲养过程中防御病原体侵入机体的第一道防线。鸡GALT主要由分布于肠道黏膜固有层和黏膜下层的淋巴细胞组成[24]。鸡发达的 GALT弥补了其缺乏淋巴结的不足。而肠道免疫应答系统中的主要效应因子是由浆母细胞分泌的分泌型免疫球蛋白A(secretory IgA,sIgA),它可以强有力地与抗原相结合,阻止病毒、细菌等有害抗原在肠上皮上的黏附并继而促发肠道的体液和细胞免疫,最终有效免疫排斥或清除有害抗原。
2 家禽肠道屏障功能的评价
目前评估动物肠道屏障功能的方法众多,归结起来主要包括测定肠道通透性、血浆内毒素、细菌移位、肠道黏膜组织学观察等方法。
2.1 肠道通透性
肠道通透性作为肠壁的正常功能,既允许营养物质通过肠壁,又起到阻止潜在的有害物质透过肠壁进入机体的屏障作用[25]。肠道通透性的异常说明肠黏膜可能受到了一定程度的损伤和破坏。因此肠道通透性已被认为是反映肠道屏障功能最主要的指标[25]而广泛应用于人体和动物的研究中。
目前常用于肠道通透性的测定方法有分子探针法、血浆二胺氧化酶(diamine oxidase)活性法和体外尤斯灌流室(ussing chamber)法等。目前在人体临床和动物研究中通常运用无毒副作用的非代谢性糖类(如乳果糖、三氯蔗糖、鼠李糖、甘露醇等)[26-27]和同位素类[如51铬 -乙二胺四乙酸(51Cr-EDTA)][28]等分子探针来评估肠道通透性。但此方法通常需通过检测尿中的分子探针含量,而家禽粪尿无法分离因而此法不适用于家禽研究中。此外,荧光标记的分子探针(如异硫氰酸荧光素 -葡聚糖)[29]和辣根过氧化物酶[30]等方法通过注入到动物特定肠段后测定血液中的标记物来检测该肠段的通透性,但在家禽研究中鲜少见运用。二胺氧化酶是存在于所有哺乳动物肠黏膜上皮绒毛中的高活性细胞内酶。当肠黏膜遭受损伤时释放出大量二胺氧化酶,导致血液和肠腔中的二胺氧化酶活性增高而肠黏膜中二胺氧化酶活性降低。因此,检测血液和肠黏膜二胺氧化酶活性的变化可以反映肠道屏障功能。但是,家禽肠黏膜中二胺氧化酶活性低,因而此法也不能用来评测家禽肠道屏障功能。尤斯灌流室系统于1951年被介绍于世,其原理是利用微电极检测细胞膜离子通道电流信号的变化来反映肠道的通透性、分泌以及对药物吸收的变化。目前该技术被广泛应用于动物上皮组织的研究,既可以应用于研究肠道上皮的通透性、内毒素和细菌移位的途径及机制,也可用于研究各种添加剂保护肠道屏障功能的机制。运用尤斯灌流室系统检测肠上皮细胞跨膜电阻抗和同位素或荧光素标记的大分子物质通过胃肠道上皮的比例已成为评估肠道通透性的金标准。目前,这一技术在家禽营养吸收和肠道屏障功能研究上的应用已越来越多。
2.2 肠道细菌移位和血浆内毒素
结构和功能完整的肠道对细菌构成屏障作用,细菌难以进入血液循环。当肠道屏障受损导致肠黏膜通透性增加时,细菌就可通过肠黏膜进入体循环以及肝脏、脾脏、肺脏等器官,此过程叫细菌移位,可触发全身炎性反应甚至多器官功能的衰竭[31]。内毒素是革兰氏阴性细菌在代谢过程中或死亡后从细胞壁中释放出来的类脂多糖体(脂多糖)。内毒素因随肠道细菌的移位进入血液循环,并引起机体一系列生理病理改变[32]。因此,检测肠道细菌移位和血浆内毒素可间接反映肠黏膜整体的屏障功能[33]。检测细菌移位常用的方法包括标记细菌示踪法、细菌培养法、聚合酶链式反应法(PCR)等。
2.3 肠道黏膜组织形态
肠黏膜组织学观察是运用光学显微镜、扫描电镜和透射电镜等工具来评估肠道屏障功能的最常用和最直接的方法,可直接观察肠道上皮细胞形态、绒毛结构、排列及上皮细胞连接复合体的状况。这些肠黏膜指标的变化可在一定程度上反映肠道机械屏障的损伤,适用于各种动物的试验研究。
3 肠道屏障功能的发育
家禽胚胎期小肠的发育速度随着孵化时间的推进而增加,其肠道形态学、生物化学和分子生物学等方面的变化主要在出壳后1~14 d[34],那么家禽肠道屏障功能从胚胎期至出壳后也可能存在一定的发育过程和规律。早期的研究发现,鸡蛋孵化4 d后,occludin蛋白在胃肠道中出现微弱的表达,随后逐渐增强。至孵化第11天,仅在肠上皮细胞的顶端(如连接复合体内)可发现很强的occludin蛋白分布,而上皮细胞的其他区域只能显示其微弱的表达[14]。
对于claudin蛋白的研究,在鸡胚胎期5~8 d时就在肠上皮上发现有claudin-1和claudin-3的表达[15,35-36]。近年来,对从胚胎期至出壳后早期claudin-3、-5、-16蛋白在鸡肠上皮发育模式的研究发现,这些蛋白质在鸡出壳阶段要么改变了其在细胞内的分布要么第1次被检测到[13]。出壳后,claudin-3主要分布在整根肠绒毛的基底侧区域,隐窝部不见其分布;claudin-5主要分布在隐窝和绒毛底部的连接复合体内,而claudin-16分布于绒毛上部的杯状细胞内;claudin-3、-5、-16 mRNA的表达水平均在孵化18~20 d升高,出壳2 d后下降,这些claudin蛋白在出壳前后呈现它们稳定的分布,暗示这些蛋白质除了它们在紧密连接中的屏障功能外,可能在鸡肠道的分化和生理机能方面也扮演着重要角色,如claudin-16分布在相对较成熟的绒毛上部的杯状细胞内提示其对杯状细胞的成熟和黏液的分泌可能起到重要作用;而ZO-2在胚胎期18 d时其基因mRNA表达水平最高,然后开始下降,直至出壳后2 d降至稳定值。ZO-2表达规律与claudin存在很大的不同,ZO-2先于claudin-3和-5蛋白的转录,其转录水平在claudin转录增加前2天就达到高水平[13]。这可能是由于ZO-2是负责连接紧密连接和细胞骨架的衔接蛋白[10],并启动 claudins的分布和接紧密连接结构的形成[37]。
不同肠段的屏障功能均需在出壳后持续发育一段时间,且不同肠段的屏障功能及其紧密连接蛋白的发育速度并不一致[38]。空肠的跨上皮电阻在鸡出壳后2 d开始增加,到出壳后11 d达到平台值,而回肠的跨上皮电阻在鸡出壳后2 d开始线性增加,到出壳后14 d时还未达到平台值;空肠的occludin mRNA表达随着日龄而线性增加,到出壳后14 d时还未达到平台值,但回肠occludin和ZO-2 mRNA表达并未受出壳后日龄增长的影响[38]。
4 家禽肠道屏障的营养调控
4.1 微量元素锌(Zn)
Zn已被证实在维护动物胃肠道上皮屏障的完整及其功能上起到非常重要的作用。在饲粮中添加Zn可降低疾病、营养不良、应激和肠道病菌感染等状态下人体和动物的肠道通透性[39-42]。而Zn的缺乏可导致Caco-2细胞跨上皮电阻降低和紧密连接及黏着连接的发生改变[43]。对家禽的研究显示,饲粮中添加Zn元素(以硫酸锌形式)可以显著增加感染鼠伤寒沙门氏菌肉仔鸡回肠的绒毛高度与隐窝比、occludin和claudin-1 mRNA的表达,显著降低血浆内毒素水平,从而减缓沙门氏菌感染造成的肠道屏障功能的损伤[44]。而Hu等[45]却认为,氧化锌和蒙脱石均没有改善肠道形态、微生物数量和屏障功能的作用。与对照、蒙脱石、氧化锌和硫酸锌相比,以氧化锌蒙脱石复合物的形式添加60 mg/kg Zn可显著降低鸡肠道中梭菌数量,显著提高直肠跨上皮电阻抗值,显著降低直肠对甘露醇的通透性及回肠和直肠对菊粉的通透性[45]。
4.2 益生菌和益生元
大量的人体和动物试验已证实益生菌和益生元可起到保护和改善肠道屏障功能的作用。近几年,益生菌和益生元对家禽肠道屏障功能影响的研究也开始增多。在肉仔鸡饲粮中添加鲍氏酵母菌(Saccharomyces boulardii)和枯草芽孢杆菌(Bacillus subtilis B10)可显著增加 occludin、claudin-2、claudin-3的mRNA表达,并显著增加了小肠绒毛高度、宽度、杯状细胞数量、空肠IgA阳性细胞,显著改善了肠道的白细胞介素-6(IL-6)、肿瘤坏死因子 -α(TNF-α)、白细胞介素 -10(IL-10)、转化生长因子-β(TGF-β)和 sIgA含量,从而来综合改善肠道的屏障功能[18]。由唾液乳杆菌(Lactobacillus salivarius)和罗伊氏乳杆菌(Lactobacillus reuteri)组成的混合益生菌制剂显著增加了十二指肠绒毛/隐窝深度值、显著降低了回肠隐窝深度,从而改善了肠绒毛组织形态;通过尤斯灌流室技术测定了肠黏膜转运葡萄糖能力和组织导电性,认为混合益生菌制剂可增加空肠和大肠对葡萄糖的转运,对肠组织导电性无影响,说明混合益生菌制剂在维持肠上皮屏障结构的同时提高了其功能[46]。乳 酸 杆 菌 (Lactobacillus fermentum 1.2029)处理可降低感染坏死性肠炎肉仔鸡的肠道损伤程度,改善回肠上皮微绒毛,增加claudin-1和occludin的mRNA表达,显示其具有保护肠道屏障功能的作用[47]。
热应激在家禽生产业中经常发生,对动物健康、生产性能以及肠黏膜结构和微生物菌群都存在很大的负面影响[48-49]。在对肠道屏障功能的影响方面,热应激可引发肉仔鸡十二指肠、空肠和回肠轻微的多灶性淋巴浆细胞性肠炎,并使感染肠炎沙门氏菌肉仔鸡的肠道屏障遭到破坏,导致沙门菌通过肠黏膜迁移到脾脏和小肠壁炎性浸润加重,使3个肠段发展成中度多灶性淋巴浆细胞性肠炎[50]。热应激还可使肉鸡肠道内乳酸杆菌和双歧杆菌数量减少,大肠杆菌和梭菌数量增加,空肠绒毛高度降低,隐窝深度增加,空肠绒毛高度/隐窝深度值降低,空肠跨上皮电阻降低,异硫氰酸荧光素葡聚糖的细胞旁通透性增加,occludin和ZO-1的蛋白表达下调[51]。而饲粮中添加地衣芽孢杆菌、枯草芽孢杆菌和植物乳杆菌的混合益生菌制剂可使无论是正常温度下还是热应激状态下饲养的肉鸡的肠道内乳酸杆菌和双歧杆菌数量、空肠绒毛高度和occludin蛋白表达增加,大肠杆菌数量降低,从而来改善肠道屏障功能[51]。添加纤维寡糖可通过增加肉鸡空肠绒毛高度和空肠绒毛高度/隐窝深度值,降低异硫氰酸荧光素葡聚糖的细胞旁通透性,从而减轻热应激给肉仔鸡肠道屏障造成的负面影响[52]。
4.3 多糖
β-1,3/1,6-葡聚糖是一种结构复杂的葡萄糖多聚复合物,可增强宿主先天性免疫和获得性免疫功能,增强抗病原细菌、病毒和寄生虫感染的能力。通过在饲粮中添加β-1,3/1,6-葡聚糖增加了感染鼠伤寒沙门氏菌肉仔鸡的空肠绒毛高度、空肠绒毛高度/隐窝深度值、杯状细胞数量、sI-gA阳性细胞数和sIgA含量,降低了盲肠沙门氏菌数量和肝脏中沙门氏菌的数量,上调了claudin-1和occludin的mRNA表达,从而减缓由感染鼠伤寒沙门氏菌引起的肉仔鸡肠道屏障功能的损失[53]。车前草非淀粉多糖已在体外和离体试验中被证实其可阻止多种病原菌黏附和侵袭人上皮细胞。在肉鸡饲粮中添加车前草非淀粉多糖50 mg/d可减少沙门氏菌对肉仔鸡脾脏的侵袭;体外试验的结果显示,车前草非淀粉多糖可抑制沙门氏菌对猪肠上皮细胞和鸡盲肠隐窝上皮的黏附,经回肠黏膜尤斯灌流室离体试验证实这种作用与增加的黏膜短路电流而跨上皮电阻不变相关。车前草非淀粉多糖的这种抑制活性主要是其酸性的果胶分成在起作用[54]。
4.4 谷氨酰胺
谷氨酰胺(glutamine,Gln)是肠上皮细胞的主要能量来源,对肠上皮细胞的生长和分化是必需的。已有研究报道Gln在人危急病症和啮齿动物的各种肠炎模型中起到维持、促进和保护肠道的屏障功能。在Caco-2肠细胞中,细胞培养液缺乏Gln或抑制Gln合酶会降低跨上皮电阻抗值,增加甘露醇的渗透性,而减少紧密连接蛋白(ZO-1、occludin和claudin-1)表达及扰乱occludin和claudin-1分布会引起屏障功能的损伤[55]。这说明Caco-2肠细胞中紧密连接蛋的表达和细胞内的分布依赖于Gln。Gln缺乏导致的跨上皮电阻抗值降低通过PI3K抑制或敲除恢复,说明Gln是通过PI3K/Akt信号通路来调控细胞内紧密连接的完整性和紧密连接蛋白[56]。Gln可阻止由乙醛(乙醇的氧化代谢产物)诱发的Caco-2细胞单层旁通路通透性增加和紧密连接的破坏,并认为Gln的这个作用涉及到表皮生长因子(epidermal growth factor,EGF)受体依赖机制[57]。最近的研究认为,通过细胞外调节蛋白激酶(ERK)和核转录因子-κB(NF-κB)信号通路调控occludin和claudin-1可阻止甲氨蝶呤诱导的肠道屏障的破坏[58]。关于Gln对家禽肠道屏障影响的研究尚未见报道,值得关注和探讨。
4.5 苏氨酸
苏氨酸是猪或家禽的第二或第三限制性氨基酸。研究证实,苏氨酸在维持动物肠道形态、黏液分泌、刷状缘酶活性和生长性能中重要作用。在家禽的研究中,添加苏氨酸可显著提高肉仔鸡唾液酸的分泌,显著提高肉鸭的肠道黏液分泌量和黏蛋白MUC2 mRNA表达,对肉鸡杯状细胞密度和MUC2 mRNA表达无影响[59]。苏氨酸的缺乏可显著降低鸡十二指肠和回肠的黏液层厚度,添加苏氨酸可显著增加黏液的分泌且不依赖MUC2的基因表达[60]。然而,有研究认为苏氨酸添加对蛋鸡杯状细胞数量、绒毛高度和黏膜厚度等肠道形态指标无影响[61]。在肠道屏障研究中,中等程度的苏氨酸缺乏(每千克饲粮6.5 g苏氨酸)会显著增加仔猪回肠黏膜旁细胞通透性,改变调控旁细胞通透性的相关基因的表达,如紧密连接蛋白ZO-1、扣带蛋白、MLCK等;而每千克饲粮添加0.93 g苏氨酸可显著增加仔猪回肠旁细胞通路通透性和MUC1、ZO-1的基因表达[62]。关于苏氨酸对家禽肠道屏障影响的研究仍尚未见报道。
4.6 脱毒剂
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)是谷物中最为常见的一种真菌。给肉仔鸡饲喂DON会影响肉仔鸡十二指肠和空肠肠壁形态,显著上调空肠claudin-5的mRNA表达,但对claudin-1、ZO-1和ZO-2的mRNA表达无影响。饲粮中添加黏土类霉菌毒素吸附剂使回肠claudin-1、claudin-5、ZO-1和ZO-2的mRNA表达均上调了。饲喂DON的肉仔鸡在空肠检测到高浓度Toll样受体4和氧化应激的2个标记物亚铁血红素和黄嘌呤氧化还原酶,而在回肠浓度较低,但添加黏土类霉菌毒素吸附剂后却在回肠中浓度较高。这些结果说明黏土类霉菌毒素吸附剂导致DON在小肠较远端聚集,可影响肠道形态和屏障功能[16]。
4.7 EGF
EGF是一种小肽,对肠上皮具有很广泛的生物学作用。饲养试验显示,EGF可减少肉鸡空肠弯曲杆菌在空肠的定植及移位到肝脏和脾脏的数量;体外研究表明,空肠弯曲杆菌可黏附并入侵到犬肠上皮细胞中,破坏紧密连接蛋白claudin-4,增加肠上皮通透性和非致病的非侵入性菌大肠杆菌C25的移位;而用EGF对犬肠上皮细胞进行预处理可消除空肠弯曲杆菌对肠上皮细胞的负作用,并认为EGF改善肠道屏障功能的作用依赖于上皮细胞上EGF受体的激活[63]。
4.8 饲用酶制剂
在小麦-豆粕基础饲粮中添加木聚糖酶可通过减轻产气荚膜梭菌感染引起的肉鸡肠道组织损伤,增加回肠和空肠绒毛和隐窝比值,优化回肠肠道菌群组成,增加回肠occludin mRNA和MUC2 mRNA表达,降低回肠细胞凋亡率等来缓解气荚膜梭菌感染对肠道屏障功能造成的损伤,使血浆内毒素降低[64]。
溶菌酶作为一种存在于机体正常体液及组织中的非特异性免疫因子,能有效地水解细菌细胞壁的肽聚糖,导致细菌细胞壁的损伤。本课题组通过外源添加溶菌酶减轻了产气荚膜梭菌感染对肉仔鸡肠道造成的损伤,减少了产气荚膜梭菌在回肠的定植,抑制了回肠大肠杆菌和乳酸杆菌的过度增长,从而改善了产气荚膜梭菌感染肉仔鸡的肠道屏障功能,使脾脏细菌移位率降低[65]。
5 小结与展望
目前,关于家禽肠道屏障各方面的研究还相当少,尤其是对组成家禽肠道屏障的蛋白质的分布和功能、影响肠道通透性的信号转导途径等理论基础方面均有待大力研究。研究中检测肠道通透性的方法较多,对各种方法的灵敏性和特异性及在不同动物和细胞模型中适用性的研究较少,多种方法的联合使用是否可提高灵敏性和特异性从而来正确有效地监测仍值得探讨。此外,通过营养措施来调控肠道屏障功能的研究还主要集中于人类医学和哺乳动物上,在家禽上的应用技术及其调控机制研究还很有限,尚待全面、深入、持续地进行探索。
[1]GOSAIN A,GAMELLI R L.Role of the gastrointestinal tract in burn sepsis[J].The Journal of Burn Care& Rehabilitation,2005,26(1):85-91.
[2]VICENTE Y,DA ROCHA C,YU J K,et al.Architecture and function of the gastroesophageal barrier in the piglet[J].Digestive Diseases & Sciences,2001,46(9):1899-1908.
[3]GONZALEZ-MARISCAL L,TAPIA R,CHAMORRO D.Crosstalk of tight junction components with signaling pathways[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2008,1778(3):729-756.
[4]TURNER J R.Molecular basis of epithelial barrier regulation:from basic mechanisms to clinical application[J].The American Journal of Pathology,2006,169(6):1901-1909.
[5]PEREZ-MORENO M,FUCHS E.Catenins:keeping cells from getting their signals crossed[J].Developmental Cell,2006,11(5):601-612.
[6]MADARA J L.Intestinal absorptive cell tight junctions are linked to cytoskeleton[J].The American Journal of Physiology,1987,253:C171-C175.
[7]ANDERSON J M.Molecular structure of tight junctions and their role in epithelial transport[J].News Physiology Science,2001,16:126-130.
[8]GARROD D,CHIDGEY M.Desmosome structure,composition and function[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2008,1778(3):572-587.
[9]ANDERSON R C,DALZIEL J E,GOPAL P K,et al.The role of intestinal barrier function in early life in the development of colitis[J/OL].InTech,2012.doi:10.5772/25753.
[10]GONZÁLEZ-MARISCAL L,BETANZOS A,NAVA P,et al.Tight junction proteins[J].Progress in Biophysics and Molecular Biology,2003,81(1):1-44.
[11]BERKES J,VISWANATHAN V K,SAVKOVIC S D,et al.Intestinal epithelial responses to enteric pathogens:effects on the tight junction barrier,ion transport,and inflammation[J].Gut,2003,52(3):439-451.
[12]SUZUKI T.Regulation of intestinal epithelial permeability by tight junctions[J].Cellular and Molecular Life Sciences,2013,70(4):631-659.
[13]OZDEN O,BLACK B L,ASHWELL C M,et al.Developmental profile of claudin-3,-5,and-16 proteins in the epithelium of chick intestine[J].The Anatomical Record:Advances in Integrative Anatomy and Evolutionary Biology,2010,293(7):1175-1183.
[14]KAWASAKI K,HAYASHI Y,NISHIDA Y,et al.Developmental expression of the tight junction protein,occludin,in the gastrointestinal tract of the chick embryo[J].Histochemistry and Cell Biology,1998,109(1):19-24.
[15]SIMARD A,DI PIETRO E,RYAN A K.Gene expres-sion pattern of claudin-1 during chick embryogenesis[J].Gene Expression Patterns,2005,5(4):553-560.
[16]OSSELAERE A,SANTOS R,HAUTEKIET V,et al.Deoxynivalenol impairs hepatic and intestinal gene expression of selected oxidative stress,tight junction and inflammation proteins in broiler chickens,but addition of an adsorbing agent shifts the effects to the distal parts of the small intestine[J].PLoS One,2013,8(7):e69014.
[17]ULLUWISHEWA D,ANDERSON R C,MCNABB W C,et al.Regulation of tight junction permeability by intestinal bacteria and dietary components[J].Journal of Nutrition,2011,141(5):769-776.
[18]RAJPUT I R,LI L Y,XIN X,et al.Effect of Saccharomyces boulardii and Bacillus subtilis B10 on intestinal ultrastructure modulation and mucosal immunity development mechanism in broiler chickens[J].Poultry Science,2013,92(4):956-965.
[19]TURNER J R.Intestinal mucosal barrier function in health and disease[J].Nature Reviews Immunology,2009,9(11):799-809.
[20]LILLEHOJ E R,KIM K C.Airway mucus:its components and function[J].Archives of Pharmacal Research,2002,25(6):770-780.
[21]DEPLANCKE B,GASKINS H R.Microbial modulation of innate defense:goblet cells and the intestinal mucus layer[J].The American Journal of Clinical Nutrition,2001,73(6):1131S-1141S.
[22]NEISH A S.Microbes in gastrointestinal health and disease[J].Gastroenterology,2009,136:65-80.
[23]NEU J.Gastrointestinal maturation and implications for infant feeding[J].Early Human Development,2007,83:767-775.
[24]FAGARASAN S,KAWAMOTOS,KANAGAWA O,et al.Adaptive immune regulation in the gut:T cell-dependent and T cell-independent IgA synthesis[J].Annual Review of Immunology,2010,28(1):243-273.
[25]LUNN P G,NORTHROP-CLEWES C A,DOWNES R M.Intestinal permeability,mucosal injury,and growth faltering in Gambian infants[J].Lancet,1991,338:907-910.
[26]BJARNASON I,MACPHERSON A,HOLLANDER D.Intestinal permeability:an overview[J].Gastroenterology,1995,108(5):1566-1581.
[27]MEDDINGS J B,GIBBONS I.Discrimination of sitespecific alterations in gastrointestinal permeability in the rat[J].Gastroenterology,1998,114(1):83-92.
[28]PROSSER C,STELWAGEN K,CUMMINS R,et al.Reduction in heat-induced gastrointestinal hyperpermeability in rats by bovine colostrum and goat milk powders[J].Journal of Applied Physiology,2004,96(2):650-654.
[29]LAMBERT G P,GISOLFI C V,BERG D J,et al.Selected contribution:hyperthermia-induced intestinal permeability and the role of oxidative and nitrosative stress[J].Journal of Applied Physiology,2002,92(4):1750-1761.
[30]CAMERON H L,PERDUE M H.Stress impairs murine intestinal barrier function:improvement by glucagon-like peptide-2[J].Journal of Pharmacology and Experimental Therapeutics,2005,314(1):214-220.
[31]BERG R D,GARLINGTON A W.Translocation of certain indigenous bacteria from the gastrointestinal tract to the mesenteric lymph nodes and other organs in a gnotobiotic mouse model[J].Infection Immunity,1979,23:403-411.
[32]HALL D M,BUETTNER G R,OBERLEY L W,et al.Mechanisms of circulatory and intestinal barrier dysfunction during whole body hyperthermia[J].A-merican Journal of Physiology.Heart and Circulatory Physiology,2001,280(2):H509-H521.
[33]MAGNOTTI L J,DEITCH E A.Burns,bacterial translocation,gut barrier function,and failure[J].Journal of Burn Care & Rehabilitation,2005,26(5):383-391.
[34]GEYRA A,UNI Z,SKLAN D.Enterocyte dynamics and mucosal development in the posthatch chick[J].Poultry Science,2001,80(6):776-782.
[35]HAWORTH K E,EL-HANFY A,PRAYAG S,et al.Expression of Claudin-3 during chick development[J].Gene Expression Patterns,2005,6(1):40-44.
[36]SIMARD A,DI PIETRO E,YOUNG C R,et al.Alterations in heart looping induced by overexpression of the tight junction protein Claudin-1 are dependent on its C-terminal cytoplasmic tail[J].Mechanisms of Development,2006,123(3):210-227.
[37]UMEDA K,IKENOUCHI J,KATAHIRA-TAYAMA S,et al.ZO-1 and ZO-2 independently determine where claudins are polymerized in tight-junction strand formation[J].Cell,2006,126(4):741-754.
[38]ROBERTS S,PEREZ-GARCIA M,NEAL M,et al.Development of the small intestinal epithelial barrier function in broiler chicks[J].Poultry Science,2005,84:74-75.
[39]ROY S K,BEHRENS R H,HAIDER R,et al.Impact of zinc supplementation on intestinal permeability in Bangladeshi children with acute diarrhoea and persistent diarrhoea syndrome[J].Journal of Pediatric Gastroenterology and Nutrition,1992,15(3):289-296.
[40]STURNIOLO G C,FRIES W,MAZZON E,et al.Effect of zinc supplementation on intestinal permeability in experimental colitis[J].Journal of Laboratory and Clinical Medicine,2002,139(5):311-315.
[41]TRAN C D,HOWARTH G S,COYLE P,et al.Dietary supplementation with zinc and a growth factor extract derived from bovine cheese whey improves methotrexate-damaged rat intestine[J].The American Journal of Clinical Nutrition,2003,77(5):1296-1303.
[42]ZHANG B K,GUO Y M.Supplemental zinc reduced intestinal permeability by enhancing occludin and zonula occludens protein-1(ZO-1)expression in weaning piglets[J].British Journal of Nutrition,2009,102(5):687-693.
[43]FINAMORE A,MASSIMI M,CONTI DEVIRGILIIS L,et al.Zinc deficiency induces membrane barrier damage and increases neutrophil transmigration in Caco-2 cells[J].Journal of Nutrition,2008,138(9):1664-1670.
[44]ZHANG B K,SHAO Y X,LIU D,et al.Zinc prevents Salmonella enterica serovarTyphimurium-induced loss of intestinal mucosal barrier function in broiler chickens[J].Avian Pathology,2012,41(4):361-367.
[45]HU C H,QIAN Z C,SONG J,et al.Effects of zinc oxide-montmorillonite hybrid on growth performance,intestinal structure,and function of broiler chicken[J].Poultry Science,2013,92(1):143-150.
[46]AWAD W A,GHAREEB K,BÖHM J.Effect of addition of a probiotic micro-organism to broiler diet on intestinal mucosal architecture and electrophysiological parameters[J].Journal of Animal Physiology and Animal Nutrition,2010,94(4):486-494.
[47]CAO L,YANG X J,LIU N N,et al.Effect of L.fermentum 1.2029 on expression of tight junction protein in necrotic enteritis of chickens[J].Chinese Journal of Veterinary Science,2014,34(1):127-130.
[48]BURKHOLDER K M,THOMPSON K L,EINSTEIN M E,et al.Influence of stressors on normal intestinal microbiota,intestinal morphology,and susceptibility to Salmonella enteritidis colonization in broilers[J].Poultry Science,2008,87(9):1734-1741.
[49]QUINTEIRO-FILHO W M,RIBEIRO A,FERRAZDE-PAULA V,et al.Heat stress impairs performance parameters,induces intestinal injury,and decreases macrophage activity in broiler chickens[J].Poultry Science,2010,89(9):1905-1914.
[50]QUINTEIRO W M,GOMES A V S,PINHEIRO M L,et al.Heat stress impairs performance and induces intestinal inflammation in broiler chickens infected with Salmonella enteritidis[J].Avian Pathology,2012,41(5):421-427.
[51]SONG J,XIAO K,KE Y L,et al.Effect of a probiotic mixture on intestinal microflora,morphology,and barrier integrity of broilers subjected to heat stress[J].Poultry Science,2014,93(3):581-588.
[52]SONG J,JIAO L F,XIAO K,et al.Cello-oligosaccharide ameliorates heat stress-induced impairment of intestinal microflora,morphology and barrier integrity in broilers[J].Animal Feed Science and Technology,2013,185(3/4):175-181.
[53]SHAO Y J,GUO Y M,WANG Z.β-1,3/1,6-Glucan alleviated intestinal mucosal barrier impairment of broiler chickens challenged with Salmonella enterica serovar typhimurium[J].Poultry Science,2013,92(7):1764-1773.
[54]PARSONS B N,WIGLEY P,SIMPSON H L,et al.Dietary supplementation with soluble plantain nonstarch polysaccharides inhibits intestinal invasion of Salmonella typhimurium in the chicken[J].PLoS One,2014,9(2):e87658.
[55]LI N,LEWIS P,SAMUELSON D,et al.Glutamine regulates Caco-2 cell tight junction proteins[J].A-merican Journal of Physiology:Gastrointestinal and Liver Physiology,2004,287(3):G726-G733.
[56]LI N,NEU J.Glutamine deprivation alters intestinal tight junctions via a PI3-K/Akt mediated pathway in Caco-2 cells[J].The Journal of Nutrition,2009,139(4):710-714.
[57]SETH A,BASUROY S,SHETH P,et al.L-Glutamine ameliorates acetaldehyde-induced increase in paracellular permeability in Caco-2 cell monolayer[J].A-merican Journal of Physiology:Gastrointestinal and Liver Physiology,2004,287(3):G510-G517.
[58]REN W K,YIN J,WU M M,et al.Serum amino acids profile and the beneficial effects of L-arginine or L-glutamine supplementation in dextran sulfate sodium colitis[J].PLoS One,2014,9(2):e88335.
[59]HORN N L,DONKIN S S,APPLEGATE T J,et al.Intestinal mucin dynamics:response of broiler chicks and White Pekin ducklings to dietary threonine[J].Poultry Science,2009,88(9):1906-1914.
[60]CHEE S H,IJI P A,CHOCT M,et al.Functional interactions of manno-oligosaccharides with dietary threonine in chicken gastrointestinal tract.Ⅰ.Growth performance and mucin dynamics[J].British Poultry Science,2010,51(5):658-666.
[61]AZZAM M M M,DONG X Y,XIE P,et al.Influence of L-threonine supplementation on goblet cell numbers,histological structure and antioxidant enzyme activities of laying hens reared in a hot and humid climate[J].British Poultry Science,2012,53(5):640-645.
[62]HAMARD A,MAZURAIS D,BOUDRY G,et al.A moderate threonine deficiency affects gene expression profile,paracellular permeability and glucose absorption capacity in the ileum of piglets[J].The Journal of Nutrition Biochemistry,2010,21(10):914-921.
[63]LAMB-ROSTESKI J M,KALISCHUK L D,INGLIS G D,et al.Epidermal growth factor inhibits Campylobacter jejuni-induced claudin-4 disruption,loss of epithelial barrier function,and Escherichia coli translocation[J].Infection and Immunity,2008,76(8):3390-3398.
[64]LIU D,GUO S S,GUO Y M.Xylanase supplementation to a wheat-based diet alleviated the intestinal mucosal barrier impairment of broiler chickens challenged by Clostridium perfringens[J].Avian Pathology,2012,41(3):291-298.
[65]LIU D,GUO Y M,WANG Z,et al.Exogenous lysozyme influences Clostridium perfringens colonization and intestinal barrier function in broiler chickens[J].Avian Pathology,2010,39(1):17-24.
