川西亚高山针叶林土壤微生物及酶对林下植物去除的响应
2014-09-19黄玉梅杨万勤卢昌泰张丹桔
黄玉梅, 杨万勤, 张 健,*, 卢昌泰, 刘 旭, 王 伟, 郭 伟,张丹桔
(1. 四川农业大学生态林业研究所, 成都 611130; 2. 四川农业大学风景园林学院, 成都 611130;3. 四川农业大学旅游学院, 都江堰 611830)
生物多样性与生态系统功能(BEF)的关系是生态学领域研究的热点与难点。过去20年,利用植物[1-4]、微生物[5-7]、动物[1,8-9]等开展了生物多样性对生态系统生产力[4,10-11]、稳定性[2,12]以及营养维持[1,3,13-14]等关键生态系统过程影响的研究,取得了一批有价值的研究成果,对于人类保护环境、维持生态系统的良性循环有很强的指导意义。森林生态系统是陆地生态系统的主体,在全球碳循环中起着源和汇的作用,但受林木生长周期长、生境复杂、研究手段缺乏等因素的制约,有关森林生态系统生物多样性与生态系统功能关系的研究仍相当少见[15-16],影响了森林生态系统的可持续经营和生态功能的发挥,因此,亟待加强。大量研究表明,地上植被和土壤生物多样性与生态系统功能过程密切相关,土壤生物群落与植被的互动决定着生态系统过程,土壤生态系统可能是联系生物多样性与生态系统功能过程的桥梁与纽带[17-19]。而土壤微生物与土壤酶是森林生态系统生物元素循环和能量转换过程的积极参与者,是森林土壤肥力的重要生物学指标。因此,研究森林生态系统植物多样性变化对土壤微生物数量及酶活性的影响具有十分重要的理论和实践意义。
川西亚高山针叶林层次结构和物种丰富度相对简单、更新和演替规律清晰、结构和功能类型分化明显[20],是研究森林物种组成及其多样性变化对森林生态系统功能过程影响的天然实验室[21]。因此,本研究通过人工除灌、除草调控植物多样性的实验手段,研究川西亚高山针叶林土壤微生物数量及酶活性对林下植物去除的响应,探讨川西亚高山针叶林植物多样性下降对土壤生态过程的影响。
1 研究区概况及研究方法
1.1 研究区概况
研究区域位于四川省阿坝州理县毕棚沟(N 31°17′—31°20′, E 102°55′—102°57′),属季风性山地气候,夏季湿润多雨,冬季寒冷干燥。年均温6—12 ℃,1月均温-8 ℃,7月均温12.6 ℃,年积温为1200—1400 ℃,年降水量为600—1100 mm,年蒸发量为1000—1900 mm。主要土壤类型为湿润雏形土、淋溶土和棕色冲积土等。主要植被类型是以云杉(PiceaaspoerataMast)为建群种的亚高山针叶林。乔木层以云杉占绝对优势,其他伴生树种有青杄(P.wilsonii)、紫果云杉(P.purpurea)、川西云杉(P.likiangensisvar.balfouriana)、鳞皮冷杉(Abiessquamata)等针叶树种,并常有红桦(Betulaalbo-sinensis)、白桦(B.platyphylla)等阔叶树种的渗入。灌木层一般较发育,常以大箭竹(Sinarundinariachungii)、华西箭竹(S.nitida)、陕甘花楸(SorbuskoehneanaSchneid)、秦岭小檗(Berberiscircumserrata)、藤山柳(Clematoclethralasioclada)等为优势种。草本层一般以木坪冷蕨(Cystopterismoupinensis)、珠芽蓼(Polygonumviviparum)、西伯利亚三毛草(Trisetumsibiricum)等为优势种。
1.2 研究方法
1.2.1 样地设置
2007年7月,于四川省理县毕棚沟亚高山林区选取1988年营造的自然环境条件比较均匀一致的云杉-红桦混交林进行植物群落调查[22]。在植物群落调查基础上,设置3个面积为20 m×20 m的定位监测样地(表1)。
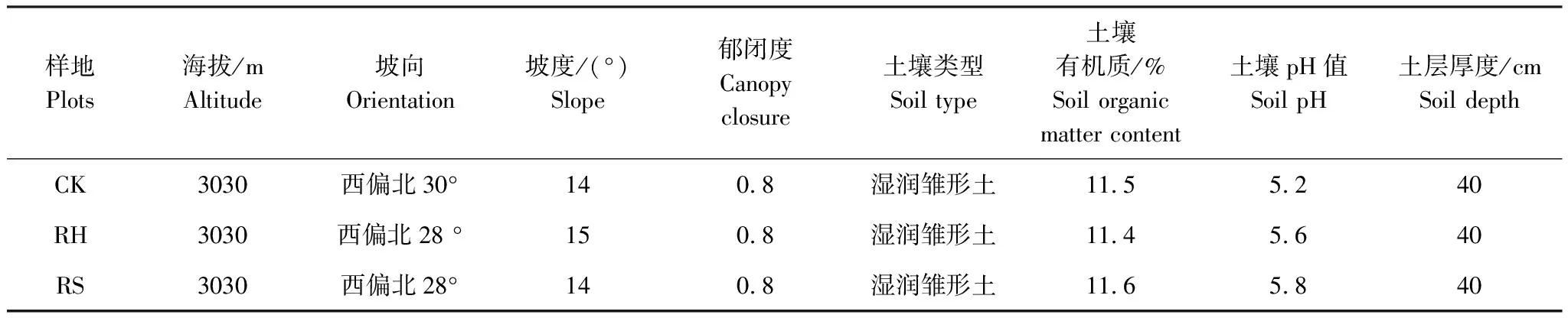
表1 样地自然环境条件
CK:对照处理;RH:除草处理Removal herb;RS:除灌处理Removal shrub
为了解森林生态系统植物功能群(生长型)多样性对土壤微生物及酶的影响,设置了人工除灌除草的林地控制实验。人工除灌实验(RS):选择定位监测样地中的一个,拔除样地内所有林下灌木植物,但保存草本植物,并将收割剩余物捡至样地外;人工除草实验(RH):选择定位监测样地中的一个,拔除样地内所有林下草本植物,但保存灌木植物,并将收割剩余物捡至样地外;另外一个定位监测样地不作任何去除处理,用作对照(CK)。为保证处理效果,以后每月中旬定期清除林下萌生的灌木植物和新生的草本植物。
1.2.2 野外采样
于2007年10月、2008年10月、2009年4月和2009年7月(除灌除草处理3个月、15个月、21个月、24个月),在3个定位监测样地内选石砾较少的地段,各挖土壤剖面3个,先收集凋落物样(30 cm×30 cm,L层),再按0—5 cm(A层)、5—10 cm(B层)、10—15 cm(C层)深度分别取土样,放入无菌袋密封,迅速带回实验室冰箱中(4 ℃)保存。
1.2.3 测试分析方法
采用平板涂抹法测定土壤微生物数量,细菌采用牛肉膏蛋白胨培养基,真菌采用马铃薯-蔗糖培养基,放线菌采用改良高氏1号培养基[23];采用3,5-二硝基水杨酸比色法测定蔗糖酶活性;采用苯酚钠-次氯酸钠比色法测定脲酶活性;采用蒽酮比色法测定纤维素酶活性;采用氯化三苯基四氮唑比色法测定脱氢酶活性[24]。
1.2.4 数据统计处理
采用单因素方差分析(One-way ANOVA)和多重比较(LSD),检验除灌、除草对土壤微生物及酶的影响。
2 结果与分析
2.1 林下植物去除对土壤微生物数量的影响
林下植物去除后,土壤细菌数量发生变化(图1),各时段均以CKRHRS,RH为CK的88.81%,RS为CK的76.35%(以L、A、B、C四层平均值表示),即除灌除草导致土壤细菌数量有所下降,并以除灌影响更大,但处理间无显著差异;土壤细菌的剖面分布具明显表聚性,以L层极显著高于A、B、C层(P<0.01),其余各层间无显著差异;土壤细菌数量随时间推移呈增长趋势,一方面是因为灌草层去除的处理效应在初期最为明显,另一方面也包含了物候效应:处理3个月和15个月时正值10月,处理21个月时正值4月,处理24个月时正值7月,受水热条件影响,7月土壤细菌数量极显著高于其余时段(P<0.01),4月土壤细菌数量显著高于10月。
林下植物去除后,土壤真菌数量也发生了变化(图2),CK、RH极显著高于RS(P<0.01),RH为CK的93.27%,RS为CK的35.78%;土壤真菌的剖面分布仍具明显表聚性,以L层极显著高于A、B、C层(P<0.01),A层显著高于B、C层(P<0.05);各处理中,以CK随土层加深递减的速率最小,RS递减的速率最大;同时,土壤真菌随土层加深递减的速率小于细菌(图1)。研究结果显示,林下植物去除后,土壤真菌占微生物总数的比例(A、B、C三层平均)也发生相应变化,其中处理3个月时,RS较CK下降74.41%,RH较CK下降6.10%;处理15个月时,RS较CK下降67.58%,RH较CK下降16.71%;处理21个月时,RS较CK下降71.67%,RH较CK下降15.42%;处理24个月时,RS较CK下降75.49%,RH较CK下降23.53%。即:林下植物去除降低了土壤中真菌在微生物总数中的比例,并以除灌处理影响大于除草处理。
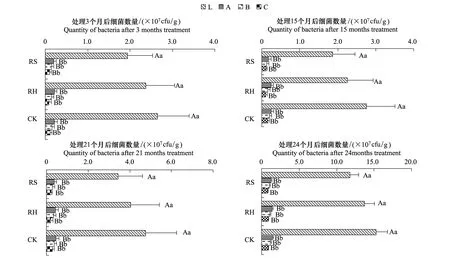
图1 林下植物去除后各处理细菌数量

图2 林下植物去除后各处理真菌数量
林下植物去除后,土壤放线菌数量随之发生改变(图3),以RH极显著高于RS(P<0.01),CK显著高于RS(P<0.05),RH为CK的102.43%,RS为CK的68.53%,即除草处理后土壤放线菌数量略有增加,而除灌处理后土壤放线菌数量显著下降;各处理放线菌的剖面分布与细菌、真菌不同,基本以A层最高,L层最低,这可能与凋落物的分解程度有关。在森林凋落物分解过程中,早期的分解主要是在细菌和真菌的作用下完成,当真菌和绝大多数细菌都停止发育后,放线菌才开始在半分解的凋落物层大量生长繁殖[19];各处理土壤放线菌随时间的变化趋势与细菌、真菌基本相同。
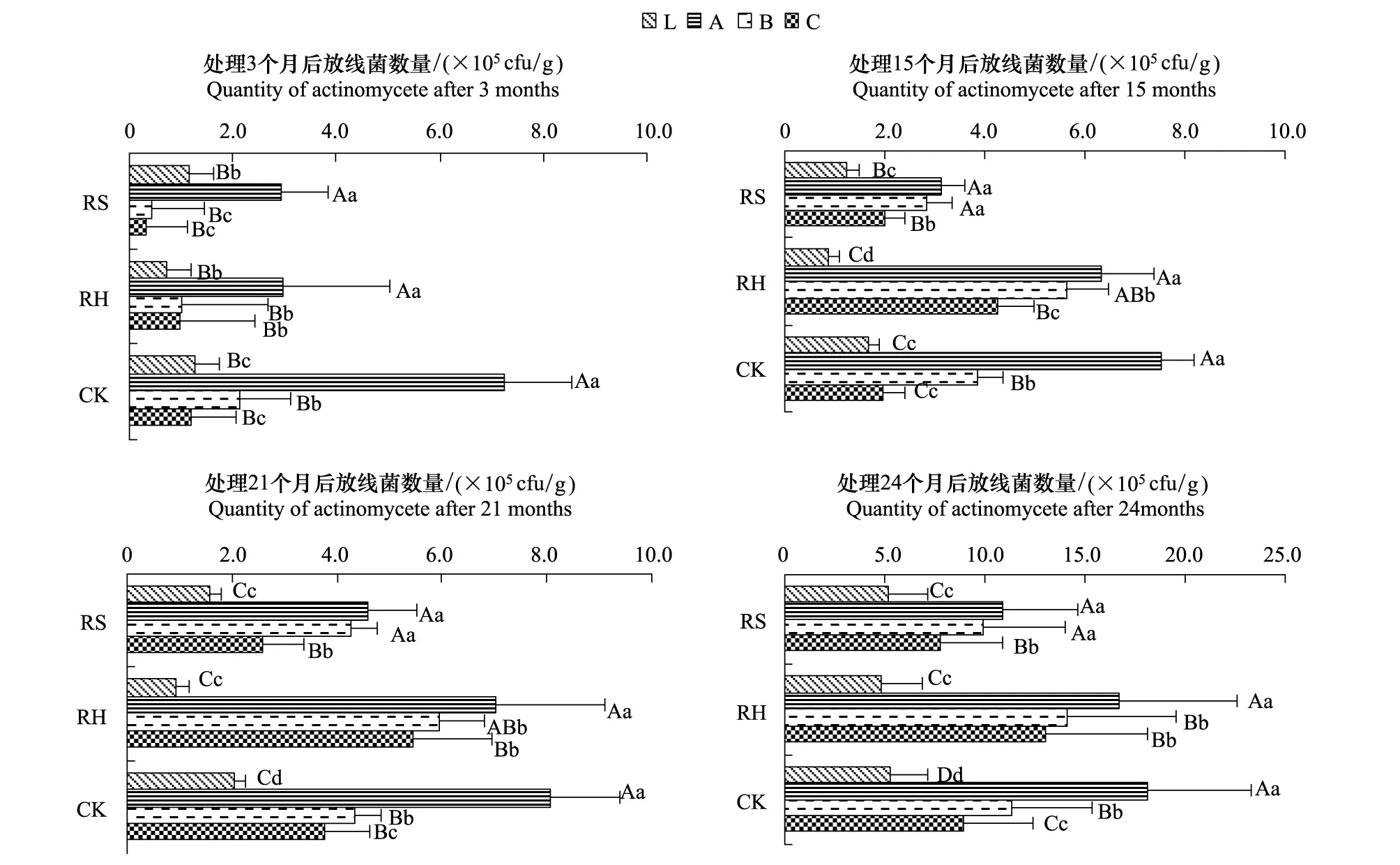
图3 林下植物去除后各处理放线菌数量
林下植被去除后,土壤微生物总数也发生相应变化(图4),以CK最大,RH次之,RS最小,RH为CK的89.27%,RS为CK的75.63%,但处理间无显著差异;各处理土壤微生物总数的剖面分布规律与细菌基本一致,具有明显表聚性,以L层极显著高于A、B、C层(P<0.01),其余各层间无显著差异;各处理土壤微生物总数随时间推移的变化趋势与细菌相似。
2.2 林下植物去除对土壤酶活性的影响
处理3个月时,各土层蔗糖酶活性均以CK>RH>RS(图5),RH为CK的57.47%,RS为CK的39.37%,CK极显著高于RH和RS(P<0.01),RH显著高于RS(P<0.05);处理15个月时,各土层蔗糖酶活性均以CK>RH>RS,RH为CK的80.65%,RS为CK的62.5%,CK极显著高于RH和RS(P<0.01),RH极显著高于RS(P<0.01);处理21个月时,各土层蔗糖酶活性均以CK>RH>RS,RH为CK的79.37%,RS为CK的58.48%,CK极显著高于RH和RS(P<0.01),RH极显著高于RS(P<0.01);处理24个月时,L层蔗糖酶活性以RS>RH>CK,其余各土层以CK>RH>RS,但无显著差异。以上分析表明,除灌处理对土壤蔗糖酶活性的影响大于除草处理,并且处理效应以初期最为明显,随时间推移,各处理与对照的差距逐渐缩小。
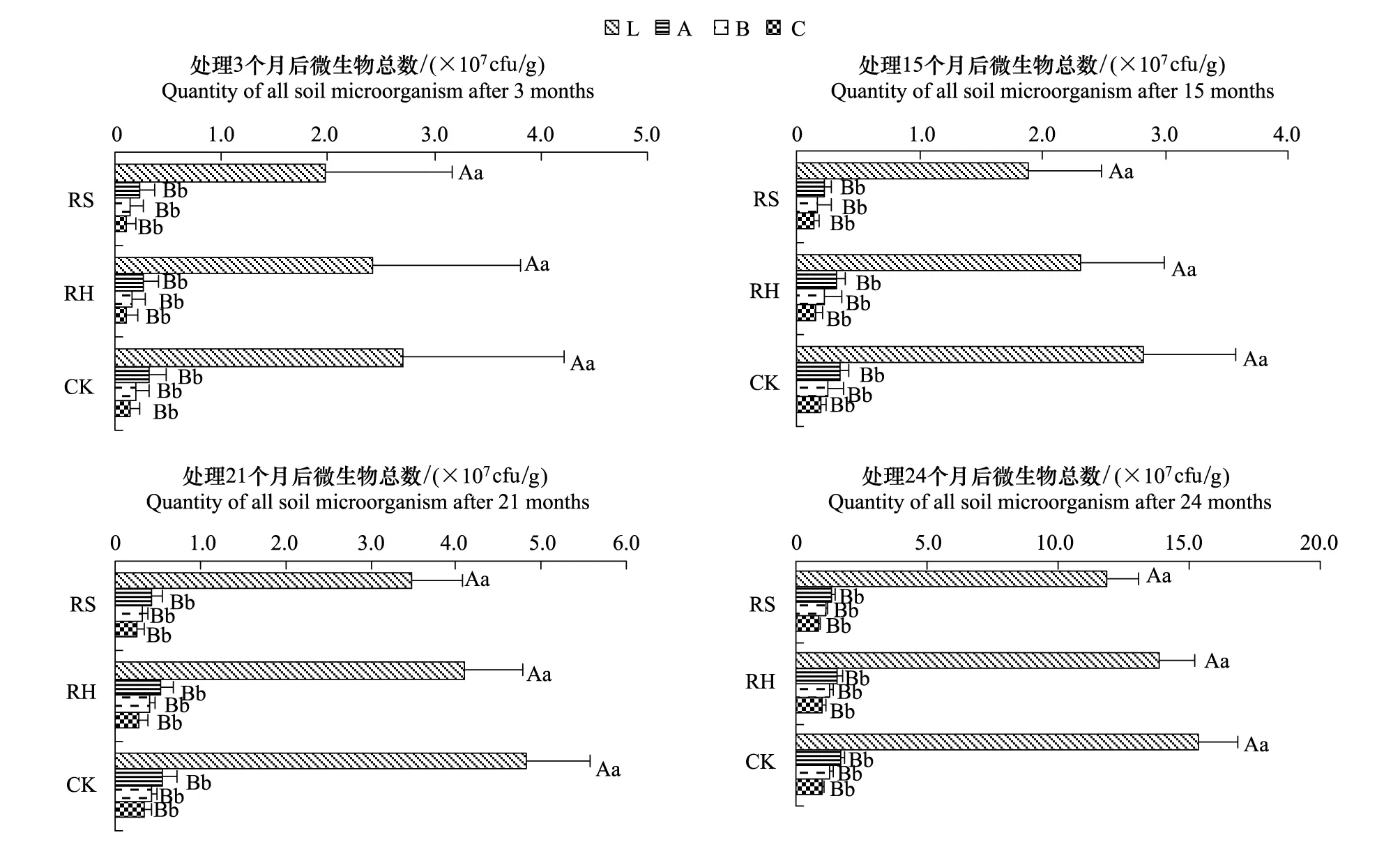
图4 林下植物去除后各处理土壤微生物总数

图5 林下植物去除后各处理土壤蔗糖酶活性
各时段土壤脲酶活性均以CK>RH>RS(图6), 其中,处理3个月时,RH为CK的83.33%,RS为CK的62.11%,CK极显著高于RS(P<0.01);处理15个月时,RH为CK的76.34%,RS为CK的60.61%,CK极显著高于RS(P<0.01);处理21个月时,RH为CK的88.5%,RS为CK的66.67%,CK、RH极显著高于RS(P<0.01),CK显著高于RH(P<0.05);处理24个月时,土壤脲酶活性以CK最高, CK极显著高于RH、RS(P<0.01)。分析表明,除灌除草处理均降低了土壤脲酶活性,但以除灌处理影响更显著。
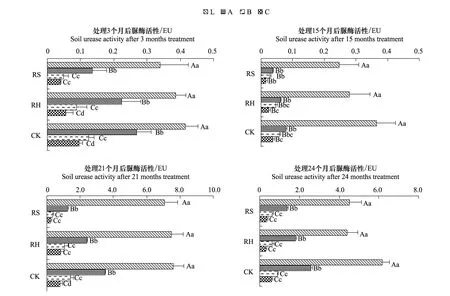
图6 林下植物去除后各处理土壤脲酶活性
林下植物去除后,土壤纤维素酶活性发生变化(图7),各时段均以CK最高,RH次之,RS最低,其中,处理3个月时,RH为CK的87.72%,RS为CK的40.65%,CK、RH极显著高于RS(P<0.01);处理15个月时,RH为CK的79.37%,RS为CK的67.57%,CK极显著高于RH、RS(P<0.01);处理21个月时,RH为CK的67.11%,RS为CK的58.82%,CK极显著高于RH和RS(P<0.01);处理24个月时,RH为CK的86.96%,RS为CK的48.78%,CK、RH极显著高于RS(P<0.01)。
林下植物去除后,土壤脱氢酶活性随之发生变化(图8),各时段均以CK>RH>RS,其中,处理3个月时,RH为CK的80%,RS为CK的56.18%,CK极显著高于RH、RS(P<0.01),RH极显著高于RS(P<0.01);处理15个月时,RH为CK的71.94%,RS为CK的58.48%,CK极显著高于RH、RS(P<0.01),RH极显著高于RS(P<0.01);处理21个月时, RH为CK的73.53%,RS为CK的53.76%,CK极显著高于RH、RS(P<0.01),RH极显著高于RS(P<0.01);实验结束时(24个月),RH为CK的61.35%,RS为CK的53.76%,CK极显著高于RH、RS(P<0.01),RH显著高于RS(P<0.05)。
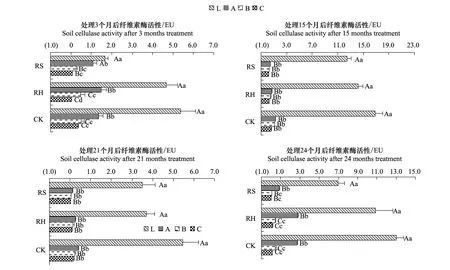
图7 林下植物去除后各处理土壤纤维素酶活性
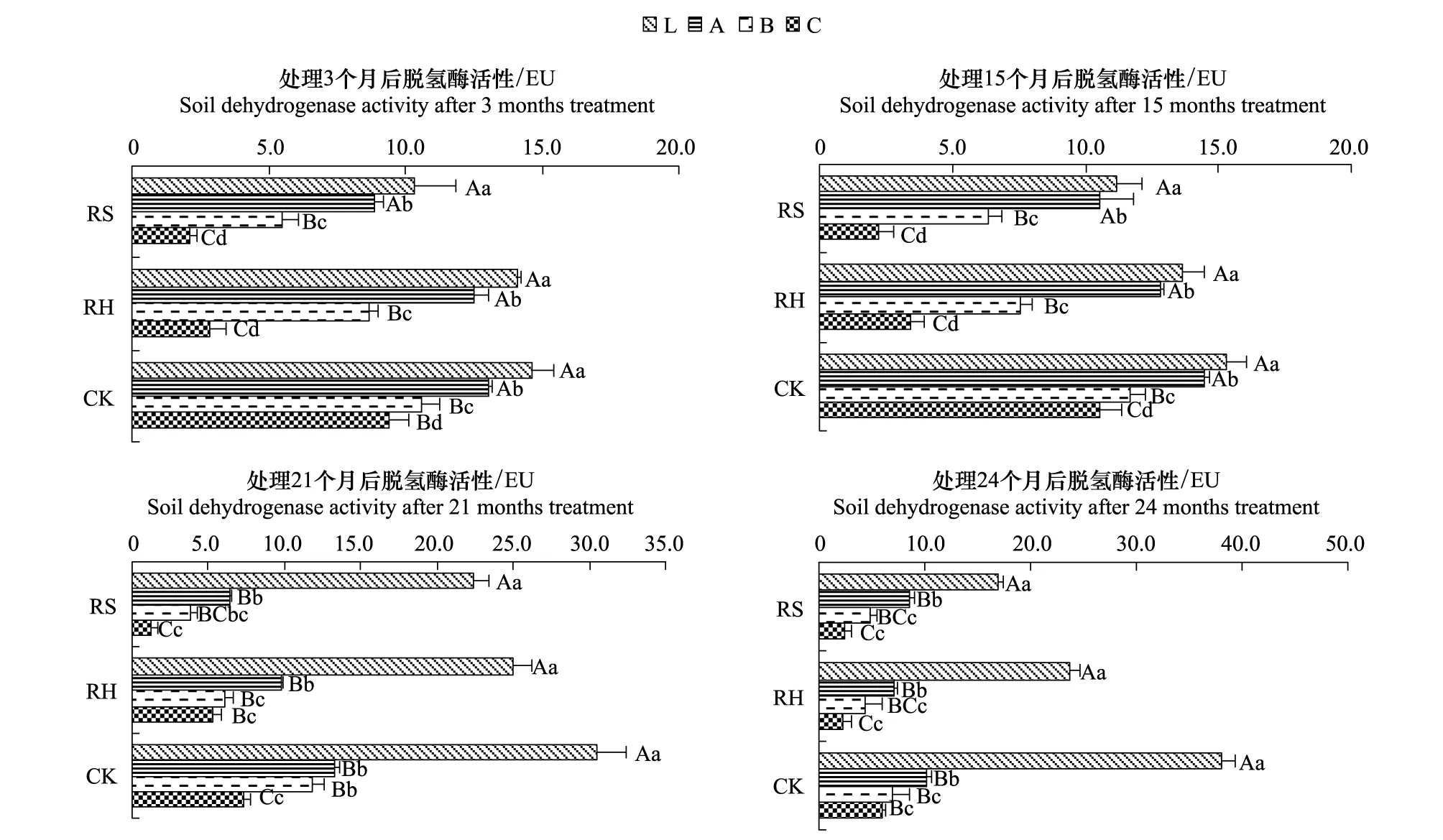
图8 林下植物去除后各处理土壤脱氢酶活性
综合来看,林下植物去除后,4种土壤酶活性均以CK>RH>RS,即除灌除草处理均降低了土壤酶活性,但以除灌处理影响更大;4种土壤酶活性均具明显表聚性,均以CK随土层加深递减的速率最小,RS递减的速率最大;4种酶中,以纤维素酶活性随土层加深递减的速率最大,脱氢酶活性递减的速率最小;4种酶中,以脱氢酶活性对除灌除草处理的反应最为灵敏,各处理间均有极显著差异。以上分析表明,除灌除草处理虽没有改变土壤酶活性随土层加深递减的趋势,但可能改变了养分在各土层间的分配,扩大了层次间的差距;不同的土壤酶催化不同的生物化学反应,土壤剖面上各种酶活性的变化规律很可能与底物的数量和质量有关。
3 讨论与结论
3.1 土壤微生物数量对林下植物去除的响应
植被是土壤微生物赖以生存的有机营养物的重要来源,同时影响着土壤微生物定居的物理环境。当植物层次去除后,输入土壤的凋落物种类和质量发生了改变,必然影响到以凋落物为基质的土壤微生物的数量和活性。本研究中,除土壤放线菌外,土壤细菌、真菌和微生物总数均以CK最大,RH次之,RS最小,其变化趋势与相同处理下土壤动物的响应[25]一致。灌木层生物量巨大,去除后导致凋落物输入及林地生境的变化程度远大于草本层,这很可能是除灌处理影响大于除草处理的重要原因;从土壤微生物的剖面分布来看,各处理细菌和真菌的剖面分布具明显表聚性,均以凋落物层极显著高于0—5 cm、5—10 cm、10—15 cm土层,其中以CK随土层加深递减的速率最小,RS递减的速率最大;各处理放线菌的剖面分布则以0—5 cm土层最高,凋落物层最低,分析原因可能与放线菌的生活习性、林内生境条件以及凋落物的分解程度有关。放线菌一般在真菌和绝大多数细菌停止发育后,才开始在半分解的凋落物层大量生长繁殖,因而较新鲜完整的凋落物上放线菌数量低于腐殖质层。
3.2 土壤微生物群落构成对林下植物去除的响应
土壤有机物质分解主要有真菌和细菌2种途径[26-27],其中,细菌适宜生活在中性和微碱性的环境中,而真菌适宜生活在微酸性的条件下[28],由于世界上绝大多数森林土壤呈酸性,因此在森林生态系统中真菌分解途径比细菌分解途径更重要[29]。本研究发现,林下植物去除降低植物多样性后,不仅土壤微生物数量表现为下降,同时土壤微生物群落构成也发生改变,即除灌除草后真菌比例较对照有所下降,从而削弱了真菌在有机物质分解中所起的作用,不利于亚高山针叶林酸性土壤条件下的养分元素循环。
3.3 土壤酶活性对林下植物去除的响应
森林植物残体和根系分泌物是森林土壤酶的重要来源之一,因此,森林植物多样性和物种组成与土壤酶活性密切相关。森林植被既可以因其凋落物或根系分泌物的多样性直接改变森林土壤酶活性,也可以通过改变土壤理化性质、水热状况和土壤生物区系间接影响土壤酶活性[30]。本研究中,林下植物去除后,土壤酶活性随之发生变化,各种酶活性均以CK>RH>RS,与土壤动物、微生物的响应基本吻合,由于土壤动物、微生物的分泌物及残体是土壤酶的另一重要来源[19],因而可以认为土壤酶活性对林下植物去除的响应也是土壤动物、微生物响应的必然产物。从土壤酶活性随处理时间的变化趋势来看,初期林下植物去除降低土壤酶活性的效应十分明显,随时间推移,除灌除草处理与对照的差距逐渐缩小,一方面是因为处理初期,“去除”行为本身可能会对生态系统产生干扰,而这种干扰会随时间的推移逐渐缩小[31];另一方面是因为生态系统自身具有较强的“再生”能力,只要给予足够的时间,由植物多样性减少所导致的生态系统功能下降会逐渐得到恢复,这也为退化生态系统的恢复重建提供了思路。
:
[1]Naeem S, Thompson L J, Lawler S P, Lawton J H, Woodfin R M. Declining biodiversity can alter the performance of ecosystems. Nature, 1994, 368(6473): 734-737.
[2]Tilman D, Downing J A. Biodiversity and stability in grasslands. Nature, 1994, 367(6461): 363-365.
[3]Tilman D, Wedin D, Knops J. Productivity and sustainability influenced by biodiversity in grassland ecosystems. Nature, 1996, 379(6567): 718-720.
[4]Hector A, Schmid B, Beierkuhnlein C, Caldeira M C, Diemer M, Dimitrakopoulos P G, Finn J A, Freitas H, Giller P S, Good J, Harris R, Högberg P, Huss-Danell K, Joshi J, Jumpponen A, Körner C, Leadley P W, Loreau M, Minns A, Mulder C P H, O′Donovan G, Otway S J, Pereira J S, Prinz A, Read D J, Scherer-Lorenzen M, Schulze E D, Siamantziouras A S D, Spehn E M, Terry A C, Troumbis A Y, Woodward F I, Yachi S, Lawton J H. Plant diversity and productivity experiments in European grassland. Science, 1999, 286(5442): 1123-1127.
[5]Naeem S, Li S B. Biodiversity enhances ecosystem reliability. Nature, 1997, 390(6659): 507-509.
[6]McGrady-Steed J, Harris P M, Morin P J. Biodiversity regulates ecosystem predictability. Nature, 1997, 390(6656): 162-165.
[7]Naeem S, Hahn D R, Schuurman G. Producer-decomposer co-dependency influences biodiversity effects. Nature, 2000, 403(6771): 762-764.
[8]Duffy J E, Richardson J P, Canuel E A. Grazer diversity effects on ecosystem functioning in seagrass beds. Ecology Letters, 2003, 6(7): 637-645.
[9]Ives A R, Cardinale B J, Snyder W E. A synthesis of subdisciplines: Predator-prey interactions, and biodiversity and ecosystem functioning. Ecology Letters, 2005, 8(1): 102-116.
[10]Naeem S, Håkansson K, Lawton J H, Crawley M J, Thompson L J. Biodiversity and plant productivity in a model assemblage of plant species. Oikos, 1996, 76(2): 259-264.
[11]Tilman D, Reich P B, Knops J, Wedin D, Mielke T, Lehman C. Diversity and productivity in a long-term grassland experiment. Science, 2001, 294(5543): 843-845.
[12]Jiang X L, Zhang W G, Wang G. Biodiversity effects on biomass production and invasion resistance in annual versus perennial plant communities. Biodiversity and Conservation, 2007, 16(6): 1983-1994.
[13]Naeem S, Thompson L J, Lawler S P, Lawton J H, Woodfin R M. Empirical evidence that declining species diversity may alter the performance of terrestrial ecosystems. Philosophical Transactions of the Royal Society B: Biological Science, 1995, 347(1321): 249-262.
[14]Wang Z H, Duan C Q, Hou Y P, Yang J S. The relationship of plant species diversity to ecosystem function in relation to soil conservation in semi-humid evergreen forests, Yunnan province, China. Journal of Plant Ecology, 2006, 30(3): 392-403.
[15]Wardle D A, Zackrisson O. Effects of species and functional group loss on island ecosystem properties. Nature, 2005, 435(7043): 806-810.
[16]Ball B A, Bradford M A, Coleman D C, Hunter M D. Linkages between below and aboveground communities: Decomposer responses to simulated tree species loss are largely additive. Soil Biology & Biochemistry, 2009, 41(6): 1155-1163.
[17]Behan-Pelletier V, Newton G. Linking soil biodiversity and ecosystem function-the taxonomic dilemma. Bioscience, 1999, 49(2): 149-153.
[18]van der Putten W H, Brown V K, Dhillion S S, van Dijk C, Gormsen D, Hedlund K, Korthals G W, Lavorel S, Leps J, Mortimer S, Rodriguez-Barrueco C, Roy J, Rundgren S, Smilauer P. Interactions between soil biodiversity, vegetation and ecosystem processes // Wolters V, ed. Functional Implication of Biodiversity in Soil. Brussels: Ecosystems Research Report 24, 1997: 87-96.
[19]Yang W Q, Zhang J, Hu T X, Sun H. Forest Soil Ecology. Chengdu: Sichuan Science and Technology Press, 2006: 87-88.
[20]Wang K Y, Yang W Q, Song G Y. Ecosystem Process of Subalpine Forests in Western Sichuan. Chengdu: Sichuan Science and Technology Press, 2004: 1-10.
[21]Yang W Q, Wang K Y. Advances in soil ecosystem process of subalpine forest in western Sichuan. World Sci-Tech R & D, 2003, 25(5): 33-40.
[22]Song Y C. Vegetation Ecology. Shanghai: East China Normal University Press, 2001: 550-650.
[23]Guan S Y. Soil Esnzyme and Its Research Methods. Beijing: China Agriculture Press, 1986: 274-320.
[24]The Microbe Staff Room of Institute of Soil Science Chinese Academy of Science. Soil Microbe Research Method. Beijing: Science Press, 1985: 43-59.
[25]Huang Y M, Yang W Q, Zhang J, Lu C T, Liu X, Wang W, Guo W. Response of soil faunal community to simulated understory plant loss in the subalpine coniferous plantation of western Sichuan. Acta Ecologica Sinica, 2010, 30(8): 2018-2025.
[26]Chen X Y, Liu M Q, Hu F, Mao X F, Li H X. Contributions of soil micro-fauna (protozoa and nematodes) to rhizosphere ecological functions. Acta Ecologica Sinica, 2007, 27(8): 3132-3143.
[27]Cao Z P, Li D P, Han X M. The fungal to bacterial ratio in soil food webs, and its measurement. Acta Ecologica Sinica, 2011, 31(16): 4741-4748.
[28]Hu Y L, Wang S L, Yan S K. Research advances on the factors influenceing the activity and community structure of soil microorganism. Chinese Journal of Soil Science, 2006, 37(1): 170-176.
[29]Wu J H, Song C Y, Chen J K. Effect of microbivorous nematodes on plant growth and soil nutrient cycling: a review. Biodiversity Science, 2007, 15(2): 124-133.
[30]Yang W Q, Wang K Y. Advances in forest soil enzymology. Scientia Silvae Sinicae, 2004, 40(2): 152-159.
[31]Lepš J. Variability in population and community biomass in a grassland community affected by environmental productivity and diversity. Oikos, 2004, 107(1): 64-71.
参考文献:
[14]王震洪, 段昌群, 侯永平, 杨建松. 植物多样性与生态系统土壤保持功能关系及其生态学意义. 植物生态学报, 2006, 30(3): 392-403.
[19]杨万勤, 张健, 胡庭兴, 孙辉. 森林土壤生态学. 成都: 四川科学技术出版社, 2006: 87-88.
[20]王开运, 杨万勤, 宋光煜. 川西亚高山森林群落生态系统过程. 成都: 四川科学技术出版社, 2004: 1-10.
[21]杨万勤, 王开运. 川西亚高山针叶林土壤生态过程的研究. 世界科技研究与发展, 2003, 25(5): 33-40.
[22]宋永昌. 植被生态学. 上海: 华东师范大学出版社, 2001: 550-650.
[23]关松荫. 土壤酶及其研究法. 北京: 中国农业出版社, 1986: 274-320.
[24]中国科学院南京土壤所微生物室. 土壤微生物研究法. 北京: 科学出版社, 1985: 43-59.
[25]黄玉梅, 杨万勤, 张健, 卢昌泰, 刘旭, 王伟, 郭伟. 川西亚高山针叶林土壤动物群落对模拟林下植物丧失的响应. 生态学报, 2010, 30(8): 2018-2025.
[26]陈小云, 刘满强, 胡锋, 毛小芳, 李辉信. 根际微型土壤动物——原生动物和线虫的生态功能. 生态学报, 2007, 27(8): 3132-3143.
[27]曹志平, 李德鹏, 韩雪梅. 土壤食物网中的真菌/细菌比率及测定方法. 生态学报, 2011, 31(16): 4741-4748.
[28]胡亚林, 汪思龙, 颜绍馗. 影响土壤微生物活性与群落结构因素研究进展. 土壤通报, 2006, 37(1): 170-176.
[29]吴纪华, 宋慈玉, 陈家宽. 食微线虫对植物生长及土壤养分循环的影响. 生物多样性, 2007, 15(2): 124-133.
[30]杨万勤, 王开运. 森林土壤酶的研究进展. 林业科学, 2004, 40(2): 152-159.
