青蒿琥酯对实验性自身免疫性重症肌无力大鼠的免疫调节作用*
2014-09-17张新欣李晓丽李秀华李衍滨
张新欣 李晓丽 庄 珊 刘 深 李秀华 李衍滨△
(1潍坊医学院临床学院,山东 潍坊 261053;2山东大学附属千佛山医院,山东 济南 250014;3山东中医药大学,济南 250014)
重症肌无力(myasthenia gravis,MG)主要由乙酰胆碱受体抗体(acetylcholine receptor,AChR)介导、细胞免疫依赖、补体参与的自身免疫性疾病[1]。大量高亲和力AChR抗体与神经肌肉突触后膜上的AChR结合后通过激活补体而导致AChR的破坏或消失[2]。临床上表现为晨轻暮重,活动后加重、休息后减轻的骨骼肌无力现象。本文通过建立实验性自身免疫性重症肌无力动物模型(experimental autoimmune myasthenia gravis,EAMG),探讨青蒿琥酯对实验性自身免疫性重症肌无力大鼠TNF-α、IgG2a、IgG2b的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 雌性Lewis大鼠(北京维通利华实验动物技术有限公司)。
1.1.2主要试剂 抗原系人工合成的大鼠来源的AChR α亚基97-116 肽段,肽序列 DGDFAIVKFT-KVLLDYTGHI(西安联美生物科技有限公司);青蒿琥酯(广西桂林药业股份有限公司);H37Ra结核杆菌(美国 Difco公司);RPMI 1640(北京HyClone公司);胎牛血清(美国Gibco公司);生物素标记兔抗大IgG、HRP标记的链霉亲和素(北京博奥森生物技术有限公司)。
1.2 方法
1.2.1EAMG模型的诱导[3]和临床评分 将人工合成的大鼠来源的AChR α亚基肽段溶于灭活结核杆菌和不完全弗氏佐剂(incomplete freund's adjuvant,IFA)中,于每只大鼠每侧后足垫皮下分别注射100 μl抗原乳液。第1次接种11d后再次强化免疫。首次免疫的当天标记为0d。采用双盲隔日称体重并观察大鼠症状。用Lennon临床评分测量肌力。
1.2.2分组与治疗 将15只大鼠随机分为青蒿琥酯大剂量组(100 mg/kg)、小剂量组(10 mg/kg)和对照组(生理盐水)。于免疫后第10天,即EAMG大鼠发病初期,每日给予灌胃治疗,直至大鼠发病高峰期第43天。
1.2.3淋巴结MNC悬液的制备 无菌条件下,取腹股沟淋巴结,放入盛有2ml RPMI1640培养基的离心管中;将离心管中的淋巴结倒至培养皿中的细胞滤器中,加入2ml RPMI1640后用无菌针栓进行研磨,制备淋巴结MNC悬液。
1.2.4流式检测淋巴结MNC中TNF-α+淋巴细胞的百分比 每管取1×106个淋巴结MNC,加入含0.5%BSA的PBS洗涤细胞,离心后弃上清并混匀;加入2%甲醛固定,离心,加入含0.5%BSA的PBS洗涤细胞,离心后弃上清并混匀,加入0.5%皂甙室温下避光20 min,洗涤细胞后,加入FITC标记的小鼠抗大鼠TNF-α抗体,孵育后加入含0.5% BSA的PBS洗涤细胞;离心、重悬、过滤后上机。
1.2.5ELISA法检测EAMG大鼠血清中抗R97-116 IgG2a、IgG2b抗体 用ELISA法测不同组大鼠血清中抗R97-116抗体的含量。将 R97-116肽溶于包被液中,加入96孔板中,4℃过夜;弃包被液,用含0.05%的Tween 20洗板;然后加入含10% FBS的封闭液200 μl /孔,室温1.5 h;弃液;加入稀释血清,室温2 h;洗板后兔抗大鼠IgG;洗板,加入TMB显色;然后加入终止液,酶标仪快速读数,结果以光密度值(OD值)表示。
1.3 统计学方法
采用SPSS17. 0对数据进行统计学分析。
2 结果
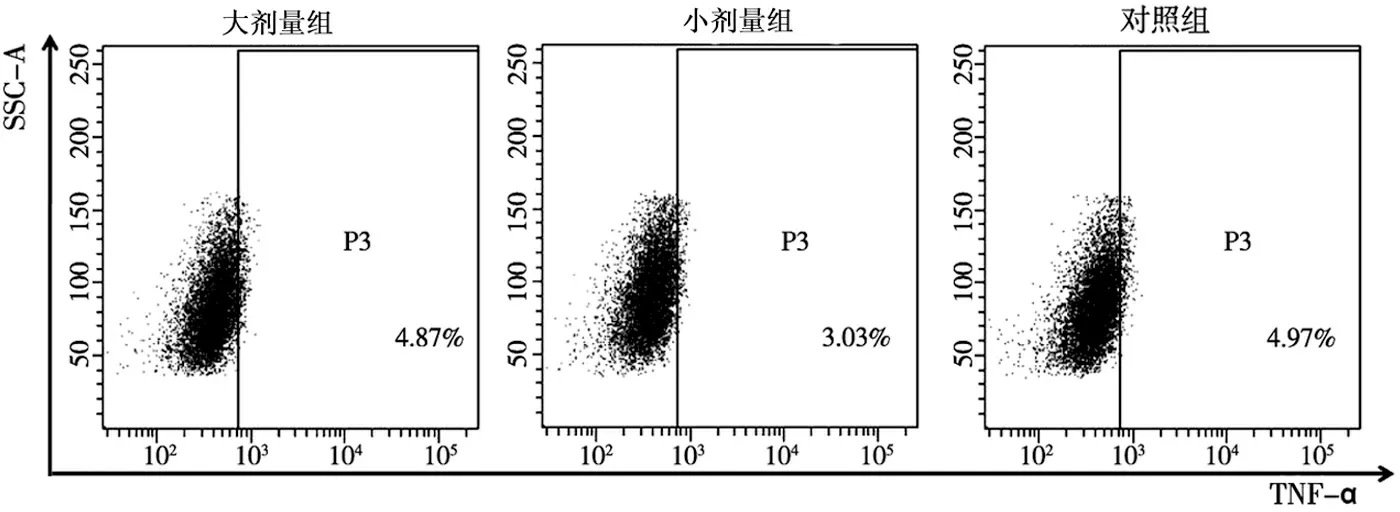
2.1 青蒿琥酯对TNF-α+淋巴细胞百分比的影响
大剂量组和小剂量组TNF-α+淋巴细胞的百分比分别为(4.87 ± 1.5)%和(3.03 ± 0.35)%,对照组TNF-α+淋巴细胞的百分比为(4.9 ± 0.31)%,与对照组相比,青蒿琥酯小剂量治疗组明显下调了TNF-α+细胞的数量(P=0.046),青蒿琥酯大剂量组TNF-α细胞的数量有所下降,但差异无统计学意义(P=0.901)。(图1)
2.2 青蒿琥酯对EAMG大鼠血清R97-116 IgG2a水平的影响
与对照组相比,青蒿琥酯两治疗组中血清IgG2a抗体水平明显下降(P<0.05),并且小剂量组血清IgG2a抗体下降趋势较大剂量组显著(P=0.044),说明青蒿琥酯可以降低血清中抗R97-116 IgG2a抗体水平。在两组中,小剂量组R97-116 IgG2a抗体量下降的幅度更明显。(见表2,图2)


*P< 0.05

*P< 0.05,**P< 0.01
图2 青蒿琥酯对血清中抗R97-116 IgG2a抗体水平的影响
2.3 青蒿琥酯对EAMG大鼠血清中R97-116 IgG2b水平的影响
与对照组相比,青蒿琥酯两治疗组中血清IgG2b抗体水平明显下降(P<0.05),且在两治疗组中,小剂量组IgG2b抗体水平下降幅度更加显著(P<0.0001)。说明青蒿琥酯可以降低血清中抗R97-116 IgG2b抗体水平,10 mg/kg青蒿琥酯小剂量治疗组中R97-116 IgG2b抗体量下降幅度更明显。(见表3,图3)

表3 各组R97-116 IgG2b抗体水平的比较

**P<0.01,***P<0.001
图3 青蒿琥酯对血清中抗R97-116 IgG2b抗体水平的影响
3 讨论
本文结果显示,与对照组和大剂量组相比,小剂量组青蒿琥酯能够明显降低TNF-α+细胞的数量,抑制 TNF-α的表达和分泌,从而诱导免疫耐受或延迟免疫应答,与此同时,小剂量组中EAMG大鼠血清抗R97-116 IgG2a和IgG2b的水平也是显著降低的,以上可以证明,小剂量的青蒿琥酯能够通过免疫调节作用改善EAMG大鼠的病情。
青蒿琥酯是具有过氧桥结构的倍半萜内酯化合物青蒿素的水溶性衍生物,现在临床上主要用于疟疾的治疗[4]。近些年来,人们研究发现,在一些自身免疫性疾病中,青蒿素及其衍生物有显著的免疫调节作用。它们能够抑制B淋巴细胞的增殖及相关自身免疫性抗体的产生。青蒿琥酯对实验性系统性红斑狼疮有显著的治疗作用,它可以抑制B淋巴细胞的增殖、分化来减少anti-dsDNA抗体的产生,下调血清中单核趋化蛋白-1(MCP-1)的水平,减少TNF-α的表达[5]。另外,在脓毒血症的小鼠中,青蒿琥酯能够通过抑制TLR4和TLR9信使RNA的表达和转录因子NF-κB的激活减少炎症因子TNF-α和IL-6的释放[6]。
细胞因子TNF-α在许多自身免疫性疾病中发挥着重要作用,例如湿性关节炎[7]、狼疮性肾炎[8]、败血症性休克[9]等。TNF-α可以通过 IL-2 / IL-2R通路,上调 IL-2Rα刺激T细胞增殖,促进体内的免疫应答的发生。而在MG的发病机制中TNF-α也起着极为重要的作用。Wang等发现,给予大鼠IFN-γ后能够加重EAMG的症状,这与增加TNF-α应答及抗AChR抗体水平及有关[10]。MG患者血清TNF-α水平明显高于正常人,胆碱酯酶抑制剂、激素治疗或胸腺手术后血清TNF-α水平下降,患者的肌无力症状也得到了一定程度的改善。抗TNF-α抗体治疗可缓解AChR诱导的 EAMG大鼠病情[11]。近年来临床上用抗TNF-α抗体治疗MG患者取得显著疗效可进一步证实这一观点。促炎因子在EAMG的发生和发展中,并不是独自发挥作用,而是相互促进协调进行的。TNF-α也是这样的,它的产生可以促进IL-1、IL-12等细胞因子的分泌,继而活化Th1细胞。在小鼠EAMG模型中,Th1细胞起着重要的致病作用,因为它们能够刺激抗AChR抗体的产生并引起神经肌肉接头功能的失调[12]。有研究表明,Th1型细胞通过分泌TNF-α等细胞因子促进B细胞产生IgG2,血清中的IgG2可以高效的与神经肌肉接头处突出后膜上的AChR结合并激活补体最终导致肌无力的发生与发展[13]。本文结果显示,与对照组和大剂量组相比,小剂量青蒿琥酯治疗组明显抑制了TNF-α的生成与分泌,显著降低了血清中IgG2a、IgG2b的水平,这也可以证明,小剂量青蒿琥酯可以通过抑制细胞因子TNF-α的分泌来降低IgG2a、IgG2b的产生,从而缓解EAMG大鼠病情。
乙酰胆碱是骨骼肌收缩所必需的一种神经递质,与AChR结合后才起生物作用。重症肌无力患者的AChR的破坏与患者体内存在AChR-Ab有关。因此测定AChR-Ab是诊断和判断预后有关。有人研究发现几乎85%~90%以全身症状为主的MG 患者血清中可检测到AChR-Ab[14]。AChR-Ab被认为是MG的主要致病因子,是介导MG发生的关键因素。MG患者的AChR-Ab主要是IgG型,以IgGl、IgG2、IgG3为主,其他亚型抗体少见。我们在实验中检测了与AChR具有较高结合能力的IgG2a、IgG2b来反应EAMG大鼠的预后。与对照组相比,青蒿琥酯治疗组能够明显缓解EAMG大鼠的症状,与最终降低的抗R97-116 IgG2a和IgG2b抗体水平密切相关,而且两治疗组相比较,小剂量组青蒿琥酯的疗效明显优于大剂量组。
本文结果表明,小剂量青蒿琥酯可以明显缓解EAMG大鼠的症状,与最终降低的抗R97-116 IgG2a和IgG2b抗体水平密切相关,且这种作用可能是通过减少TNF-α的合成与分泌来抑制B细胞的活化实现的。总之,小剂量青蒿琥酯对EAMG有显著的治疗作用,将为MG的临床治疗提供新的策略和方法。
:[1] Vincent A,Palace J,D Hilton-Jones D,et al. Myasthenia gravis[J]. Lancet,2001,357: 2122-2128.
[2] Thiruppathi M,Sheng JR,Li L,et al. Recombinant IgG2a Fc (M045) multimers effectively suppress experimental autoimmune myasthenia gravis[J]. J Autoimmun,2014,S0896-8411(13):161-163.
[3] Froehner SC,Rafto S. Comparison of the subunits of Torpedo californica acetylcholine receptor by peptide mapping[J]. Biochemistry,1979,18(2):301-307.
[4] 朱红.青蒿琥酯治疗抗氯喹性恶性疟疾51例[J]. 济宁医学院学报,1998,21(1):41.
[5] Jin O,Zhang H,Gu Z,et al. A pilot study of the therapeutic efficacy and mechanism of artesunate in the MRL/lpr murine model of systemic lupus erythematosus[J].Cell Mol Immunol,2009,6(6):461-467.
[6] Li B,Zhang R,Li J,et al.Antimalarial artesunate protects sepsis model mice against heat-killed Escherichia coli challenge by decreasing TLR4,TLR9 mRNA expressions and transcription factor NF-κB activation[J]Int Immunopharmacol,2007,8(3): 379-389.
[7] Li Y,Wang S,Wang Y,et al. Inhibitory effect of the antimalarial agent artesunate on collagen-induced arthritis in rats through nuclear factor kappa B and mitogen-activated protein kinase signaling pathway[J]. Transl Res,2013,161(2): 89-98.
[8] Li WD,Dong YJ,Tu YY,et al. Dihydroarteannuin ameliorates lupus symptom of BXSB mice by inhibiting production of TNF-alpha and blocking the signaling pathway NF-kappa B translocation[J]. Int Immunopharmacol,2004,6(2006): 1243-1250.
[9] Li B,Zhang R,Li J,et al. Antimalarial artesunate protects sepsis model mice against heat-killed Escherichia coli challenge by decreasing TLR4,TLR9 mRNA expressions and transcription factor NF-κB activation[J]. Int Immunopharmacol,2008,8(3): 379-389.
[10] Wang HB,Shi FD,Li H,et al. Role for Interferon-γ in Rat Strains with Different Susceptibility to Experimental Autoimmune Myasthenia Gravis[J]. Clin Immunol,2000,95(2): 156-162.
[11] Duan RS,Wang HB,Yang JS,et al.Anti-TNF-α antibodies suppress the development of experimental autoimmune myasthenia gravis[J]. J Autoimmun,2002,19: 167-174.
[12] Wang W,Ostlie NS,Conti-Fine BM,et al.The susceptibility to experimental myasthenia gravis of STAT6-/-and STAT4-/-BALB/c mice suggests a pathogenic role of Th1 cells[J]. J Immunol,2004,172(1):97-103.
[13] Conti-Fine BM,Milani M,Kaminski HJ. Kaminski,Myasthenia gravis: past,present,and future[J]. J Clin Invest,2006,116(11):2843-2854.
[14] Mossman S,Vincent A,Newsom-Davis J.Myasthenia gravis without acetylcholine recetor antibody:a distinct disease entity[J]. Lancet,1986,1(8473): 116-118.
