奥曲肽长效生物可降解微球的制备及其分析方法研究
2014-09-14赵转霞刘哲鹏董堃华周逸明徐强强
赵转霞,刘哲鹏*,董堃华,周逸明,徐强强
1. 上海理工大学 医疗器械与食品学院(上海, 200093) 2. 上海医药工业研究院(上海, 200040)3. 上海苏豪逸明制药有限公司(上海, 200333)
奥曲肽长效生物可降解微球的制备及其分析方法研究
赵转霞1,刘哲鹏1*,董堃华2,周逸明3,徐强强3
1. 上海理工大学 医疗器械与食品学院(上海, 200093) 2. 上海医药工业研究院(上海, 200040)3. 上海苏豪逸明制药有限公司(上海, 200333)
目的运用已正交优化的复乳法制备三批奥曲肽PLGA长效生物可降解微球,并且建立有效的分析方法。方法利用HPLC、激光粒度仪与扫描电镜等仪器对所制备的微球进行综合质量研究。结果在该工艺条件下制得的三批微球包封率均为35%以上,载药量为8.0%以上,平均粒径为60μm左右,微球外观圆整,形态良好。结论该制备工艺稳定可靠,分析方法科学有效。
微球;奥曲肽;复乳法;分析方法
奥曲肽为一种人工合成的生长抑素类似物,具有多种生理活性,半衰期是天然抑素的30倍。目前主要治疗肢端肥大症等病症,对胃酸、胰酶、胰高血糖素和胰岛素的分泌也有抑制作用。但是作为多肽、蛋白质类药物具有分子量大, 在体内外的稳定性差, 容易降解, 生物半衰期短,生物膜通透性差等缺点, 使得多肽、蛋白质类药物的临床应用大受限制[1]。
长效生物可降解微球,不仅能够有效防止药物在体内的很快降解, 还能将药物缓慢释放从而达到长效缓释靶向目的[2]。具有疗效稳定、毒副作用小 与用量少等特点[3]。
运用复乳法(w/o/w)制备奥曲肽微球,解决了传统的水包油法中药物向外水相渗漏的问题[4],提高了水溶性药物的包封率。对复乳法制备醋酸奥曲肽微球及制备得到微球质量开展研究,通过调整制备工艺与处方对复乳法的制备工艺进行了完善。在已正交优化的实验工艺基础上制得三批奥微球。当前奥曲肽微球的质量分析方法过于单一,没有形成其综合性整体质量评价。本方法综合采用HPLC,激光粒度仪等检测方法与手段对微球包封率、载药量与粒径分布等性状进行研究,确立科学的分析方法,并考察制备方法的稳定性。
1 实验材料
1.1试剂
PLGA聚乳酸-羟基乙酸共聚物 (50:50,来源于Corp-Birmingham 分子量38 000 ),奥曲肽(shanghaisoho-yimingpharmacentical co.ltd 批号090501 纯度 99.5%),二氯甲烷、甲醇、PVA(均为国药沪试,分析纯),三批奥曲肽微球(自制,批号20120904-1,20120904-2,20120904-3)。
1.2仪器
岛津LC-20A 高效液相色谱仪,winner2005 激光粒度仪,IKA RW20 机械搅拌器,SK5200lh 超声仪,XSP-3C扫描电子显微镜。
2 实验方法
2.1含量测定方法的建立
2.1.1 检测波长确定
对奥曲肽进行全波长扫描,选择合适波长作为奥曲肽检测波长。溶液条件:取奥曲肽原料药适量,加pH=5.4的磷酸盐溶液稀释定容至100 mL容量瓶,配制成0.1 mg/mL溶液,进行全波长扫描。
2.1.2 HPLC方法评价
高效液相HPLC条件:0.02 M 磷酸溶液-乙腈(75:25)进行等度洗脱。检测波长为214 nm;流速为1 mL/min;进样量为20 μL;柱温为30℃。
2.1.2.1 标准曲线线性
配制浓度为(5、10 、50 、 100 和500 )μg/mL 的奥曲肽溶液,进样,考察其标准曲线线性。
2.1.2.2 精密度
称取奥曲肽适量,配制成浓度为0.1 mg/mL的溶液,过滤,考察进样精密度与中间精密度。
2.1.2.3 空白辅料的干扰试验
将PVA和PLGA分别溶解,配制成空白辅料,过滤,取续滤液,进样考察。
2.1.2.4 回收率试验
称取3份空白微球,每份取3个样品,奥曲肽样品标示量为30 mg,各加入相当于标示量的80%,100%和120%的醋酸奥曲肽,照上述方法测定含量。
2.1.2.5 定量限
称取奥曲肽原料药适量,配制成浓度0.1 mg/mL的溶液,并进行适度稀释,进样考察,计算S/N值。
2.1.2.6 溶液稳定性考察
称取奥曲肽适量,配制成浓度为0.1 mg/mL的溶液,过滤,取续滤液每隔2 h进行重复进样,对奥曲肽原料进行12 h的稳定性考察。
2.1.2.7 专属性考察
称取奥曲肽适量,分别溶于高温80℃、0.1 mol/L盐酸、0.1 mol/L氢氧化钠、5%双氧水的4种溶液,放置1 h,考察样品强制破坏后的专属性。
2.1.3 含量测定
高效液相HPLC条件: 0.02 M 磷酸溶液-乙腈(75:25)进行等度洗脱。检测波长为214 nm;流速为1 mL/min;进样量为20 μL,主峰理论塔板数计算应不低于3 000,分离度符合要求。
测定法:称取制备的奥曲肽PLGA微球适量,将样品在10 mL二氯甲烷中充分溶解。使用注射用水10 mL进行6次萃取,合并萃取液,转移至100 mL容量瓶中,加入25 mL乙腈,摇匀,加入蒸馏水定容至刻度,配制成约每1 mL中约含0.1 mg奥曲肽的溶液,摇匀,滤过,精密量取20 μL注入液相色谱仪,记录色谱图。
另,精密称取奥曲肽对照品适量,用水稀释制成每1 mL中约含0.1 mg奥曲肽的溶液,同法精密量取20 μL注入液相色谱仪,记录色谱图;按外标法以峰面积计算,即得。
2.2微球制备方法
经一系列的正交优化实验[5]得到的最佳处方为:
(1) 内水相药物与中油相PLGA 的重量比为1∶5;
(2) 中油相PLGA 的浓度为10%(W/V);
(3) 外水相为1% 的22 000 分子量PVA 水溶液;
(4) 中油相与外水相的体积比不小于为1∶50;
(5) 复乳化采用机械搅拌法,搅拌速度为1 200 rpm。
在此基础上建立工艺流程简图如下:内水相+中油相 → 混合溶液 → 搅拌乳化1 200 rpm → 初乳 → 加入外水相中 → 高速搅拌形成复乳,冷冻干燥。
2.3微球的质量考察
2.3.1 微球形态的研究
形态观察:取本品,用水洗去赋形剂成分,冻干,采用扫描电子显微镜观察微球形态。
2.3.2 粒度及其分布
取本品,依法《中华人民共和国药典》(2010年版)二部附录Ⅸ E 粒度和粒度分布测定法中的光散射法进行测定,用激光粒度仪进行实验并记录微球的平均粒径及其分布。
2.3.3 微球载药量及包封率考察
运用上述含量测定的方法来测定微球中的药物含量,并计算出微球的载药量和包封率。
(1)
(2)
3 实验结果与讨论
3.1含量测定方法验证结果
3.1.1 奥曲肽全波长扫描
奥曲肽溶液在214 nm,286 nm处均有吸收峰,经吸收峰的比较,其检测波长定为214 nm[6]。
3.1.2 HPLC方法评价结果
3.1.2.1 标准曲线线性 奥曲肽溶液标准曲线如图1所示。标准曲线方程为:y=10 046x,n=5,相关性系数R2= 0.999 8,得到的线性良好。

图1 标准曲线性Fig.1 standard curve
3.1.2.2 精密度
进样精密度如表1所示,样品精密度良好。

表1 进样精密度Tab.1 The accuracy test results
3.1.2.3 空白辅料干扰试验
考察辅料的干扰实验,见图2~图4空白溶剂、辅料的色谱图,药物与其他辅料峰分离良好。

图2 空白溶剂色谱图Fig.2 Chromatograms of Blank solvent

图3 辅料PLGA对照色谱图Fig.3 Chromatograms of accessory PLGA

图4 辅料PVA对照色谱图Fig.4 Chromatograms of accessory PVA
3.1.2.4 回收率考察
平均回收率为99.88%,RSD值为1.12%。
3.1.2.5 定量限考察
奥曲肽在该条件下的定量限为38.3 ng/mL,S/N为10.04,符合定量限要求。
3.1.2.6 溶液稳定性的考察
稳定性考察12 h,RSD值为0.11%,供试品稳定性良好
3.1.2.7 专属性考察
在高温、酸、碱与氧化的条件下,主峰与各杂质峰分离良好。
总结,该液相方法经过方法学验证,科学可靠,可以运用为奥曲肽微球的含量测定方法[8]。
3.2三批微球的质量考察结果
用上述处方工艺参数制得三批微球,API投入量分别为31.31 mg,31.30 mg, 32.03 mg。制得微球总质量收率为61.5%、62.3%、61.1%。
对三批微球进行微球形态,粒径分布,包封率,载药量等指标进行考察,得到如下结果。
3.2.1 包封率及载药量测定
三批微球的包封率都在35%以上(见表3),在同类微球制备工艺相比,达到比较好的效果,说明该方法科学可靠。
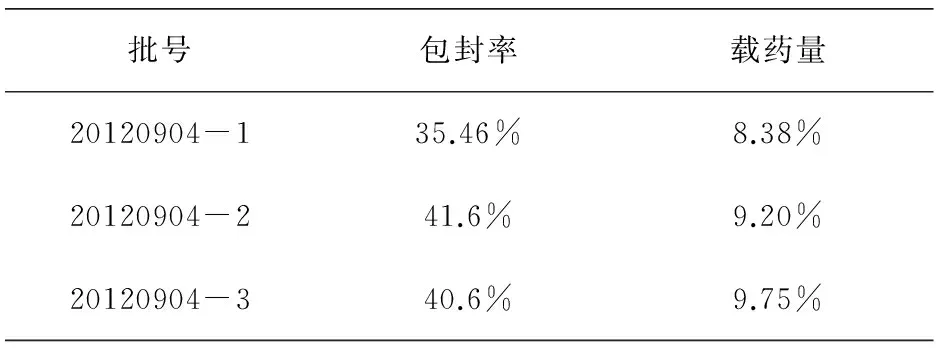
表3 包封率与载药量Tab.3 The envelopment rate and drug loadings
3.2.2 三批粒径分布
微球粒径的分布及形态对其缓释效果有较大的影响, 具体粒径分布系如表4 所示。从表4可以看出,得微球的粒径分布比较集中,并且每批之间相差甚小,重现性好。

表4 样品粒径分布结果Tab.4 Particle size distribution results
3.2.3 扫描电镜结果
三批微球在扫描电镜观察下微球形态圆整(见图5),微球表面光滑,微球粒径大小基本集中在20 μm~80 μm之间,基本形态较为理想,为微球的长效缓释提供了依据。

图5 电镜扫描图Fig.5 Electron microscope scanning figure
3.3三批样品质量考察结果统计

表5 三批样品质量考察结果Tab.5 Three batch sample quality inspection results
通过对三批微球全面科学的质量考察,结果表明,在已经优化的工艺条件下制得微球的包封率及载药量较高,微球形态良好,粒径适中,重现性良好。
4 讨论
在正交优化实验的基础上,确定了最佳工艺处方,并在该条件下制备得到三批样品,建立综合的质量分析方法,通过对微球形态、粒度及分布、对载药量等多个因素进行考察,结果表明微球的形态良好,粒度分布集中,载药量包封率达到甚至在原研之上。
该方法处方工艺简单可控,分析方法科学可靠,有望实现工业化生产。
[1] 刘志峰,李萍,刘珂.奥曲肽的研究和应用进展[J].青岛大学医学院学报,2001(02):164-167.
[2] Hunter SJ, Shaw JA, Lee KO, et al. Comparison of monthly intramuscular injections of sandostatin LAR with multiple subcutaneous injections of octreotide in the treatment of acromegaly: Effects on growth hormone and other markers of growth hormone secretion [J]. Clin Endocrinol (Oxf), 1999, 50(2): 245-251.
[3] 杨建军,孟延飞,魏晓萍.生长抑素及其类似物的临床应用研究[J].延安大学学报,2004,2(4): 50-51.
[4] 陈庆华,瞿文.多肽、蛋白质类药物缓释剂型的研究进展[J] 中国药学杂志,2000,35(3):147-150.
[5] 董堃华,刘哲鹏.奥曲肽长效生物可降解微球的制备工艺研究[J]应用化工,2012,06(6):45-51.
[6] 韩冰.醋酸奥曲肽微球的制备性质及其在动物体内的研究[D].吉林大学,2010,3(5):60-63.
[7] Liggins RT,Burt HM. Paclitaxel loaded poly (L-lactic acid) microspheres:properties of microspheres made with low molecular weight polymers[J]. Int. J.Pharm ,2001,222(1):19-33.
[8] Yan C, Characterization and morphological analysis of protein-loaded PLGA microspheres prepared by w/o/w emulsion technique[J].J Control Rel 1994,32(3):231-241.
[9] Hayashi Y, Yoshiko S, Aso Y, et al, Entrapment of proteins in poly (L-lactide) microspheres using reversed micelle sovent evaporation[J]. Pharm Res 1994,11(2): 337-340.
[10] 何京涛.生物降解药物控释体系中分子扩散行为及药物释放动力学研究[D].北京化工大学博士学位论文, 2005.
[11] 冯晓健.复乳法制备聚乳酸微球及其体外释药性能的测定[D].南京师范大学硕士论文, 2008.
[12] 张立德, 牟季美.纳米材料和纳米结构[M] .北京: 科学出版社, 2001.
[13] Pasquali I, Bettini R, Giordano F. Supercritical fluid technologies: An innovative approach for manipulating the solid-state of pharmaceuticals[J]. Advanced Drug Delivery Reviews, 2007, 28(6): 1-12.
[14] Leea LY, Liang KL, Huab J, et al. Jet breakup and droplet formation in near-critical regime of carbon dio-xide—dichloromethane system [J]. Chemical Eng-ineering Science, 2008, 63(13): 3366-3378.
StudyonPreparationandAnalysisofSustainedReleaseBiodegradableOctreotideMicrospheres
Zhao Zhuanxia1,Liu Zhepeng1,Dong Kunhua2,ZhouYiming3,Xu Qiangqaing3
1.School of Medical Instrument and Food Engineering,University of Shagnhai for Science and Technology(,Shanghai,200093) 2. Shanghai Institute of Pharmacetical Industry (Shanghai,200040,)3.ShanghaiI Sohoyiming Pharmaceticals Co.,Ltd (Shanghai,200333)
ObjectiveTo prepare three batches of biodegradable poly (DL-lactide-co-glycolide) (PLGA) microspheres with Octreotide inside with sustained release properties.MethodsOrthogonal optimized w/o/w craft was used to prepare the PLGA microspheres with Octreotide peptide inside. HPLC, microscope, and ultraviolet spectrophotometer were used to characterize the microspheres.ResultsThe average particle size of microspheres is aboat 60 μm and the microspheres are in shpere appearance. The encapsulation efficiency is over 35% and the drug loading rate is over 8.0%.ConclusionThe preparation method is stable and reliable and the analysis method is effective.
microsphere,octreotide,multiple emulsion method,the method of analysis
10.3969/j.issn.1674-1242.2014.03.007
赵转霞,在读硕士研究生
E-mail:zhaozhuanx1988@163.com
刘哲鹏,高级工程师,E-mail:
TQ464.7 TQ469
A
1674-1242(2014)03-0155-05
2014-06-24)
