黄河口大型底栖动物群落结构特征及其与环境因子的耦合分析
2014-09-14吴斌宋金明李学刚
吴斌,宋金明,李学刚
(1.中国科学院 海洋研究所 海洋生态与环境科学重点实验室,山东 青岛266071;2.中国科学院大学,北京100049)
黄河口大型底栖动物群落结构特征及其与环境因子的耦合分析
吴斌1,2,宋金明1*,李学刚1
(1.中国科学院 海洋研究所 海洋生态与环境科学重点实验室,山东 青岛266071;2.中国科学院大学,北京100049)
为探究复杂环境下的河口大型底栖生物群落结构特征,研究了黄河口及其毗邻海域内14个站位的底栖生物群落结构及其与主要环境因子的耦合关系。研究结果表明调查海域底栖生物群落组成和结构的空间异质性较高。底栖生物优势度不明显,优势物种集中于河口附近站位。生物多样性随离河口距离增加而增加,物种丰富度和生物多样性指数等的高值区均出现在远离河口的渤海湾和渤海中部站位,低值区位于近河口站位。对底栖生物群落的非参数多维排序(n MDS)和等级聚类分析显示,底栖生物群落结构相似性较低。丰度/生物量曲线(ABC曲线)分析显示,黄河口底栖生物群落整体上处于稳定状态,但近河口和莱州湾中西部站位受到干扰影响,群落结构不稳定。研究还表明生物量大的底栖生物(软体动物)倾向于向重金属含量较高的站位聚集。综合沉积物化学、预测毒性和底栖生物群落结构变化的评价结果可知,远离黄河口的沉积物环境质量普遍较好,而河口附近的沉积物环境质量较差。
大型底栖无脊椎动物;非参数多维排序;耦合关系;重金属;黄河口
1 引言
大型底栖无脊椎动物(简称底栖生物)是海洋生态系统物质循环和能量流动中积极的参与者,具有重要的生态学功能[1—2]。由于底栖生物具有特殊的分类多样性、广泛的生理适应特性、多样的摄食模式和营养关系,使其对多种环境胁迫具有敏感的特异性响应特征[3],研究表明底栖生物及其群落结构具有重要的环境指示作用[4—5]。例如甲壳类动物是大型底栖无脊椎动物中对环境胁迫、人为扰动最敏感的生物种;多毛类动物则是相对最不敏感的生物种,后者在胁迫环境下,种群丰度和生物种数相对于敏感的甲壳类和软体动物均呈增加的趋势[6—8]。再比如清洁河口的底栖生物多样性要比富营养化河口低,但生物密度相对较高[9];而当发生富营养化,甚至由此引起底栖环境处于厌氧状态时,河口底栖生物将以机会种为主,如海稚虫Spionidae sp.、小头虫Capitella capitata[10]。在沉积物质量综合评价领域,底栖生物常用来反映沉积物环境质量状况,其所代表的生态相关性是沉积物环境质量评价的重要依据[11]。原因包括:第一,多数种类的底栖生物成体终身栖息在固定场所或只能在有限的范围内活动,与沉积物关系密切[12];第二,底栖生物生活在致污物浓度较高的沉积底质附近,受污染影响较大,对其响应较敏感[13];第三,致污物是引发底栖生物物种组成和群落结构变化的重要原因[14—15]。由于水体重金属最终沉降到沉积物中,底栖生物较易受到这些化学物质的持久性影响,因此,研究底栖生物群落的结构特征及其变化情况,可以指示生态系统健康状况,并为沉积物环境质量综合评价提供关键信息。
黄河口是我国第二大河口,以入海输沙量大而闻名于世。近十多年来,由于黄河上游调水调沙工程的实施,短期内引发入海径流和输沙量等物理环境的大幅波动[16]。近30年的研究显示,黄河口及其邻近海域大型底栖生物群落结构发生了一系列改变,其中以多毛类、甲壳类的比例增加,而双壳类动物比例减小的变化趋势最为明显[17—18]。近年的研究表明,该海域已出现显著的富营养化征兆[19]。以上研究均在一定程度上说明黄河口生态系统所受的环境压力增加、生态系统健康状况呈现恶化趋势。尽管这方面的研究时有报道,然而有关该海域生态系统退化与环境因子的耦合关系的研究还较少,以底栖生物群落结构为基础的沉积物环境质量综合评价等方面的研究则更少。就目前而言,尽管河口沉积物质量评价报道较多,但系统有效的评价体系尚未确立[20—21]。鉴于此,本文根据2010年7—8月黄河口生态调查结果,通过整合可获得的资料,分析底栖生物的群落组成与结构特征,评估底栖生物群落结构稳定性,诠释探明底栖生物群落与多种环境因子的耦合关系,以推进近海海域沉积物环境综合质量评价体系的完善和确立。
2 材料与方法
2.1 大型底栖无脊椎动物采集
于2010年7—8月在黄河口采集了14个站位的底栖生物样品,站位设置如图1所示。调查范围位于37.3°~38.1°N,119.0°~119.5°E。采用0.05m2的箱式采样器,以成功采集3次的样品合并为该站位的样品,样品厚度为10~15 cm。样品采集后,使用0.5 mm孔径网筛分选样品,采用70%的乙醇溶液现场进行固定。底栖生物的采集、固定等操作均根据《海洋调查规范》(GB 12763.6-2007)中海洋生物调查的有关规定进行。

图1 底栖生物采集站位
2.2 数据处理与分析方法
2.2.1 底栖生物群落组成与结构
通过计算物种优势度指数(Y)、Margalef物种丰富度指数(d)、Shannon—Wiener多样性指数(H′)等单变量统计量比较不同群落的结构差别[22]。Y用于指示某物种在种群中的优势地位,当Y>0.02时,即认为该种为优势种[23],根据优势度理论,优势度相对不明显的底栖生物,其群落结构相对稳定,即优势度指数越小,表明群落内物种数量分布越均匀,优势种的地位相对不突出。d即物种的数目,是最简单的物种多样性测度方法,H′则综合了丰富性和均匀性两方面的信息。试验数据采用Excel 2003进行处理,计算方法如下:

式中,ni为第i种的总个体数,fi为该物种在所有站位上出现的频率(%),Pi为该站位上第i种的个体数占总个体数的比率;N为所有站位上采集的总个体数,S为某站样品中的物种数。
底栖生物群落结构采用多变量统计分析方法,通过Bray—Curtis相似性矩阵对群落结构进行非参数多维排序(non—metric multidimensional scaling,n MDS)和等级聚类分析。分析使用Primer5.0软件,步骤如下[24]:(1)将丰度数据进行4次方根转换,以站位的Bray—Curtis相似性分数为基础构建相似性距阵;(2)采用类平均法进行等级聚类分析,采用Bray—Curtis相似性进行n MDS和聚类分析,其中n MDS的胁迫系数用来表示在数据降维过程的失真水平,该值越小,则标序图中的空间关系更能准确表征数据信息;(3)使用相似性百分比分析(SIMPER)研究群落的特征物种和引起群落间差异的特征物种。
底栖生物群落稳定性采用丰度/生物量曲线(ABC曲线)进行分析,以丰度和生物量原始数据为基础,通过Primer5.0软件作图,在同一坐标系中比较生物量优势度曲线和数量优势度曲线,确定底栖动物群落受到污染和扰动情况[25—28]。底栖生物群落结构与主要环境因子的耦合关系分析采用SPSS软件中的Pearson相关性(双尾)程序进行检验。其中,配对沉积物中重金属等环境因子数据参见吴斌等[29]的报道,重金属的平均熵值(mean Effect Range Median Quotients,mERMQ)[30—31]系根据该文的数据计算得到,用以表征沉积物的总体毒性水平。分析前,对各项参数进行非参数Shapiro—Wilk正态分布检验,对于不符合正态分布的参数进行数据转换(如Ln),取显著水平α=0.05。
2.2.2 沉积物环境质量综合评价
沉积物质量综合评价以沉积物质量三元法[32]为基础,评估和预测环境胁迫的生态效应[33]。由于要求的数据类型较多,而且数据解译过程复杂,在我国近海评价实践中应用较少。本研究以重金属为评价对象,结合生物预测毒性效应(mERMQ),以底栖生物群落结构的稳定性与否作为沉积物环境质量好坏的评判标准,是沉积物环境质量评价的最终依据[34]。基于重金属的独特地球化学特征,采用区域背景值-预测毒性-底栖生物群落结构参数的新“三元”构成,分别对应重金属含量是否超过清洁水平、该含量水平是否可能引发生物有害效应以及底栖生物群落结构是否稳定等3个问题,通过整合这些信息,初步开展黄河口沉积物环境质量进行综合评价。
3 结果与讨论
3.1 底栖生物群落组成与结构
3.1.1 底栖生物种类组成与分布
本次调查在黄河口海域的14个站位上共采集到底栖生物46科56属67种,其中环节动物门多毛纲18科25属31种,占所有底栖动物种类的46.3%;甲壳动物亚门15科15属19种(占28.4%);软体动物10科13属14种(占21.0%);棘皮动物2科2属2种(占2.9%);腔肠动物1科1属1种(占1.4%)。整个调查区内出现频率大于20%的大型底栖无脊椎动物共26种(表1),包括多毛类14种、甲壳动物4种以及软体动物8种。多毛类中以寡节甘吻沙蚕Glycinde gurjanovae的出现频率最高,甲壳类以钩虾1种Gammarus sp.出现频率最高,软体动物则以小刀蛏Cultellus attenuatus和棉花薄泡螺Philine argentata的出现频率最高。

表1 黄河口海域主要大型底栖无脊椎动物的出现频率(fi)
调查区内底栖生物的优势度不明显,优势度大于2%的物种仅5种(表2),其中软体动物紫壳阿文蛤的优势度指数最高。优势地位相对占优的物种还有多毛类中的西方似蛰虫、中蚓虫、稚齿虫、寡节甘吻沙蚕。在调查海域,由于河口沉积物生态环境的复杂多变,底栖生物的分布具有显著的空间异质性。紫壳阿文蛤仅分布于渤海湾中的A1,靠近河口的A4和A5等3个站位,其中A4和A5站各出现50和75个个体。西方似蛰虫分布于渤海湾中的A1和A2,靠近河口的A4和A6,莱州湾西南部的A8和A10等6个站位,其中在A2和A6站各出现31和39个个体。稚齿虫分布于靠近河口的A4和A6站,莱州湾西南部的A8、A9和A10,以及A11和A12等7个站位,其中以A10站出现的个体最多(13个)。中蚓虫分布于渤海湾中的A1和A2,靠近河口的A4、A6、和A8以及远离河口的A10、A11和A12等8个站位,其中以A1站出现的个体最多(11个)。寡节甘吻沙蚕分布于渤海湾的A1和A2、靠近河口的A4、A5、A6,A7和A8,以及远离河口的A10、A13等9个站位,其中仅A8站出现个体的个体最多(11个)。总体而言,优势种集中在靠近河口的A4、A5和A6等局部站位,进而导致整个调查海域的优势度偏低,但这也体现了河口复杂多变的环境特征。根据优势度理论,河口附近站位的底栖生物群落结构不稳定。
研究区域内,平均每个站位的底栖生物为14.07种,比辽东湾北部(2007年)的7.14种高出一倍[35],但低于胶州湾(1998—1999年)的每个站位的20.02种[36]。图2为14个站位上底栖生物的物种数及对应的物种出现频率,图中显示,不同站位的底栖生物种数存在较大差异。其中,物种数最少的站位为A3站,仅发现3种;该站位于黄河口北侧,渤海湾外,水深12.5m,沉积物类型泥质粉砂,受油田开采等人为活动的影响较大。物种数最多的站位为A1站,发现25种;该站位位于渤海湾中部,水深14.5m,沉积物类型粉砂质泥。受栖息地环境差异(如粒度、氧化还原环境)的影响,沉积物中的致污物的生物有效性[37]和底栖生物的分布存在显著不同[38]。
总体而言,黄河口海域底栖生物物种丰富度相对较低,具有显著的空间异质性。物种丰富度的高值区集中在距黄河口较远的海域,而低值区主要集中在靠近河口的站位。原因可能与黄河口复杂多变的环境密切相关:黄河口径流量、输沙量月季变化很大,伴随着冲淡水的入侵,底栖生物难以适应环境的剧烈变动;此外,黄河三角洲油田开采活动的干扰和入海污染物的输入,也对底栖生物的生存造成一定的影响。

表2 黄河口海域主要大型底栖无脊椎动物的优势度指数(Y)
3.1.2 栖息密度与生物量
研究区域内底栖生物的总栖息密度为33~1 313个/m2,平均值为396个/m2;总生物量为0.11~21.71 g/m2,平均值为6.00 g/m2。其中多毛类的平均栖息密度为166个/m2,平均生物量为1.10 g/m2;软体动物的平均栖息密度为164个/m2,平均生物量为3.03 g/m2;甲壳动物的平均栖息密度为59个/m2,平均生物量为0.97 g/m2;棘皮动物的平均栖息密度为7个/m2,平均生物量为0.18 g/m2;腔肠动物的平均栖息密度为1个/m2,平均生物量为0.53 g/m2。由图3可知,研究区内多毛类的平均栖息密度最大,软体动物次之,而腔肠动物最小;但从生物量上来看,软体动物平均生物量最高,棘皮动物最小。尽管棘皮动物个体较大,但由于仅在14%的站位零星出现,因此平均生物量较低;多毛类尽管个体相对较小,但在所有站位均有出现,其栖息密度和生物量相对较高。

图2 黄河口各站位大型底栖动物种类数及出现频率

图3 底栖动物主要类群栖息密度和生物量组成
从空间分布的角度看(见图4),高栖息密度区出现在黄河口附近的A4—A7站位,并在A5站出现最大值,达到1 313个/m2,该站沉积物为泥质粉砂,水深6.0m,仅软体动物紫壳阿文蛤的单种栖息密度就高达1 167个/m2。低栖息密度区出现在河口附近的A3站以及离河口较远的A11、A13和A14等站,栖息密度均低于250个/m2,其中A3最低,仅为33个/m2,包括软体动物棉花薄泡螺3个、脆壳理蛤1个和多毛类多丝独毛虫1个。上述4个低栖息密度的站位,除A11站水深仅为8.0m外,其他均在12.0m以上。从生物量的空间分布来看,除了渤海湾中部的A1站、黄河口南侧,莱州湾外的A7站外,其他站位的生物量普遍偏低。其中,A7站的生物量最高,为21.71 g/m2,仅小刀蛏的单种生物量就高达14.53 g/m2;A1站的生物量仅次于A7,为14.46 g/m2,而扁玉螺单种生物量就达11.2 g/m2。生物量最低的为 A3站,仅为0.11 g/m2。
综上所述,以A7为中心的河口区域和渤海湾中部的A1为底栖生物聚集区。在该聚集区内,底栖生物的物种丰富度较高,部分物种的生物量很高(主要是软体动物),这可能与河流带来大量营养物质有关[39]。黄河口北侧的A3站,河口外延A4以及渤海湾东南A11等站均为栖息密度和生物量区同步低值区,这可能与黄河的影响有关,较高的沉积速率和低盐特性妨碍了底栖生物的生存与生长[40]。

图4 底栖动物栖息密度和生物量的空间分布
3.1.3 生物多样性指数
生物多样性是衡量生态系统环境状态的最重要的评价参数,黄河口海域底栖生物的Margalef物种丰富度指数(d)为1.24~5.33,平均值为3.32;Shannon—Weiner多样性指数(H′)为0.22~4.10,平均值为2.72。从空间分布的角度看(图5),所有站位底栖生物的d和H′变化趋势较吻合,高值区主要分布在渤海中部的A1、A2站;而低值区主要分布于黄河口附近站位。调查区内,位于黄河口外缘浅水区的A5站,其H′最低,为0.86,说明该站位上的底栖生物群落处于较脆弱的状态;H′最大值出现在渤海中部的A1站位,说明底栖生物群落结构相对稳定;A11站的H′是仅次于A5站的第二低值站位,同时也是仅次于A3、A5站的d的第三低值区。A11站处于小清河口附近,可能受到小清河及莱州湾南岸排污的影响。调查显示莱州湾南岸分布了多个对海域环境影响严重的排污口[41],已有研究也显示小清河口海域已处于富营养化状态[42],这进一步印证了在富营养化的河口,底栖生物多样性较低。其他站位的d和H′变化较平稳,其中黄河口南侧、莱州湾西部的A7—A10站位和黄河口海域最东侧的A12—A14站位为相对高值区。
综上,底栖生物多样性具有随离河口距离增加而增加的趋势。近河口海域,由于河口物理、化学环境的剧烈变化,以及可能的人为干扰(黄河调水调沙、排污等)的影响,其底栖生物群落处于较脆弱状态。而渤海湾中部、莱州湾西部以及正对黄河口的东部海域,由于受河口的影响减弱,人为干扰相对降低,其底栖生态系统较为稳定,物种丰富度和生物多样性较高。

图5 各站位底栖动物丰富度指数和多样性指数的空间分布
3.1.4 群落结构
n MDS分析表明,研究区内各站位底栖生物群落结构相似性较低。以20%的相似度划分,可将所有站位划分为6个底栖生物站组(图6a)。其中A3、A5、A7、A11、A14站独自成组,而剩余站位为一组(图6b),这表明研究海域底栖生物群落结构空间异质性较高。n MDS的胁迫系数为0.13,说明标序图的表征能力在可接受范围。对剩余站组按更高的相似度(28%)划分,可分为3个组(图6b),分别是I′:A9、A10、A12;I″:A1、A2、A13;I‴:A4、A8、A6。该分组的单因素ANOSIM检验结果为R=0.86;p<0.05,说明剩余站组群落结构具有显著的差异,分组具有合理性。SIMPER分析表明:(1)站组I′的组内平均群落相似性为30.14%,其特征种为稚齿虫,贡献率为47.20%;站组I″的组内平均群落相似性为36.21%,其特征种为中蚓虫、扁玉螺、脆壳理蛤和棉花薄泡螺,累积贡献率达63.10%;站组I‴的组内平均群落相似性为16.59%,其特征种为寡节甘吻沙蚕、钩虾一种、西方似蛰虫和稚齿虫累积贡献率达62.74%。(2)站组I′和I″的平均非相似性为80.60%,其中以稚齿虫的贡献最大,贡献比例为11.81%;站组I′和I‴的平均非相似性为84.30%,尤以紫壳阿文蛤和西方似蛰虫的贡献为主,累积贡献为27.93%;I″和I‴的平均非相似度为86.12%,它同样以紫壳阿文蛤和西方似蛰虫的贡献为主,累积贡献为26.83%。
由此可见,黄河口海域底栖生物群落结构的差异主要是由多毛类和甲壳动物引起的。站组I‴与站组I′、I″的群落结构差异主要体现在紫壳阿文蛤和西方似蛰虫的组成上。站组I‴的所有站位均位于河口附近,受环境胁迫的影响相对较大,多毛类的比例较其他站组高。

图6 黄河口海域底栖生物等级聚类与非参数多维排序分析
3.1.5 群落结构稳定性
对上述底栖生物群落亚组I′、I″、I‴的底栖生物(物种数均大于10)进行ABC曲线(见图7a)分析,结果显示生物量曲线皆位于丰度曲线之上,且生物量和丰度的累积优势度适中,这表明,研究海域的3个亚区底栖生物未受干扰,群落结构稳定。对比3个亚组的生物量曲线起点,I′组最低、I‴组最高,I″与I′组相近却显著低于I‴组,这显示I′、I″两组较I‴较具有更稳定的群落结构。站组I‴的群落结构稳定性相对较低,这可能与优势度和多样性分析结果中的原因类似,均与河口的影响有关。A5、A7站位于河口附近,物种数分别是12和18种,对其进行ABC曲线分析(见图7b),A5站的生物量曲线大部分位于丰度曲线下,并出现交叉和翻滚,显示底栖生物群落结构受到中等以上干扰影响,处于不稳定的状态;而A7站则生物量曲线在丰度曲线上,表明其生物群落结构处于未受干扰的稳定状态。
调查中,A3、A11、A14这3个站位上物种数均低于10种,分别是3、6、9种。结合前述分析,A3站位于近河口位置,A11站位于污染严重的小清河口与莱州湾近海养殖污染排放入海交汇处,A14站尽管位于离河口较远的位置,但受到莱州湾北部海上石油开采活动的影响[41],显示此3站位的底栖生物皆受到干扰的影响,底栖生物群落结构不稳定。

图7 黄河口海域底栖生物丰度生物量复合k—优势度曲线
3.1.6 底栖生物群落结构与环境因子的耦合关系
Pearson相关性分析结果显示,底栖生物群落组成与重金属、硫化物和石油类之间皆无显著相关关系(表3)。然而,统计分析也显示,生物量与mERMQ具有较高的正相关关系(r=0.506),在一定程度上说明以软体动物为代表的底栖生物倾向于向重金属含量较高的站位聚集。这与生物量高值区出现在以A7为中心的河口区域和渤海湾中部的A1站,而河口外延以及渤海湾东南等站位皆为生物量低值区的调查结果相吻合,也与Ryu等[43]报道的结果相似。水深与多个底栖生物参数也具有正相关性(r=0.304~0.404),在一定程度上说明水深是影响底栖生物群落结构的因子之一。当然,由于采样站位有限,上述相关性讨论可能存在一定的局限性。

表3 黄河口海域底栖生物群落结构与主要环境参数的关系(r)
3.2 沉积物环境质量综合评价
黄河口沉积物中重金属的化学调查结果显示[29],14个沉积物样品中Cu、Pb、Zn、Cr、Hg、As等6种重金属的含量与渤海沉积物平均含量(背景值)相比,仅Cu、Pb和Hg这3种重金属存在超出背景值的情况。其中A6站的Cu,A5、A6站的Pb和 A6、A8、A10、A12、A14站的Hg仅轻微超出对应背景值,而A4、A5、A11站的Hg则超过背景值两倍以上。毒性预测水平(mERMQ)的计算结果显示,14个沉积物样品的值均小于0.1,表明黄河口海域沉积物由重金属引发毒性的可能性较低(发生率低于9%);黄河口底栖生物群落结构分析表明,受多种胁迫因子影响,A3、A5、A11、A14站位上的底栖生物群落结构受到扰动的严重影响,群落结构不稳定;ABC曲线分析显示其他站位的底栖生物群落较为稳定,但靠近河口的站组I‴(A4、A6和A8)较其他两个亚组的稳定性低,假定该组底栖生物群落受到中等扰动的影响。其它站位未受干扰影响,群落结构稳定。
针对上述3个评价指标,定义3个响应程度水平:沉积物化学中,●表示1种以上的重金属含量超过两倍的背景值;◎表示一种以上的重金属含量超过背景值,但均未超过1倍背景值;○表示所有金属的含量均低于背景值。预测毒性中,●表示毒性发生率很高(>75%);◎表示毒性发生率处于中等水平(25%~75%);○毒性发生率很低(<25%)。底栖生物群落结构中,●表示受到严重干扰,群落结构不稳定;◎表示受到中等干扰,群落结构具有不稳定的倾向;○表示未受干扰,群落结构稳定。据此在决策矩阵表中标示各站位中的相应响应程度,如表4所示。评价结果显示A3、A5、A11、A14等站位的沉积物受到严重影响,环境质量处于较差水平,其中A5、A11和A14站的沉积物质量下降很有可能是由重金属Hg引起的,而A3站的沉积物质量下降可能是除测定的重金属以外的其他因素造成的。A4、A6和A8站的沉积物质量处于中等水平,Hg依然是最可能的潜在原因。其他7个站的沉积物环境质量处于良好水平。尽管A10和A12站中重金属Hg超过了背景值,但并未引起生物有害效应和底栖生物群落结构的变化。所有站位的沉积物均未出现显著的毒性效应,这可能与所测定的重金属含量水平总体处于较低水平有关。从站位的空间分布看,沉积物环境质量较差的站位位于河口附近、小清河口及莱州湾北部;沉积物环境质量处于中等水平的站位位于河口附近;沉积物环境质量较好的站位位于渤海湾中部、渤海中部以及莱州湾西部。
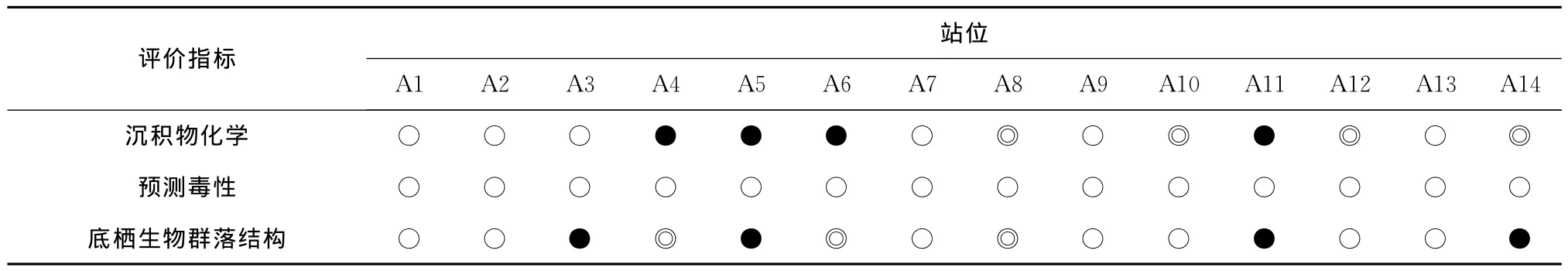
表4 黄河口沉积物综合评价结果
4 结论
黄河口底栖生物群落呈现复杂的群落结构特征,具有显著的空间异质性。通过研究底栖生物群落组成与结构,分析其结构特征与环境因子的耦合关系,获得如下几点主要认识:(1)调查海域底栖生物优势度不明显。优势种集中在靠近河口的局部海域,其底栖生物群落结构不稳定。(2)底栖生物多样性随离河口距离增加而增加。黄河口海域的底栖生物物种丰富度指数和生物多样性指数的高值区主要集中在在远离黄河口,靠近渤海中部的海域,低值区集中在河口附近站位。(3)受河流输入和近岸人为活动的影响,ABC曲线分析显示群落结构不稳定的站位主要位于河口附近和莱州湾中西部的站位。(4)底栖生物群落结构与环境因子的耦合关系分析表明,生物量较大的底栖生物在一定程度上倾向于向重金属含量较高的站位聚集。(5)沉积物环境质量综合评价研究表明,远离黄河口的沉积物环境质量普遍较好,而河口附近的沉积物环境质量较差,显示黄河径流输入和人为活动的影响。
本研究采用综合评价方法,试探性地评估了黄河口海域的沉积物环境质量,研究中不可避免地存在一些不足,建议在今后的研究中,适当地增加采样站位和分析的参数,开展生物毒性和生物富集测试,以更好地探讨河口底栖生物群落结构特征及其与环境的耦合作用。
[1]Wildsmithm,Rose T,Potter I,et al.Benthic macroinvertebrates as indicators of environmental deterioration in a large microtidal estuary[J].Marine Pollution Bulletin,2011,62(3):525—538.
[2]刘录三,郑丙辉,李宝泉,等.长江口大型底栖动物群落的演变过程及原因探讨[J].海洋学报,2012,34(3):134—145.
[3]Thompson B,Lowe S.Assessment of macrobenthos response to sediment contamination in the San Francisco Estuary,California,USA[J].Environmental Toxicology and Chemistry,2009,23(9):2178—2187.
[4]Leonard D,Robert C K,Somerfield P J,et al.The application of an indicator based on taxonomic distinctness for UK marine biodiversity assessments[J].Journal of Environmental Management,2006,78(1):52—62.
[5]Ryu J,Khim J S,Kang S G,et al.The impact of heavy metal pollution gradients in sediments on benthic macrofauna at population and communitylevels J.Environmental Pollution 2011 159 10 2622 2629.
[6]Wildsmithm,Rose T,Potter I,et al.Changes in the benthic macroinvertebrate fauna of a large microtidal estuary following extreme modifications aimed at reducing eutrophication[J].Marine Pollution Bulletin,2009,58(9):1250—1262.
[7]Giangrande A,Liccianom,Musco L.Polychaetes as environmental indicators revisited[J].Marine Pollution Bulletin,2005,50(11):1153—1162.
[8]O'brien A L,Keoughm J.Detecting benthic community responses to pollution in estuaries:A field mesocosm approach[J].Environmental Pollution,2013,175:45—55.
[9]Hutchings P.Biodiversity and functioning of polychaetes in benthic sediments[J].Biodiversity and Conservation,1998,7:1133—1145.
[10]Kemp W,Boynton W,Adolf J,et al.Eutrophication of Chesapeake Bay:historical trends and ecological interactions[J].Marine Ecology Progress Series,2005,303(21):1—29.
[11]Chapman Pm.Do not disregard the benthos in sediment quality assessments![J].Marine Pollution Bulletin,2007,54(6):633—635.
[12]Kiffney Pm,Clements W H.Ecological effects of metals on benthic invertebrates[M]//Simon T P.Biological Response Signatures:Indicator Patterns Using Aquatic Communities.CRC,2003.
[13]Rosenberg Dm,Resh V H.Freshwater biomonitoring and benthic macroinvertebrates[M].Chapman & Hall,1993.
[14]Clements W H,Carlisle Dm,Lazorchak Jm,et al.Heavy metals structure benthic communities in Colorado mountain streams[J].Ecological Applications,2000,10(2):626—638.
[15]Goto D,Wallace W G.Relative importance of multiple environmental variables in structuring benthic macroinfaunal assemblages in chronically metal—polluted salt marshes[J].Marine Pollution Bulletin,2010,60(3):363—375.
[16]Cui B L,Li X Y.Coastline change of the Yellow River estuary and its response to the sediment and runoff(1976—2005)[J].Geomorphology,2010,127(1/2):32—40.
[17]周红,华尔,张志南.秋季莱州湾及邻近海域大型底栖动物群落结构的研[J].中国海洋大学学报(自然科学版),2010,40(8):80—87.
[18]Zhou H,Zhang Z,Liu X,et al.Decadal change in sublittoral macrofaunal biodiversity in the Bohai Sea,China[J].Marine Pollution Bulletin,2012,64(11):2364—2373.
[19]孙丕喜,王波,张朝晖,等.莱州湾海水中营养盐分布与富营养化的关系[J].海洋科学进展,2006,24(3):329—335.
[20]Chapman Pm,Wang F Y.Assessing sediment contamination in estuaries[J].Environmental Toxicology and Chemistry,2001,20(1):3—22.
[21]Telesh I V,Khlebovich V V.Principal processes within the estuarine salinity gradient:A review[J].Marine Pollution Bulletin,2010,61(4-6):149—155.
[22]李新正.中国海洋大型底栖生物-研究与实践[M].北京:海洋出版社,2010:53—54.
[23]陈亚瞿,胡方西.长江口河口锋区浮游动物生态研究I生物量及优势种的平面分布[J].中国水产科学,1995,2(1):49—58.
[24]周红,张志南.大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用[J].青岛海洋大学学报 (自然科学版),2003,33(1):58—64.
[25]Warwick R.A new method for detecting pollution effects on marine macrobenthic communities[J].Marine Biology,1986,92(4):557—562.[26]Clarke K,Warwick R.Changes in marine communities:an approach to statistical analysis and interpretation[R].2nd ed.Plymouth:PRIMER-E,2001.
[27]李宝泉,李新正,王洪法,等.长江口附近海域大型底栖动物群落特征[J].动物学报,2007,53(1):76—82.
[28]李圣法.以数量生物量比较曲线评价东海鱼类群落的状况[J].中国水产科学,2008,15(1):136—144.
[29]吴斌,宋金明,李学刚.黄河口表层沉积物中重金属的环境地球化学特征[J].环境科学,2013,34(4):1324—1332.
[30]Long E R,Macdonald C.Calculation and uses of mean sediment quality guideline quotients:A critical review[J].Environmental Science &Technology,2006,40(6):1726—1736.
[31]Gao X L,Chen C T A.Heavy metal pollution status in surface sediments of the coastal Bohai Bay[J].Water Research,2012,46(6):1901—1911.
[32]Chapman Pm,Anderson J.A decision—making framework for sediment contamination[J].Integrated Environmental Assessment and Management,2005,1(3):163—173.
[33]Damásio J,Fernández—Sanjuanm,Sánchez—Avila J,et al.Multi—biochemical responses of benthic macroinvertebrate species as a complementary tool to diagnose the cause of community impairment in polluted rivers[J].Water Research,2011,45(12):3599—3613.
[34]Mcpherson C,Chapman Pm,Debruyn Am H,et al.The importance of benthos in weight of evidence sediment assessments-A case study[J].Science of the Total Environment,2008,394(2/3):252—264.
[35]刘录三,郑丙辉,李宝泉,等.长江口大型底栖动物群落的演变过程及原因探讨[J].海洋学报,2012,34(3):134—145.
[36]李新正,于海燕,王永强,等.胶州湾大型底栖动物数量动态的研究[J].海洋科学集刊,2002,44:66—73.
[37]Clements W H,Hickey C W,Kidd K A.How do aquatic communities respond to contaminants?It depends on the ecological context[J].Environmental Toxicology and Chemistry,2012,31(9):1932—1940.
[38]Burton A G,Johnston E L.Assessing contaminated sediments in the context of multiple stressors[J].Environmental Toxicology and Chemistry,2010,29(12):2625—2643.
39 张莹,吕振波,徐宗法,等.环境污染对小清河口大型底栖动物多样性的影响[J.生态学杂志,2012 31 2 381 387.
[40]中国海湾志编纂委员会.中国海湾志,第十四分册:重要河口[M].北京:海洋出版社,1998:75.
[41]国家海洋局北海分局.2011北海区海洋环境公报[EB/OL].http://www.ncsb.gov.cn/gggb/ncsb/2012062901.htm
[42]马绍赛,辛福言,崔毅,等.黄河和小清河主要污染物入海量的估算[J].海洋水产研究,2004,25(5):47—51.
[43]Ryu J,Khim J S,Kang S G,et al.The impact of heavy metal pollution gradients in sediments on benthic macrofauna at population and community levels[J].Environmental Pollution,2011,159(10):2622—2629.
Abstract:Benthic macroinvertebrate assemblages in 14 sediment stations from Huanghe estuary were investigated to explore the characteristics of benthic community structure and its relationships to potential explanatory factors.Results showed there was a substantial spatial heterogeneity in species composition and community structure.Low degree of dominance was found in the surveyed area and dominance species was found aggregating in the stations near the river mouth.We also found a trend of increasing species diversity with increasing distance from the river mouth in Huanghe estuary.High values of richness and diversity index usually appeared in stations from Bohai Bay and central areas of Bohai Sea,but low values occurred near the river mouth.Reduction of benthic data by nonmetric multidimensional scaling(n MDS)and hierarchical cluster suggested low similarity among stations.Ecosystem health assessment examined by combined abundant biomass k—dominance curve(ABC)indicated the overall status of benthic community in the area investigated remained stable.The stations with unstable benthic community mainly situated adjacent to the river mouth and located in the central and west Laizhou Bay.In addition,the presence of larger size species with increasing proximity to stations with higher metal contamination level was inferred from Pearson correlation analysis between benthic data and coupling factors.A holistic assessment of sediment quality by incorporating sediment chemistry,predicted toxicity and benthic community structure indicated that impacted sediment(degraded)was distributed near the river mouth,while unimpacted sediment located far from the river mouth.
Key words:macrozoobenthos;n MDS;coupling relationships;heavy metals;Huanghe estuary
Characteristics of benthic macroinvertebrate community structure and its coupling relationships with environment factors in Huanghe estuary
Wu Bin1,2,Song Jinming1,Li Xuegang1
(1.Key Laboratory of Marine Ecology and Environmental Sciences,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
X822
A
0253—4193(2014)04—0062—11
吴斌,宋金明,李学刚.黄河口大型底栖动物群落结构特征及其与环境因子的耦合分析[J].海洋学报,2014,36(4):62—72,
10.3969/j.issn.0253—4193.2014.04.005
Wu Bin,Song Jinming,Li Xuegang.Characteristics of benthic macroinvertebrate community structure and its coupling relationships with environment factors in Huanghe estuary[J].Acta Oceanologica Sinica(in Chinese),2014,36(4):62—72,doi:10.3969/j.issn.0253—4193.2014.04.005
2013—03—19;
2013—11—26。
国家自然科学基金项目(41376092);国家海洋局环境评价项目(DOMEP(MEA)-01-01);国家基金委“创新研究群体科学基金”(41121064)。
吴斌(1987—),男,江西省萍乡市人,博士研究生,主要研究方向为环境海洋学。E—mail:arthurwuio@hotmail.com
*通信作者:宋金明(1964—),男,河北省枣强县人,研究员,博士生导师,从事海洋生物地球化学和环境海洋学研究。E—mail:jmsong@ms.qdio.ac.cn
