丁香苦苷单体与丁香苦苷PLGA纳米粒药动学比较
2014-09-14吕邵娃李永吉杨志欣赵义军
李 爽,吕邵娃,李永吉,杨志欣,赵义军
(黑龙江中医药大学 药学院,哈尔滨 150040)
丁香苦苷(Syringopicroside,SYR)是丁香叶的主要有效成分[1],抗HBV病毒、保肝、利胆作用显著[2-5],但是该成分体内代谢较快,常规给药途径不利于强烈药效的发挥.纳米粒应用载药微粒携带药物,不仅可定向输送药物到病变的靶器官,而且能有效延长药物作用时间.其中PLGA为无刺激、无毒、生物降解度高的高分子载体材料[6].课题组前期已成功制备了丁香苦苷PLGA纳米粒,为类球形实体,平均粒径为120 nm, 具有较高的包封率和载药量.本文对其药动学进行了研究.
1 实验材料
1.1 药品与试剂
SYR-NP(自制:批号20110712);丁香苦苷对照品(自制:经面积归一化法计算质量分数>98%);色谱纯甲醇(Dikmapure,Made in USA),肝素(分析纯,上海惠兴生化试剂有限公司);其他试剂均为分析纯.
1.2 仪器与设备
美国Waters公司高效液相色谱仪系统:2996Photodiode Array Detector, 2695Separations Module, Empow色谱工作站;色谱柱Diamonsil C18250×4.6 μm,5 μm;WH-1微型涡旋混合器(上海沪西分析仪器厂有限公司);TGL-16C型离心机(上海安亭科学仪器厂);微量移液器(大龙合资);MP2000电子天平(上海第二天平仪器厂);氮吹仪(BF-2000).
1.3 实验动物
Wistar大鼠,雌雄兼用,体重(190±10)g,清洁级(SPF级),由黑龙江中医药大学药物安全性评价中心提供,合格证号为SCXK(黑)2008004号.
2 方法与结果
2.1 色谱条件
色谱柱:Diamonsil C18(5 μm,250×4.6 mm);预柱:SHIMADZU 10L×4.6;流动相:甲醇-水(50∶50,V/V);流速:1.0 mL/min;检测波长:221 nm;柱温:30 ℃;进样量:20 μL.
2.2 血浆样品处理
精密吸取100 μL血浆置于1.5 mL离心管中,加入1 mL甲醇作为蛋白沉淀剂,沉淀蛋白,涡旋混合3 min,至混合均匀,离心机10000 r/min离心10 min,吸取上清液于50 ℃氮气吹干,残余物用200 μL甲醇溶解,涡旋混合3 min,使用0.22 μm微孔滤膜过滤至内衬管中,进样20 μL,HPLC分析记录峰面积.
2.3 方法学考察
2.3.1 专属性实验
分别制备空白血浆,空白血浆加对照品及大鼠尾静脉注射给药后血浆样品,进样20 μL,进行HPLC分析,记录色谱图,色谱图见图1.

A-空白血浆色谱图 B-空白血浆+丁香苦苷色谱图 C-大鼠尾静脉注射给药后血浆样品色谱图
结果表明在血浆样品处理过程中未引入干扰性杂质,且血浆中内源性物质不干扰测定.
2.3.2 标准曲线的制备
1)标准溶液的配制
称取丁香苦苷对照品约10 mg,精密称定为10.02 mg,置于10 mL量瓶中,甲醇定容至刻度,得到1.02 mg/mL的标准储备液,分别精密量取标准储备液适量于容量瓶中,加甲醇稀释并定容至刻度,配成丁香苦苷质量浓度为0.01、20.02、40.02、60.02、80.02、100.02 μg/mL的系列标准溶液备用.
2)标准曲线与线性范围
精密吸取丁香苦苷系列标准溶液200 μL,置于1.5 mL离心管中,40 ℃水浴蒸干后,分别精密加入空白血浆100 μL,涡旋混合1 min后,血浆样品处理后进样20 μL,HPLC分析测定,并记录峰面积.以丁香苦苷的质量浓度为横坐标,丁香苦苷的峰面积为纵坐标绘制标准曲线.见图2.
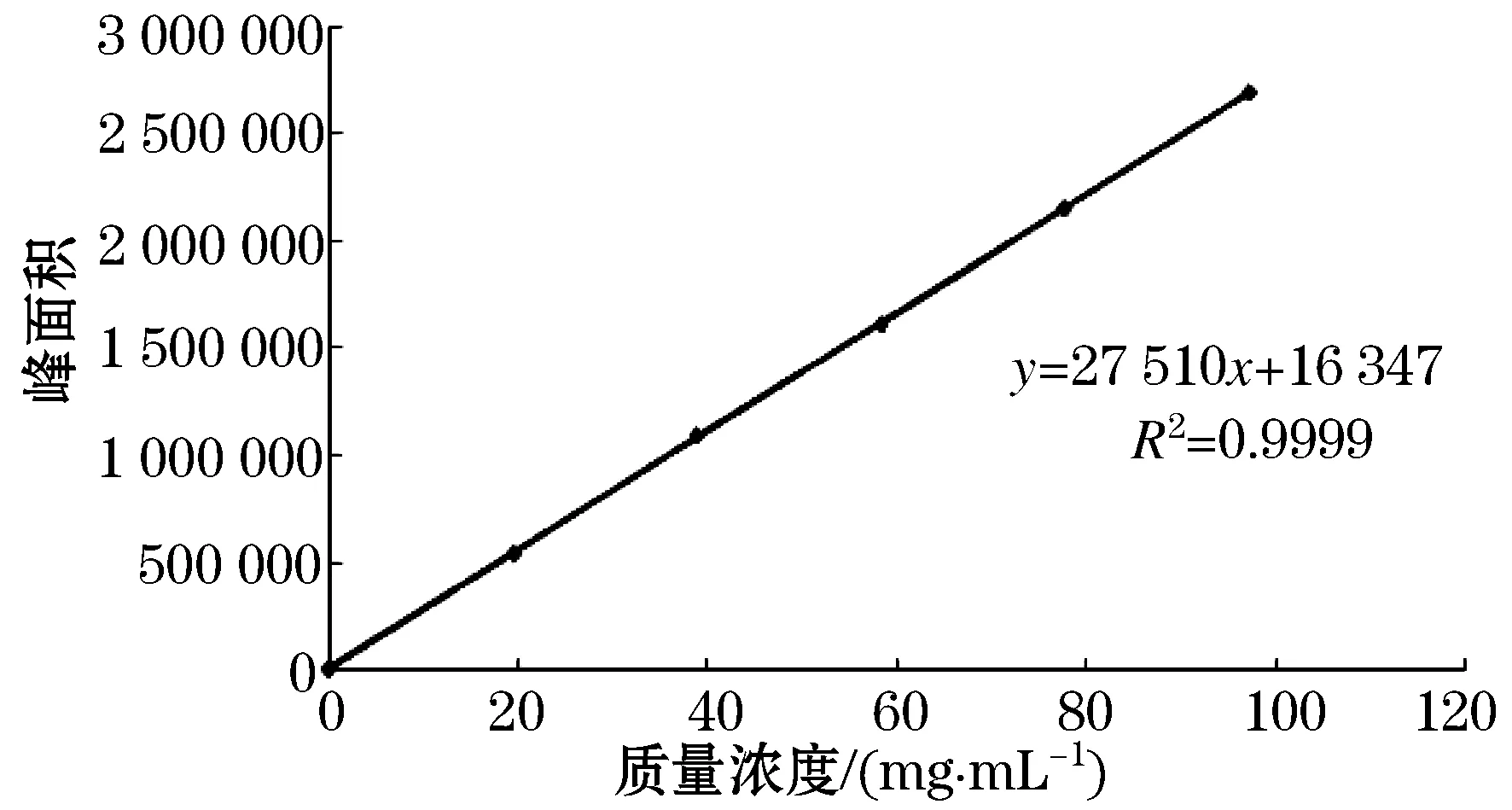
图2 丁香苦苷大鼠血浆标准曲线
经线性回归可知丁香苦苷质量浓度在0.012~100.02 μg/L范围内线性关系良好,回归方程为Y=27 510x+16 347,r2=0.999 99(n=6).
3)精密度实验
配制含丁香苦苷低、中、高三种质量浓度为1.0、20.0、60.0 μg/mL的血浆样品,各质量浓度样品连续进样5针,得日内精密度;各质量浓度样品每日测定1次,连续测定5 d,得日间精密度;记录峰面积,按回归方程计算样品质量浓度,计算日内精密度和日间精密度.结果见表1.
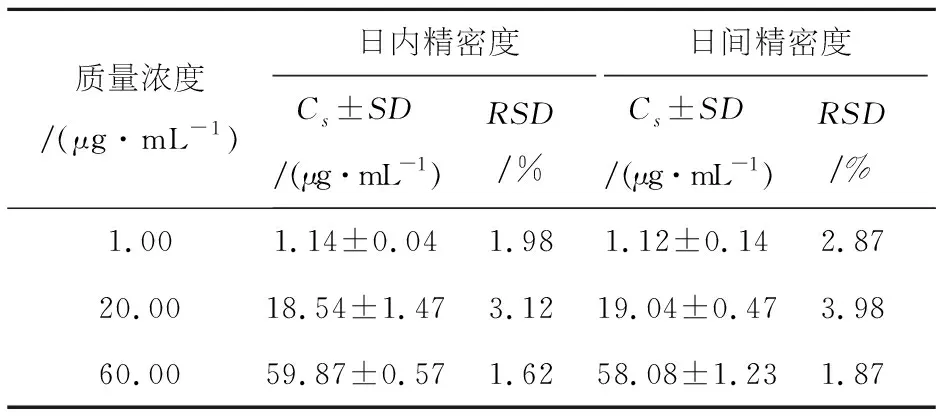
表1 丁香苦苷精密度测定结果
日内精密度和日间精密度的RSD值均小于5%,符合药代动力学研究方法的要求.
4)提取回收率
分别配制含丁香苦苷低、中、高三种质量浓度为1.0、20.0、60.0 μg/mL的血浆样品各5份,进样20 μL,进行HPLC分析,将所得峰面积与未经提取的相同质量浓度的丁香苦苷标准液直接进样所得峰面积相比,即得提取回收率,见表2.

表2 血浆中丁香苦苷的提取回收率
结果表明提取回收率在85%以上,RSD<5%.满足测定要求.
5)方法回收率
配制含丁香苦苷低、中、高三种质量浓度为1.0、20.0、60.0 μg/mL的血浆样品各5份,进样20 μL,进行HPLC分析,将测得的样品峰面积代入丁香苦苷大鼠血浆标准曲线中,计算样品的质量浓度,将测定量与加入量比较,得到样品的方法回收率,结果见表3.
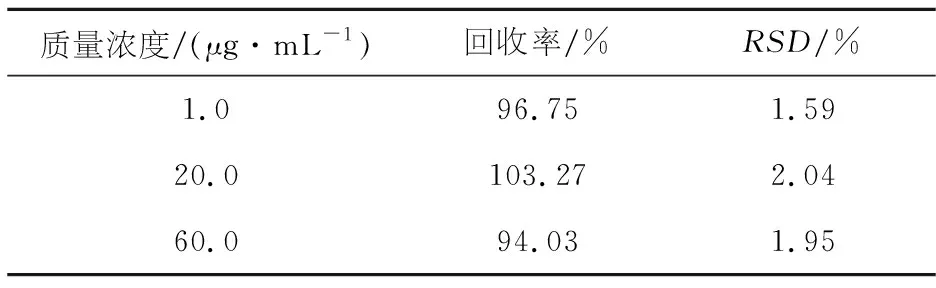
表3 血浆中丁香苦苷的方法回收率
2.4 大鼠体内药动学研究
2.4.1 动物分组
将大鼠随机分为2组,每组12只,雌雄各半,根据文献以及预实验,确定丁香苦苷生理盐水注射液组(10 mg/kg)以及SYR-PLGA-NP组(10 mg/kg,其剂量是依据SYR-PLGA-NP的包封率为(61.1±1.21)%和载药量为(6.01±0.21)%计算得来的).
2.4.2 给药方式
给药前12 h禁食,不禁水,给药方式为尾静脉注射.
2.4.3 取样
分别尾静脉注射后:取丁香苦苷生理盐水溶液组于第5、10、15、20、25、30、40、60、90 min,丁香苦苷-PLGA纳米粒组分别于第5、15、30、60、90、150、210、270、330、390 min自大鼠后眼眶取血约0.5 mL,置于涂有肝素抗凝的塑料离心管中,5 000 r/min离心15 min,分离上层血浆,置于冰箱(-20 ℃)中冷冻,避光保存.
2.5 实验结果
2.5.1 各组大鼠时间-血药质量浓度数据
大鼠尾静脉注射SYR水溶液(对照组)和SYR-PLGA-NP(实验组),分别在大鼠尾静脉注射10 mg/kg丁香苦苷注射液后,在个时间点经大鼠后眼眶静脉丛取血,得血浆后保存于-20 ℃冰箱,并按前述方法检测质量浓度,绘制SYR水溶液组和SYR-PLGA-NP溶液组的平均血药质量浓度-时间曲线,见图3、4.不同时间的血药质量浓度分别见表4、5.(其中血浆蛋白结合率为56.92%[7])

表4 静脉注射10 mg/kg丁香苦苷单体静脉注射后血药质量浓度
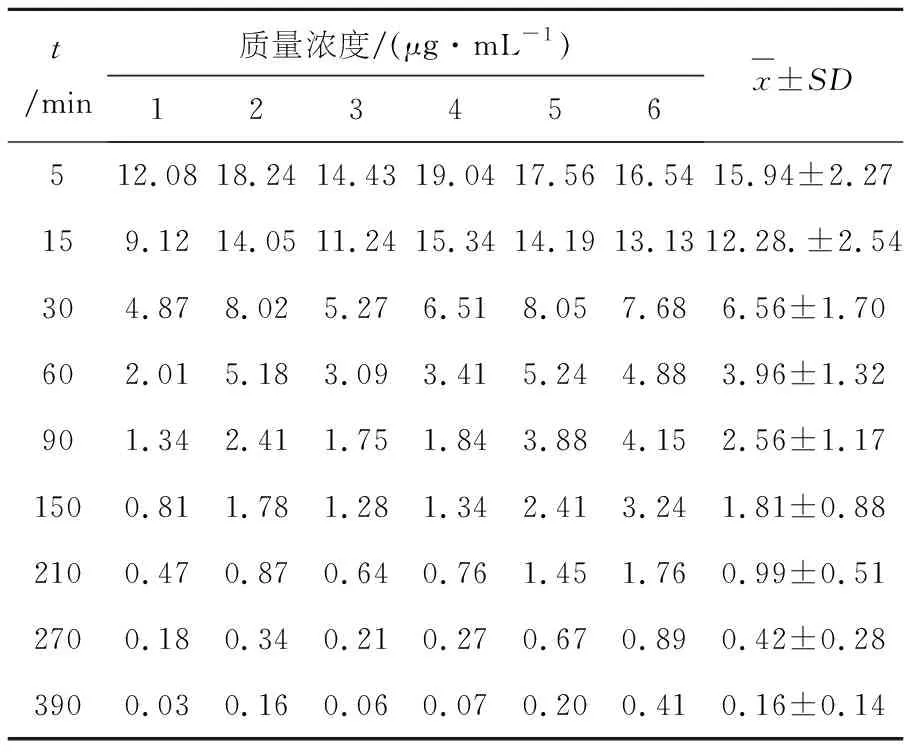
表5 丁香苦苷PLGA纳米粒10mg/kg静脉注射后血药质量浓度

图3 丁香苦苷单体10 mg/kg静脉注射后药时曲线
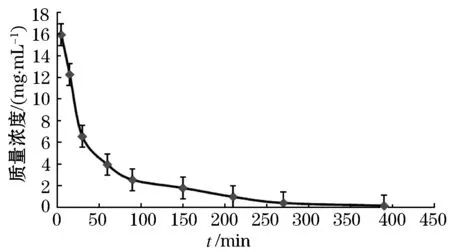
图4 SYR-PLGA-NP 10 mg/kg给药后药时曲线
2.5.2 大鼠体内药动学参数研究
对照组和实验组分别按照预先设定的不同剂量进行尾静脉注射丁香苦苷溶液和SYR-PLGA-NP注射液后,在不同时间点进行眼眶静脉丛采血[8].经甲醇沉淀蛋白后,以所建立HPLC-UV检测方法,测定其血药质量浓度并以3P97软件拟合C-T曲线,按一、二、三室模型拟合,确定模型,计算药物动力学参数,经该程序处理后以理论血药质量浓度值与实验测定血药质量浓度值相关系数最大和AUC最小作为判断标准,所确定的药物动力学行为均符合二室模型(权重系数为1/C/C),并求得了药动学参数,其结果见表6.
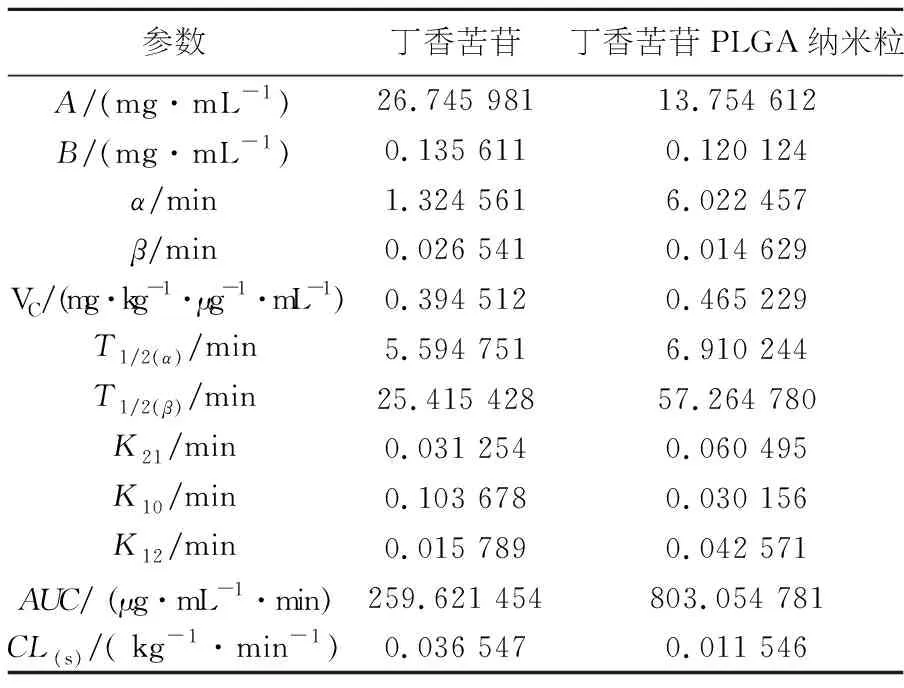
表6 丁香苦苷、丁香苦苷PLGA纳米粒静脉注射后药动学参数
根据上述药动学参数结果显示: SYR-PLGA-NP药动学参数显示,比较了大鼠尾静脉注射SYR-PLGA-NP与丁香苦苷溶液,发现药代动力学参数发生了变化:AUC、Tl/2a和T1/2β显著增加,CL大大降低.
经过数据拟合发现丁香苦苷单体与SYR-PLGA-NP在大鼠体内过程均符合二室模型,药物动力学实验结果表明,给药剂量相同(10 mg/mL)时丁香苦苷溶液的T1/2α为5.59min,T1/2β为25.41 min,AUC为259.621 454 (μg/mL)·min,血浆清除率为0.036 547 kg-1·min-1.而SYR-PLGA-NP的T1/2α和T1/2β为6.91 min和57.26 min,分别是丁香苦苷溶液的1.23倍和2.25倍.AUC值为803.054(μg/mL)·min,是丁香苦苷溶液的3.09倍,血浆清除率为1.15×10-2kg-1·min-1,约为丁香苦苷溶液的1/3.说明采用载药纳米粒给药后,可显著改变药物的一些体内的药动学参数.延长了药物在体内循环系统中的滞留时间,降低了清除率,使丁香苦苷能在体内较长时间维持较高的血药质量浓度,起到一定的缓释作用.
3 讨 论
3.1 血浆样品的预处理
在血样处理方法中,文献报道多采用液-液萃取法,萃取剂的选择关系到实验是否受到干扰,以及数据的准确性,本实验对不同萃取溶剂(乙醚、乙酸乙酯、三氯甲烷、二氯甲烷)进行考察后发现,样品进样后峰较多,干扰丁香苦苷的测定,且萃取回收率不高,影响了实验的准确性.本实验选择用蛋白沉淀法进行样品前处理,分别考察了甲醇、乙醇、乙睛、丙酮等溶剂的蛋白沉淀效果,最终选定5倍量甲醇,由于流动相的选择就是甲醇和水,甲醇作为沉淀剂对液相条件没有影响.沉淀蛋白的同时对药物的提取率也较高,样品处理进样后可获得较好的分离效果.
3.2 药动学研究
本实验采取的是尾静脉给药,研究丁香苦苷在大鼠体内的药动学行为.本研究制得的SYR-PLGA -NP将丁香苦苷包裹进载体内,避免了肝脏对药物的直接代谢,起到缓释作用;维持药物在体内稳态血药质量浓度.经过药动学参数的比较,血浆清除率为丁香苦苷单体溶液的1/3左右.这表明SYR-PLGA -NP能够起到缓释的作用.
参考文献:
[1]刘 磊,李桂英,杨海玲,等.丁香苦苷不同给药途径的药物动力学研究[J].中医药学报, 2010, 38(1): 96-99.
[2]王录娜,李永吉,管庆霞,等. 丁香叶的研究现状及展望[J]. 时珍国医国药,2009,20(4):963-964.
[3]米宝丽. 中药丁香叶的质量及应用研究[D]. 沈阳:辽宁中医药大学,2008.
[4]卢 丹,李平亚. 丁香属植物的化学成分和药理作用研究进展[J].长春中医学院学报,2001,17(4):58-59.
[5]李 全,许琼明,郝丽莉,等. 紫丁香叶化学成分研究[J]. 中草药,2009,40(8):369-371.
[6]AVGOUSTAKIS K. Pegylated-poly (lactide) and poly (lactide-coglycolide) nanoparticles: preparation, properties and possible applications in drug delivery[J]. Curr Drug Deliv, 2004, 1(4): 321-333.
[7]王艳宏,李永吉,王艳芝,等.紫丁香叶中丁香苦苷的Re-HPLC法测定[J].中草药, 2003, 34(3): 79-80.
[8]刘 卢,吕邵娃,张坤弛,等.龙胆苦苷PLGA纳米粒的制备[J].哈尔滨商业大学学报:自然科学版,2013,29(3):280-283.
