不同高危型HPV检测方案对宫颈癌患者的筛查价值比较
2014-09-13高娜娜
高娜娜
宫颈癌是临床上最常见的一种妇科肿瘤,其发病率为逐年上升趋势[1-2]。研究发现宫颈癌的发生与发展是一个渐进的过程, 其演变过程需要几年甚者十几年,如能及时发现早期宫颈癌并进行治疗,可达90%以上的治愈率[3],及早地发现、密切监测宫颈癌发生的高危人群是治疗癌前病预防宫颈癌发生的重要手段[4]。研究发现宫颈癌发生的一个主要原因就是高危型HPV的感染[5-6]。早期发现对于宫颈癌防治具有重要的意义,而有效的筛查方法又是早期发现宫颈癌的关键,目前检测高危型HPV的方法很多, PCR及HC2-HPV-DNA是目前最常用检测高危型HPV的两种方法[7]。本研究以120例健康体检的妇女为研究对象,来比较PCR及HC2-HPV-DNA两种高危型HPV的方法在筛选宫颈癌中的应用价值。
1 资料与方法
1.1 一般资料
选取健康体检的妇女120例,年龄23~60岁,平均年龄(43.6±2.4)岁。采样前应注意以下事项:①采样前3天内不冲洗阴道及不适用阴道内药物;②采样前1天内不能有性行为;③采样前没有进行相关疾病的治疗;④取样时为非月经期。将棉签用生理盐水浸湿后试净宫颈口过多的分泌物,然后暴露宫颈口,用新的湿棉球在宫颈的鳞柱交界处采集宫颈脱落的细胞,并迅速将其放入保存液中,保存待检。
1.2 研究方法
实时荧光定量PC的引物及探针依据高危型HPV的L1基因靶序列来设计,其具体操作按照深圳港龙生物技术有限公司提供的高危型HPV的荧光定量PCR检测试剂盒的说明书进行,并应用荧光定量分析仪ABI 7500来分析结果,其判定标准为:<500拷贝/mL为阴性,≥500拷贝/mL为阳性。宫颈口脱落细胞中高危型HPV-DNA应用美国Digene公司天津分公司提供的HC2-HPV-DNA检测试剂盒来检测,其判定标准为:<1.0 pg/mL为阴性,≥1.0 pg/mL为阳性。
1.3 统计学方法
应用SPSS 19.0统计软件进行整理与分析,然后采用χ2检验及Fisher精确检验来进行计数资料的比较,以P<0.05为其差异有统计学意义。
2 结果
2.1 PCR及HC2-HPV-DNA的检测结果
分别采用PCR及HC2-HPV-DNA两种方法,对120例健康体检的妇女进行高危型HPV感染情况的检测,其检测结果显示PCR检出阳性率为15.83%(19/120),HC2-HPV-DNA检出阳性率为10.83%(13/120),同时检出阳性率为9.17%(11/120),同时检出阴性率为81.67%(98/120),两者比较存在着差异(P<0.05)。
2.2 PCR及HC2-HPV-DNA检测高危型HPV感染情况
按照年龄大小将120例健康女性分为23~30岁、31~41岁、41~50岁和51~60岁4个年龄组。高危型HPV感染率41~50岁及51~60岁两组明显高于其余两组,PCR及HC2-HPV-DNA两种检测方法对各个年龄段患者的高危型HPV感染检出率存在显著差异,见表1、图1。
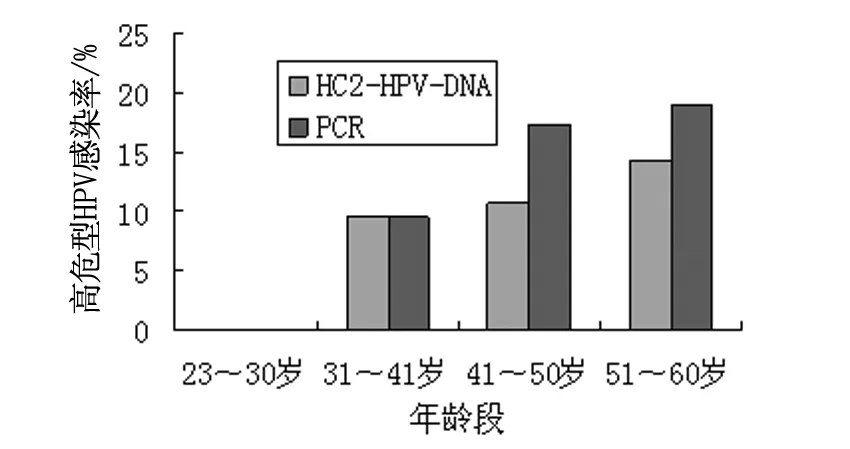
图1 不同年龄段患者高危HPV感染情况
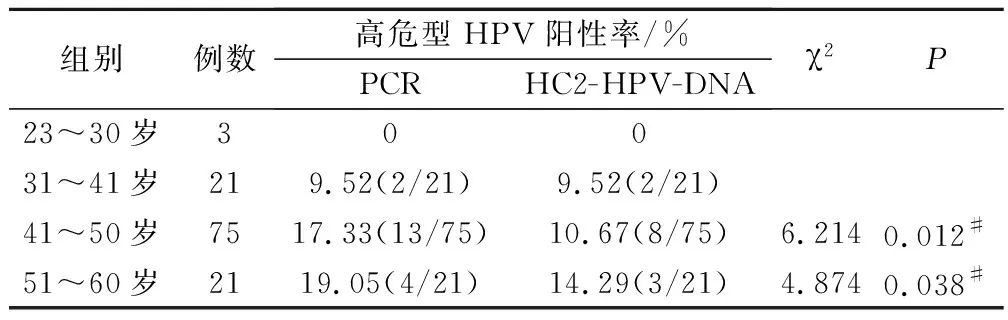
表1 PCR及HC2-HPV-DNA检测高危型HPV感染情况
注:#为PCR法与HC2-HPV-DNA法相比。
3 讨论
宫颈癌为仅次于乳癌的第二常见妇科恶性肿瘤,宫颈癌的发生及发展是一个从宫颈上皮内瘤变到浸润癌的漫长并逐渐演变的过程[8]。正是因为如此,早期发现、诊断及治疗宫颈癌是降低宫颈癌发病率及死亡率的关键,而癌前病变的筛选工作尤为重要。目前唯一病因明确的恶性肿瘤就是宫颈癌,研究发现宫颈癌的发生和HPV的感染密切相关[9]。在自然界中HPV普遍存在,目前发现有100余种HPV病毒的型别,大多数为不致病性,仅有少数型别的HPV才可以致癌[10]。HPV依据致病能力的高低分为低危型及高危型两种,而高危型则是引发宫颈癌的重要因素,从病因上讲,对宫颈癌病因进行的监测及干预可以降低宫颈癌的发生,这比治疗已确诊的宫颈癌患者的意义更远大,因此能对高危型的HPV感染进行检测,可以有效地预防宫颈癌的发生。HPV 是一种常见的病毒,HPV在体内感染后有3种演变方式。①进展期:有一部分HPV感染后需经一定的潜伏期,然后进一步发展才会有临床表现,如肿瘤、尖锐湿疣等;②静止期:如HPV于皮肤黏膜组织长期存在就不会引起临床症状;③消退期:部有一部分HPV的感染具有自限性,经一定阶段后能逐渐消失。因此,HPV感染通常要经过潜伏期、亚临床期、临床症状期及HPV相关的肿瘤期。对于潜伏期及亚临床期,有时可以检测到HPV的存在,但在初期,部分患者还没有发生细胞学的改变,因此更不会有组织学的改变。
检测高危型HPV的方法目前虽然有很多种,PCR及HC2-HPV-DNA是其中很重要的两种方法。HC2-HPV-DNA检测技术的原理是首先捕获RNA抗体,然后通过化学发光法来放大信号进而来检测高危型HPV,而PCR检测高危型HPV是通过DNA扩增技术[11]。其中HC2-HPV-DNA是唯一种通过美国FDA认证的高危型HPV的检测方法,是检测高危型HPV的金标准[12]。本研究使用PCR及HC2-HPV-DNA两种方法来检测120例健康女性患者高危型HPV的感染情况,研究结果发现在检测出高危型HPV的阳性率方面HC2-HPV-DNA技术低于PCR技术,两者在阳性检测率上存在着明显的差异,这与Chateau等[13]的研究结果相符合。本研究的结果还显示虽然高危型HPV感染率在各年龄段组女性的分布趋势没有显著差异,但是两种检测方发均显示高危型HPV的感染的阳性率在41~50岁及51~60岁两个年龄段组中的女性明显高于其余两组,且其差异有统计学意义。依照两种实验方法的检测原理而进行分析后,由于HC2-HPV-DNA检测技术应用了RNA-探针和信号放大技术,因而避免了PCR检测技术过程中的DNA错配和交叉反应而造成的假阳性,故HC2-HPV-DNA检测技术优于PCR检测方法,因此其高危型HPV感染的检测结果更加可靠。虽然宫颈癌发生与高危型HPV感染有关,但是这并不代表任何高危型HPV检测阳性的健康体检者都会患宫颈癌。反而言之,宫颈癌患者也并非均为高危型HPV检测的阳性患者。因此,HC2-HPV-DNA检测可以作为细胞学检测的重要补充,在妇女宫颈癌的风险评估中发挥着重要的作用。因此对可能发生宫颈癌的高危人群使用HC2-HPV-DN检测方法来检测此型HPV感染的阳性率来进行宫颈癌的早期筛查,对宫颈癌的预防及发生发展在、起着重要的作用。
综上所述,本研究通过使用PCR及HC2-HPV-DNA两种检测方法对120例健康体检女性高危HPV的感染率进行研究, 研究结果发现HC2-HPV-DNA检测技术在高危型HPV检测上优于PCR技术,更适合与中老年女进行高危型HPV的检测,这样就可以对检测结果阳性者进行早期的干预措施,进而可以有效地达到预防宫颈癌的发生。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics〔J〕.CA Cancer J Clin,2011,61(2):69-90.
[2] 梁东霞,张彦娜.宫颈癌与hpv关系的研究进展〔J〕.实用癌症杂志,2010,25(2):202-205.
[3] 李 青,钱 宁,张静敏,等.HC2-HPV-DNA 检测与薄层液基细胞学检查在筛查宫颈癌中应用价值的对比〔J〕.南京医科大学学报(自然科学版),2009,29(8):1172-1174.
[4] 张丽娜,周蓓蓓,张 玢,等.HR-HPV 检测与细胞学联合检查在宫颈病变筛查中的应用〔J〕.中国现代医学杂志,2011,21(14):1665-1669.
[5] 王 鹤,于继云,李 力,等.广西宫颈癌患者HPV感染情况的分子流行病学调查〔J〕.中国肿瘤临床,2012,39(24):2070-2074.
[6] 张敏鸽,刘明晖.高危HPV与宫颈癌发生的相关性〔J〕.实用癌症杂志,2012,27(6):670-672.
[7] Preisler S,Rebolj M,Untermann A,et al.Prevalence of Human Papillomavirus in 5,072 Consecutive Cervical SurePath Samples Evaluated with the Roche Cobas HPV Real-Time PCR Assay〔J〕.PLoS One,2013,8(3):e59765.
[8] 陈丽芳.Cervista法与基因分型法检测高危型人乳头状瘤病毒的对比研究〔D〕.福建医科大学,2012:33.
[9] Powell NG,Hibbitts SJ,Boyde AM,et al.The risk of cervical cancer associated with specific types of human papillomavirus:acase-control study in a UK population〔J〕.Int J Cancer,2011,128(7):1676-1682.
[10] 李世霞.515例妇女高危型HPV感染检测结果分析〔J〕.中国肿瘤临床,2011,38(16):954-956.
[11] Tristao W,Ribeiro RM,Oliveira CA,et al.Epidemiological study of HPV in oral mucosa through PCR〔J〕.Braz J Otorhinolaryngol,2012,78(4):66-70.
[12] 李萌辉,李世霞,刘俊田.两种高危型HPV 检测方法在宫颈癌早期筛查中的应用〔J〕.中国肿瘤临床,2013,40(21):1300-1303.
[13] Du Chateau BK,Schroeder ER,Munson E.Clinical laboratory experience with cervista HPV HR as a function of cytological classification:comparison with retrospective digene HC2 high-risk HPV DNA test data〔J〕.J Clin Microbiol,2013,51(3):1057-1058.
