Smad4及P21WAF1/CIP1在卵巢上皮癌组织中的表达及意义
2014-09-13陈凤云胡小青
陈凤云 胡小青
TGF-β/Smads信号通路中的信号由细胞核外进入核内要借助于Smads家族中的核心成员Smad4的核转运功能。若Smad4突变或缺失,整个TGF-β超家族信号转导网络就会被破坏,胞外信号无法转运入核,使得下游基因的转录调节不受控制,导致增殖与分化失衡,形成肿瘤。有研究证实P21WAF1/CIP1是TGF-β/Smads信号通路的下游靶基因,P21WAF1/CIP1启动子的转录活性受Smad4的调控,当Smad4羧基末端被截断后,P21WAF1/CIP1的表达严重下降[1-2]。多数研究者认为TGF-β/Smads信号通路对于正常卵巢上皮的生长调控是至关重要的,若此信号通路及其下游靶基因遭到破坏时则可能导致卵巢癌的发生[3-6]。我们以卵巢上皮肿瘤组织中Smad4上游信号正常为假设前提,探讨Smad4蛋白及其下游信号在卵巢上皮肿瘤由良性向恶性转化过程中的作用及相关性。
1 材料与方法
1.1 临床资料
收集2007年1月-2009年12月江西省妇幼保健院收治的行手术切除的89例卵巢组织标本存档蜡块,患者术前均未行任何治疗,均有完整的临床病理资料,均经病理检查确诊,并由两位主治级别以上的病理医师复查HE切片核实病理诊断。卵巢上皮癌按FIGO2000分期标准进行分期。
卵巢上皮良性肿瘤组24例:浆液性囊腺瘤14例,黏液性囊腺瘤10例,年龄19~54岁。卵巢上皮交界性肿瘤组22例:浆液性交界瘤8例,黏液性交界瘤14例,年龄23~58岁。
卵巢上皮癌组43例,均为原发癌,年龄30~68岁,中位年龄50岁。病理类型:浆液性囊腺癌18例,黏液性囊腺癌10例,子宫内膜样癌15例。临床分期:Ⅰ~Ⅱ期23例,Ⅲ~Ⅳ期20例。组织学分化:高分化(G1)9例,中低分化(G2-3)34例。有淋巴结转移12例,无淋巴结转移31例。
1.2 主要试剂及方法
Smad4(SC-7966)为浓缩型单克隆抗体,购自美国Santa Cruz公司(由北京中杉金桥公司代购);P21WAF1/CIP1(ZM-0206)为即用型单克隆抗体,P21WAF1/CIP1抗体及SP试剂盒购自福州迈新生物技术有限公司。
采用S-P两步法进行免疫组织化学染色,实验步骤按照试剂盒说明书进行。
1.3 判断标准
Smad4蛋白表达主要定位于细胞质,也有少量位于细胞核中;P21WAF1/CIP1蛋白表达主要定位于细胞核;以细胞质或细胞核出现棕黄色颗粒为阳性细胞。选择染色均匀的肿瘤区域,在 400 倍视野下计数着色细胞占细胞总数的百分比,共计数 10个视野,取平均值。① 按着色细胞占视野细胞总数的比例分为 0~3级:无阳性细胞为0 级;< 25 %为1级;25%~50 %为2级;>50 %为3级。② 按染色强弱分:0 级,阴性;1级,弱;2级,中;3 级,强。按 ①与②级数之和判断结果,以0~6表示:0~2 为(-);3~4为(+);5~6为(++)。(-)和(+)为阴性组,(++)为阳性组。
1.4 统计学处理
应用SPSS 17.0软件进行统计学处理。计数资料采用卡方检验,小样本资料采用Fisher确切概率法。相关性应用非参数统计中的Spearman等级相关性分析。P<0.05为差别有统计学意义。
2 结果
2.1 Smad4在卵巢上皮良性肿瘤、卵巢上皮交界性肿瘤及卵巢上皮癌组织中的表达(表1)
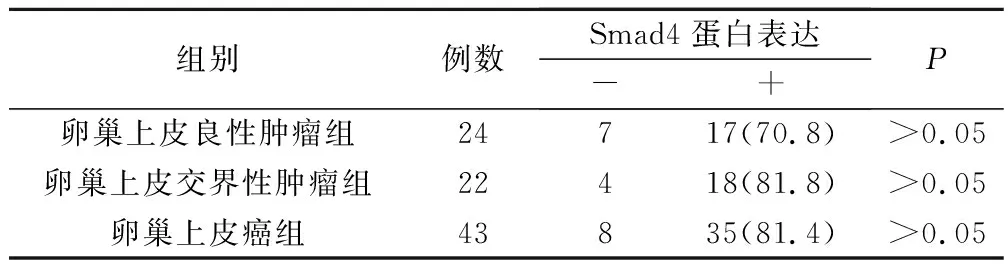
表1 Smad4蛋白在卵巢上皮良性肿瘤、卵巢上皮交界性肿瘤及卵巢上皮癌组织中的表达(例,%)
卵巢上皮良性肿瘤与卵巢上皮交界性肿瘤组织Smad4阳性表达率比较,P>0.05;卵巢上皮交界性肿瘤与卵巢上皮癌组织Smad4阳性表达率比较,P>0.05;卵巢上皮癌与卵巢上皮良性肿瘤组织Smad4阳性表达率比较,P>0.05。
2.2 Smad4蛋白表达与卵巢上皮癌临床病理特征的关系(表2)
Smad4蛋白表达与卵巢上皮癌的FIGO分期、组织学类型,病理分化及淋巴结有无转移无相关性。
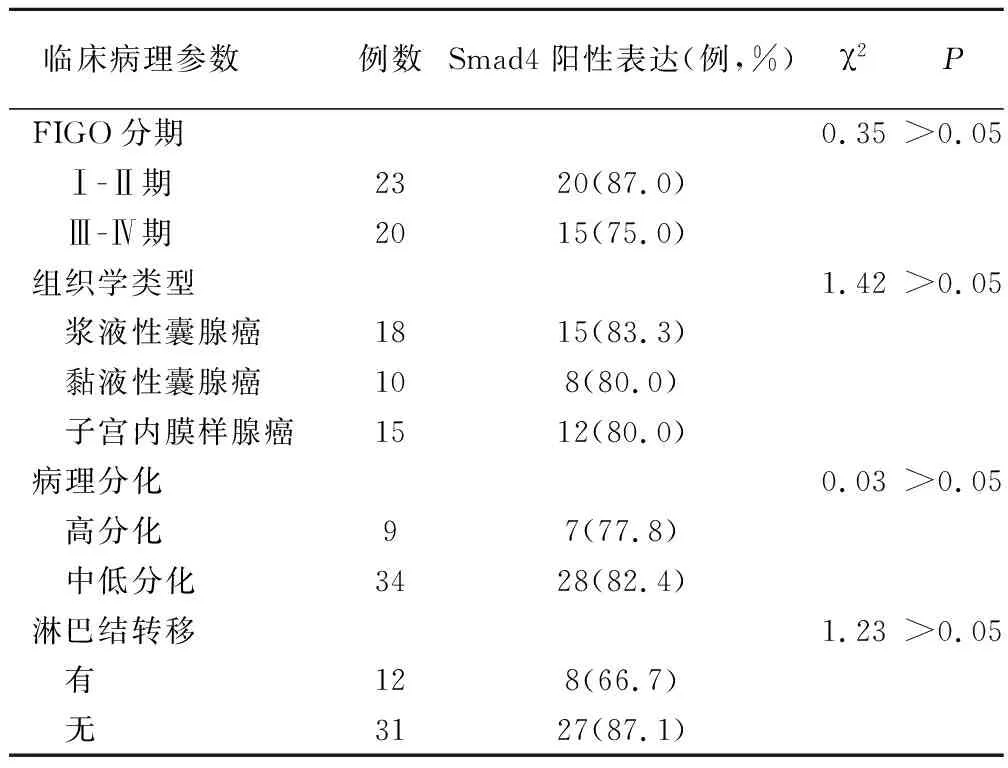
表2 Smad4蛋白表达与卵巢上皮癌临床病理特征的关系
2.3 P21WAF1/CIP1在卵巢组织中的表达
P21WAF1/CIP1在卵巢上皮良性肿瘤、卵巢上皮交界性肿瘤及卵巢上皮癌组织中的表达见表3。

表3 P21WAF1/CIP1蛋白在卵巢上皮良性肿瘤、卵巢上皮交界性肿瘤及卵巢上皮癌组织中的表达(例,%)
卵巢上皮良性肿瘤与卵巢上皮交界性肿瘤组织Smad4阳性表达率比较,P>0.05;卵巢上皮交界性肿瘤与卵巢上皮癌组织Smad4阳性表达率比较,P>0.05;卵巢上皮癌与卵巢上皮良性肿瘤组织Smad4阳性表达率比较,P>0.05。
2.4 P21WAF1/CIP1蛋白表达与卵巢上皮癌临床病理特征的关系(表4)
P21WAF1/CIP1蛋白表达与卵巢上皮癌的FIGO分期及病理分化密切相关,与其组织学类型及有无淋巴结转移无相关性,见表4。
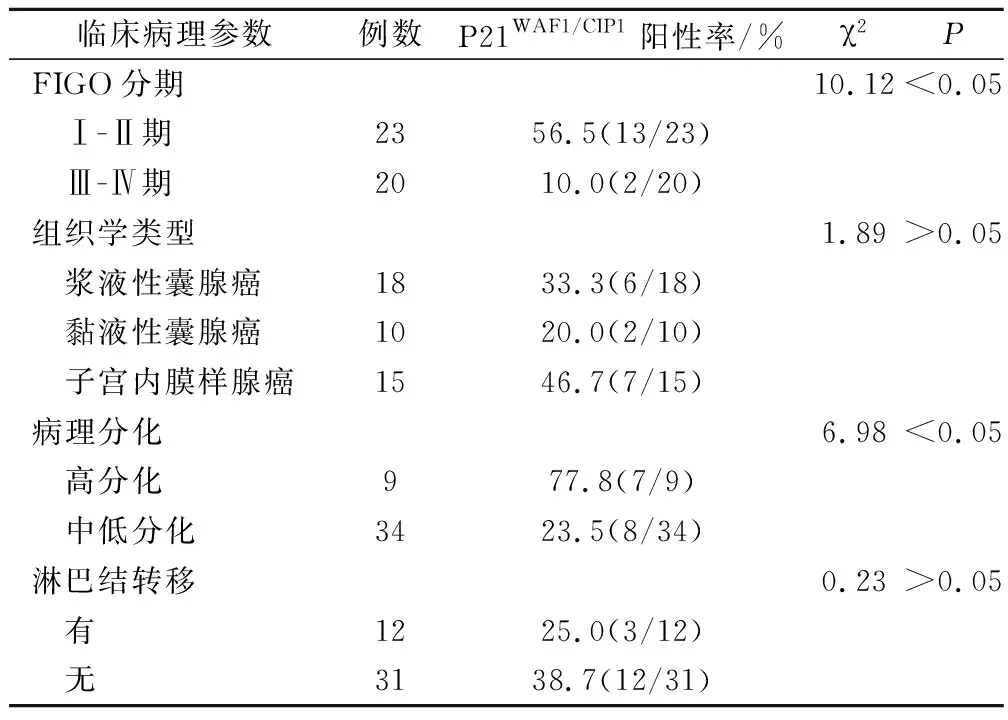
表4 P21WAF1/CIP1蛋白表达与卵巢上皮癌临床病理特征的关系
2.5 卵巢上皮癌组织中Smad4及P21WAF1/CIP1蛋白表达的相关性
43例卵巢上皮癌组织中,Smad4及P21WAF1/CIP1同时呈阳性表达13例;同时呈阴性表达6例;22例Smad4呈阳性表达而P21WAF1/CIP1呈阴性表达;有2例Smad4呈阴性表达而P21WAF1/CIP1呈阳性表达。经统计,Smad4及P21WAF1/CIP1蛋白在卵巢上皮癌组织中的表达无相关性(Rs=0.099,P>0.05)。
3 讨论
Smad4,又称DPC4(Deleted in pancreatic cancer 4),位于染色体18q21.1上,是研究胰腺癌时发现大多数标本的18号染色体长臂上存在杂合性缺失(loss of heterozygosity LOH),予命名为DPC4(Deletedin Pancreatic Cancer4)基因。后来发现DPC4蛋白与果蝇的MAD和线虫的Sma2、Sma3、Sma4蛋白属同源蛋白,都是转化生长因子(TGF-β)超家族信号传导的成员,参与细胞内信号传导,所以后来将这类蛋白统称为Smads蛋白,故DPC4也称为Smad4。Smad4作为Smad家族的核心成员,既是TGF-β超家族受体的直接底物,又是将受体信号传递导核内的递质。若Smad4突变或缺失,整个TGF-β超家族信号转导网络就会被破坏,胞外信号无法转运入核,使得下游基因的转录调节不受控制,导致增殖与分化失衡,最终形成肿瘤。有报道Smad4在其脑胶质瘤、大肠癌、肝癌、宫颈癌等多种肿瘤中都有不同程度表达下调[7-10]。Heini等[11]通过等位基因分析后认为,18q21.1近端区域的Smad4、Smad2、DDC为卵巢癌抑癌基因,三者中一个或一个以上的等位基因突变或缺失在卵巢上皮癌的形成事件中占有相当大的作用。本试验在前人研究的基础上,假定卵巢上皮肿瘤组织中TGF-β受体正常的前提下,对89例卵巢肿瘤组织进行Smad4蛋白检测后发现Smad4的缺失并不是卵巢上皮癌发生发展的关键原因。
P21CIP1是寻找细胞周期依赖性蛋白激酶调节蛋白时发现的1种可与其相互作用的蛋白,与野生型P53蛋白激活因子为同一基因,又称为P21WAF1/CIP1基因,是P53重要的下游基因。当细胞受到各种损伤后,野生型P53通过P21WAF1/CIP1上游2.4kb和8kb处的P53蛋白特异性结合位点结合并表达产生P21WAF1/CIP1蛋白,这是依赖P53途径的功能。P21还有非依赖P53途径的功能,即P53通路破坏时,P21WAF1/CIP1蛋白可以在TGF-β/Smads通路中的信号刺激而高表达[12];这是因为在其第二个外显子的近端区域(-124/-61)间含有多个构成性转录协同因子SP1结合位点,它能与结合在Smad2/3/4的MH1区域上的SP1结合,而诱导P21WAF1/CIP1蛋白的表达。本研究与Annette等研究相符[13],这些数据表明在卵巢上皮肿瘤由良性向恶性转化的过程中,P21WAF1/CIP1蛋白的阳性表达率逐渐下降;在卵巢上皮癌组织中,病理分化越低、临床分期越晚,P21WAF1/CIP1蛋白阳性表达率越低;提示P21WAF1/CIP1蛋白的缺失与卵巢上皮肿瘤的恶性进展关系密切。
多数研究者认为,在胰腺癌、肝癌及乳腺癌等恶性肿瘤中P21WAF1/CIP1为Smad4的下游靶基因,其表达水平受Smad4蛋白的调控,并与Smad4的表达水平呈正相关;若上游的Smad4蛋白表达下降,P21WAF1/CIP1的表达水平也相应下降,其抑制细胞周期的活性也随着降低,使DNA复制失控,最终导致细胞癌变的发生。但是在我们的研究中发现:在卵巢上皮肿瘤由良性向恶性进展的过程中,Smad4蛋白表达无明显改变,而P21WAF1/CIP1蛋白的表达则有一个下降的过程。这表明Smad4蛋白的缺失可能并不是卵巢上皮肿瘤恶性进展的关键原因;且卵巢上皮恶性肿瘤组织中P21WAF1/CIP1蛋白的表达并不受Smad4蛋白表达的调控。总之,TGF-β所介导的TGF-β/Smads信号通路在卵巢上皮癌中不能正常发挥生长抑制作用,不是因为Smad4蛋白的核转运功能障碍,可能是由于Smad4蛋白的上游信号异常所致。在下一步的研究工作中,我们将对卵巢上皮癌组织中Smad4蛋白的上游信号再行研究,以探讨此信号通路中其它组成成分在卵巢上皮癌发生发展过程中的作用。
[1] Qin H,Chan MW,Liyanarachchi S,et al.An integrative ChIP-chip and gene expression profiling to model SMAD regulatory modules〔J〕.BMC Syst Biol,2009,3:73.
[2] Pardali K,Kowanetz M,Heldin CH,et al.Smad pathway-specific transcriptional regulation of the cell cycle inhibitor P21WAF1/CIP1〔J〕.J Cell Physiol,2005,182(2):205-212.
[3] Rodriguez GC,Haisley C,Hurteau J,et al.Regulation of Invasion of Epithelial Ovarian Cancer by Transforming Growth Factor-β〔J〕.Gynecol Oncol,2001,80(2):245-253.
[4] Chen T,Triplett J,Dehner B,et al.Transforming Growth F-actor-β Receptor Type I Gene Is Frequently Mutated in Ovarian Carcinomas〔J〕.Cancer Res,2001,61(12):4679-4682.
[5] Toutirais O,Chartier P,Dubois D,et al.Constitutive expres
sion of TGF-beta1,interleukin-6 and interleukin-8 by tumor cells as a major component of immune escape in human ovarian carcinoma〔J〕.Eur Cytokine Netw,2003,14(4):246-255.
[6] Wang D,Kanuma T,Mizunuma H,et al.Analysis of Specific Gene Mutations in the Transforming Growth Factor-β Signal Transduction Pathway in Human Ovarian Cancer〔J〕.Cancer Res,2000,60(16):4305-4310.
[7] Kjellman C,Olofsson S,Hansson O,et al.Expression of T-GF-beta isoforms,TGF-beta receptors,and SMAD molecules at different stages of human glioma〔J〕.Int J Cancer,2000,89(3):251-258.
[8] Woodford-Richen K,Rouwan A,Gorman P,et al.SMAD4 -mutations in colorectal cancer probably occur before chromosomal instability,but after divergence of the microsatellite instability pathway〔J〕.PNAS,2001,99(17):9719-9723.
[9] Amin R,Mishra L.Liver Stem Cells and TGF-β in Hepatic Carcinogenesis〔J〕.Gastrointest Cancer Res,2008,2(4):S27-S30.
[10] Ki KD,Tong SY,Huh CY,et al.Expression and mutational analysis of TGF-β/Smads signaling in human cervical cancers〔J〕.Gynecol Oncol,2009,20(2):117-121.
[11] Lassus H,Salovaara R,Aaltonen LA,et al.Allelic Analysis of Serous Ovarian Carcinoma Reveals Two Putative Tumor Suppressor Loci at 18q22-q23 Distal to SMAD4,SMAD2,and DCC〔J〕.Am J Pathol,2001,159(1):35-42.
[12] Barbareschi M,Caffo O,Doglioni C,et al.P21waf1 immunohistochemical expression in breast carcinoma:correlations with P53-independent expression and association with tumoral differentiation〔J〕.Oncogene,2003,12(6):1391-1324.
[13] Schmider-Ross A,Pirsig O,Gottschalk E,et al.Cyclin-dependent kinase inhibitors CIP1 (p21) and KIP1 (p27) in ovarian cancer〔J〕.J Cancer Res Clin Oncol,2006,132(3):163-170.
