索拉非尼联合顺铂抑制人肺癌裸鼠移植瘤生长的疗效研究
2014-09-13崔彦芝陈逢生
郑 航 崔彦芝 陈逢生
索拉非尼最初是在对c-RAF激酶的抑制剂先导物进行结构-活性评价的生化分析中被发现的,其对c-RAF、野生型和突变型b-RAF有强效的抑制作用,直接抑制肿瘤细胞的生长,还能抑制人VEGFR-2和小鼠VEGFR-2、VEGFR-3、PDGFR-β、FLT3和c-KIT的酪氨酸激酶活性,阻断肿瘤新生血管的形成和切断肿瘤细胞的营养供应,间接地抑制肿瘤细胞的生长,有双重抗肿瘤作用[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是发病率和病死率都很高的恶性肿瘤,目前化疗使晚期NSCLC的病死风险下降尚不足30%;对于放化疗失败的NSCLC患者,尚缺乏有效手段控制其病情进展。因此,有必要寻找和开发新的药物,近年来兴起的分子靶向治疗药物日益引起重视。本研究通过观察索拉非尼联合顺铂对肺癌A549细胞裸鼠移植瘤的抑制效果及对裸鼠免疫功能的影响,为索拉非尼治疗肺癌的临床应用提供实验依据。
1 材料与方法
1.1 药物、动物与细胞株
索拉非尼片剂为拜耳制药公司产品。顺铂注射液为连云港豪森制药生产。
4~5 周龄的 BALB/c(nu/nu)裸小鼠 50 只,SPF级,雌雄各半,由广州中医药大学动物实验中心提供。A549肺癌细胞株来源于本中心。
1.2 人肺癌 A549裸鼠移植瘤模型的建立及治疗实验分组
人肺癌A549细胞悬液(含活细胞5×106/ml)接种于裸鼠右腋皮下,每只裸鼠注射0.2 ml。将成瘤小鼠(瘤重达120~140 mg)随机分成空白对照组、溶剂对照组、索拉非尼组、顺铂组和联合用药组共5组,每组10只。索拉非尼组给予索拉非尼30 mg/kg,胃管灌入0.1 ml,每天1次,共12 d;腹腔注射生理盐水0.2 ml,每4 d 1次,共3次;顺铂组给予顺铂5 mg/kg,腹腔注射0.2 ml,每4 d 1次,共3次,生理盐水0.1 ml胃管灌入,每天1次,共12 d。联合用药组给予索拉非尼30 mg/kg,顺铂5 mg/kg,2种药物于同一天开始给药,早上给予索拉非尼,下午给予顺铂,时间间隔3~5 h。而溶剂对照组给予稀释至与索拉非尼组相同浓度的溶剂0.1 ml,腹腔注射0.2 ml生理盐水,时间同上述。空白对照组按上述给药方式及时间给予生理盐水腹腔注射或胃管灌入。
1.3 裸鼠体重及瘤重的测定
给药第1天开始测体重和瘤重,每周测2次。应用游标卡尺测量肿瘤长径(a)及短径(b);瘤体积根据以下公式计算:瘤重=(a×b2)/2,绘制皮下肿瘤生长曲线。
1.4 疗效及毒性评价
疗效评价以治疗后肿瘤体积增长至治疗前2倍所需的时间,用T2表示。疗效以完全缓解(complete remission,CR)、部分缓解(partial remission,PR)和肿瘤生长延迟时间(tumor growth delay,TGD)来评价:肉眼皮下肿瘤完全消失至少超过5 d为CR;肿瘤体积缩小在50%~100%间,并至少持续5 d为PR;TGD指处理组T2与空白对照组T2的差值。毒性评价:以超过20%裸鼠死亡和(或)体重(去除瘤重)减轻超过20%为毒性标准。
1.5 统计学处理
2 结果
2.1 索拉非尼、顺铂单药和联合用药对人肺癌 A549移植瘤的治疗效应
联合用药组肿瘤生长较其余4组均慢,表明联合用药组抑制肿瘤生长效果优于索拉非尼及顺铂单药组。治疗后第25天空白对照组和溶剂对照组肿瘤瘤体积比较无显著性差异(P=0.072),联合用药组肿瘤瘤体积小于索拉非尼及顺铂单药组(P<0.01),见图1。
各治疗组与对照组相比,T2明显延长(P<0.01);联合用药组T2(29.05 d)长于索拉非尼(19.31 d)和顺铂组(21.22 d)。联合用药组TGD较索拉非尼(8.53 d)及顺铂单药组(9.72 d)长,达16.73 d,见表1。
2.2 索拉非尼、顺铂单药和联合用药对人肺癌 A549移植瘤的安全性和毒性
各治疗组耐受性良好,每组均病死率均示超过20%,体重减少亦未超过20%。溶剂对照组、顺铂组、索拉非尼组及联合用药组各死亡1只。各组均无CR,其中索拉非尼单药组及联合用药组各有1只PR,见表2。
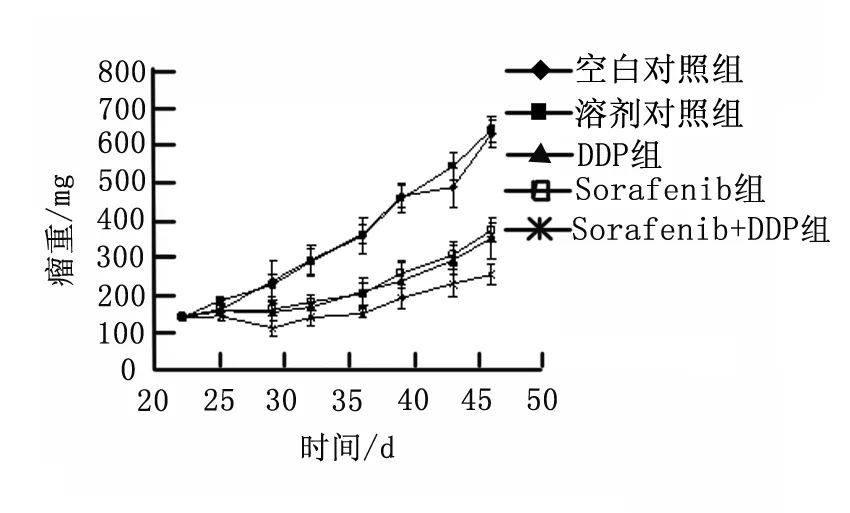
图1 索拉非尼、顺铂单药及联合用药对人肺癌 A549细胞移植瘤模型瘤体积的影响

组别 T2/dTGD/d空白对照组11.75±2.83 0溶剂对照组10.91±3.02-0.84Sorafenib组20.28±2.03∗ 8.53DDP组21.47±3.87∗ 9.72Sorafenib+DDP组28.48±4.35∗#△ 16.73
注:*为与对照组比较P<0.05;△为与Sorafenib组比较P<0.05;#为与DDP组比较P<0.05;T2为肿瘤增长至治疗前瘤体积2倍所需的时间;TGD为肿瘤生长延迟时间。
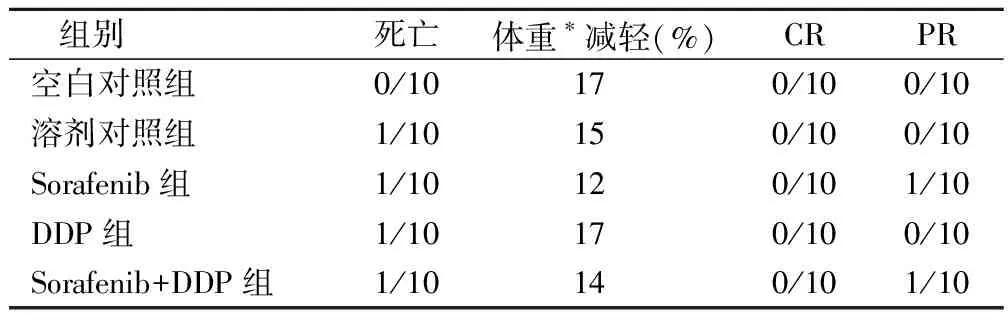
表2 索拉非尼、顺铂单药及联合用药对人肺癌 A549细胞移植瘤裸鼠的疗效和毒性
注:* 为去除瘤重的体重。
3 讨论
对于晚期难治性肺癌病例,彻底根治的机会很小,而延长生存期、提高生活质量则成为更为重要的目标。索拉非尼联合化疗药物方案可以是很多晚期实体瘤有价值的治疗方案选择之一。本实验通过索拉非尼联合顺铂在人肺癌移植瘤模型中的研究,观察两药联合的安全性及抗肿瘤活性,为临床的应用提供一定的试验依据。
研究[1-2]显示,索拉非尼每日1次口服对人肿瘤的动物移植模型了广泛的抗肿瘤活性,如小鼠非小细胞肺癌模型NCI-H460、NCI-H23和A549,结肠癌模型HT-29、DLD-1、HCT-116和Colo-205,乳腺癌模型MDA-MB-231、胰腺癌模型Mia-Paca-2等,肿瘤的生长抑制率为30%~94%。与紫杉醇、伊立替康、吉西他滨和顺铂等联合应用后抗肿瘤作用增强,而毒副作用不增强[3-4]。 Carter等[5]在NCI-H460模型中,应用长春瑞滨(6.7 mg/kg)和索拉非尼(40 mg/kg)治疗后,单药TGD分别为2.4 d和7.8 d,联合用药TGD达10.0 d,且毒副作用不增强;而在NCI-H23模型中,高剂量索拉非尼联合顺铂耐受性良好,疗效与顺铂单药相仿,但低剂量两药联合产生相加的作用,疗效优于单药或至少和单药相似[5]。达卡巴嗪(DTIC)联合或不联合索拉非尼作为一线方案治疗晚期黑色素瘤患的Ⅱ期随机研究结果显示[6],索拉非尼+DTIC组较安慰剂+DTIC 组的中位TTP显著延长(21.1 周对11.7 周,RR 为0.619,P=0.039);两组最佳应答率(ORR:CR+PR)、疾病控制率分别为24% vs 12%和71% vs 56%;两组6个月和9个月PFS率分别为41% vs 20%和22% vs 12%。本实验结果显示,根据瘤重增长曲线,索拉非尼和顺铂无论单药还是联合,均显示出抗肿瘤活性,而联合用药肿瘤生长比单药更慢。索拉非尼单药组和顺铂单药组的TGD分别为8.53 d和9.72 d,联合用药组出现了更长的TGD,达16.73 d。索拉非尼联合顺铂在裸鼠A549细胞移植瘤模型中显示出了增强的抗肿瘤效应。与上述结果一致。
临床试验显示[7],索拉非尼联合化疗药物在多种进展期实体瘤包括RCC、黑色素瘤、HCC和结肠癌中,取得优于单药甚至相加的作用,联合治疗的疾病控制率达79%,而且具有较好的安全性和耐受性,联合应用的安全性和耐受性与临床前研究的结果相一致[3-4]。其主要不良反应是手足综合征、皮疹、腹泻和疲乏,这些不良反应多为暂时性的轻度、中度反应,经对症处理可恢复正常。本研究中,溶剂对照组、顺铂组及联合用药组各有1只裸鼠死亡,索拉非尼组有1只死亡,其中溶剂对照组、索拉非尼组及联合组裸鼠死亡为灌胃操作不当引起。顺铂组死亡裸鼠解剖后未发现明显的肿瘤转移及淋巴结肿大,考虑药物毒性所致。各组裸鼠死亡率及体重减轻均未超过20%,提示联合用药组亦未出现比单药更强的毒性,该浓度索拉非尼和顺铂两药联用是安全、能耐受的。
索拉非尼在体外试验中可诱导多种肿瘤细胞的Bcl-2家族成员Mcl-1下调[8],而抗凋亡分子(如Bcl-2)的过表达可能是化疗药物的耐药机制之一[9]。最近的证据显示,Bcl-2 和C-Raf可协同抑制凋亡[9],Raf可以上调多药耐药基因(mdr-1)的表达[10],因此,或许可以通过Raf抑制剂如索拉非尼来减低化疗药物的耐药性。研究发现,对单药化疗抵抗的肿瘤与索拉非尼联用时显示出了增强的抗肿瘤效应,提示了索拉非尼可能增强这些化疗药的敏感性。比如,索拉非尼联合奥沙利铂治疗奥沙利铂无效的结肠癌患者仍可使疾病得到稳定;对紫杉类、铂类及蒽环类抵抗的卵巢癌患者接受索拉非尼联合吉西它滨治疗仍可出现PR[11]。吉西它滨治疗无效的鼻咽癌患者联合索拉非尼后SD仍可超过1年[11]。这些结果与临床前研究哟一致性,其机制值得我们深入研究。
总之,索拉非尼及顺铂联合用药对人肺癌 A549裸鼠移植瘤模型显示出了增强的抗肿瘤效应。两药在该剂量水平联合具有较好的安全性和耐受性。随着对生物化疗这一模式研究的深入,无论是临床前还是临床试验,越来越多的联合方案及实体肿瘤被纳入研究中。索拉非尼联合化疗药物这种生物化疗方案逐渐成为研究热点,但其内在联合机制仍未明确,有待进一步探讨。
[1] Wilhelm S,Chien DS.BAY 43-9006:preclinical data〔J〕.Curr Pharm Des,2002,8(25):2255-2257.
[2] Lyons JF,Wilhelm S,Hibner B,et al.Discovery of a novel Raf kinase inhibitor〔J〕.Endocr Relat Cancer,2001,8(3):219-225.
[3] Vincent P,Zhang X,Chen C,et al.Preclinical chemotherapy with the Raf kinase inhibitor BAY 43-9006 in combination with gefetinib,vinorelbine,gemcitabine or doxorubicin〔R〕.Prac Am Assoc Cancer Res 94th Annual Meeting,Washington,DC,2003,44:164.
[4] Vincent R,Bernando V,Chen C,et al.Chemotherapy with BAY 43-9006 in combination with Irinotecan or administered as repeated cycles of therapy against the DLD-1 human tumor xenograft〔J〕.Clin Cancer Res,2003,44:4469.
[5] Carter CA,Chen C,Brink C,et al.Sorafenib is efficacious and tolerated in combination with cytotoxic or cytostatic agents in preclinical models of human non-small cell lung carcinoma〔J〕.Cancer Chemother Pharmacol,2007,59(2):183-195.
[6] McDermott DF,Sosman JA,Hodi FS,et al.Randomized p-hase II study of dacarbazine with or without sorafenib in patients with advanced melanoma〔J〕.J Clin Oncol,2007,25(18S):8511-8511.
[7] Rietschel P,Ejadi S,Wolchok J.etal.Phase II trial of extended-dosing temozolomide in patients with melanoma〔J〕.J Clin Oncol,2006,24(18S):8042-8042.
[8] Yu C,Bruzek LM,Meng XW,et al.The role of Mcl-1 downregulation in the proapoptotic activity of the multikinase inhibitor BAY 43-9006〔J〕.Oncogene,2005,24(46):6861-6869.
[9] Wang HG,Miyashita T,Takayama S,et al.Apoptosis regulation by interaction of Bcl-2 protein and Raf-1 kinase〔J〕.Oncogene,1994,9(9):2751-2756.
[10] Kim SH,Lee SH,Kwak NH,et al.Effect of the activated -Raf protein kinase on the human multidrug resistance1(MDR1)gene promoter〔J〕.Cancer Lett,1996,98(2):199-205.
[11] Siu LL,Awada A,Takimoto CH,et al.Phase I trial of sorafenib and gemcitabine in advanced solid tumors with an expanded cohort in advanced pancreatic cancer〔J〕.Clin Cancer Res,2006,12(1):144-151.
