蛋白酶体抑制剂MG132联合顺铂诱导肺癌A549细胞凋亡的机制
2014-09-12韩玉杰刘东雷潘丽红
韩玉杰 赵 松 杨 洋 刘东雷 吴 恺 潘丽红 朱 砾
(郑州大学第一附属医院,河南 郑州 450052)
肺癌是目前世界恶性肿瘤死亡的主要原因,发病率和病死率呈上升趋势〔1〕。化疗是肺癌治疗的一种重要手段〔2〕,但是目前肺癌细胞对化疗药物的耐药性以及毒副作用仍为治疗过程中一大难题。三肽基乙醛蛋白酶体抑制剂(MG132)(Z-Leu-Leu-Leu-CHO)是一种常用的肽醛类26S蛋白酶体抑制剂,它能够抑制泛素-蛋白酶体通路〔3〕介导的蛋白质降解,如影响核转录因子(NF-κB)、半胱氨酸蛋白酶(caspase)和凋亡抑制蛋白等的降解过程,从而影响细胞增殖促进细胞凋亡,是一种潜在的抗肿瘤药物〔4〕。本实验通过联合MG132和顺铂(DDP)作用于肺癌A549细胞,观察A549细胞抑制率、凋亡情况以及凋亡相关蛋白NF-κB、caspase9表达情况。探讨MG132和DDP联合应用调控A549细胞凋亡的作用机制,为肺癌的生物化疗提供了新的治疗思路和实验证据。
1 材料与方法
1.1细胞与试剂 肺癌A549细胞由河南省高等学校临床医学重点学科开放实验室惠赠;四甲基偶氮唑盐(MTT)、Hoechst33342荧光染料购于美国Sigma公司;DDP购于山东齐鲁制药有限公司。MG132购于Calbiochem公司。胎牛血清购于美国HyClone公司。无血清细胞冻存培养液(RPMI1640)、不含乙二胺四乙酸(EDTA)胰蛋白酶消化液购买于北京索莱宝科技有限公司公司。AnnexinV-FITC/PI细胞凋亡检测试剂盒购于南京凯基生物科技发展有限公司。兔抗人B-actin单抗、兔抗人caspase9多抗、兔抗人NF-κB多抗购于Santa Crus公司。
1.2方法
1.2.1细胞培养及分组 肺癌A549细胞培养于含有10%胎牛血清的RPMI1640培养基,置于37℃、5%CO2饱和适度的培养箱。1次/d更换培养液,用胰蛋白酶液(含0.02%EDTA和0.25%胰酶)消化细胞传代或实验操作。实验分组为不加药物干预的对照组、MG132组、DDP组、MG132与DDP联合组(同时加入MG132和DDP)。
1.2.2MTT法检测细胞抑制率 取对数生长期的肺癌A549细胞,以1×105个/ml浓度接种于96孔板,100 μl/孔,培养24 h,弃培养液,分别加入一系列浓度的DDP及MG-132,100 μl/孔,每个浓度设置5个复孔,对照组加入等体积的培养液,药物分别干预24、48、72 h后每孔加入5 g/L的MTT 10 μl,于37℃、5%CO2饱和适度的培养箱中孵育4 h,弃去培养液,每孔加入DMSO 100 μl,震荡10 min,用酶标仪于490 nm波长处测定吸光度(A)值。细胞抑制率=〔1-实验组A450/对照组A490〕×100%,每次实验重复3次。
1.2.3Hoechst33342染色检测细胞形态变化 用胰蛋白酶液处理对数生长期的肺癌A549细胞,制成1×105个/ml细胞悬液,接种于24孔板中,待细胞贴壁后,按实验浓度的MG132、DDP、联合组作用细胞24 h,弃培养基,磷酸盐缓冲液(PBS)冲洗2次,加入终浓度1 mg/L的Hoechst33342避光染色,37℃孵育20 min弃染液,PBS冲洗2次,然后置于倒置荧光显微镜观察细胞形态变化并摄片,计算荧光染色阳性细胞百分比。
1.2.4流式细胞术(FCW)检测细胞凋亡率 取对数生长期的肺癌A549细胞,胰蛋白酶消化制成1×105个/ml细胞悬液,接种于6孔板中,待细胞贴壁后,按实验浓度的MG132、DDP、联合组作用细胞24 h,收集悬浮及贴壁细胞,冷PBS洗涤细胞2次,加入400 μl Annexin结合液悬浮细胞,使细胞浓度约为1×106个/ml,细胞悬浮液中加入5 μl Annexin-FITC,4℃避光孵育15 min,再加入10 μl PI,4℃避光孵育5 min;流式细胞仪检测,每次实验重复3次。
1.2.5Western印迹检测凋亡相关蛋白的表达 取对数生长期的肺癌A549细胞,每孔2×105个/ml接种于6孔板,细胞贴壁后按实验浓度的MG132、DDP、联合组加入,培养24 h后收集悬浮及贴壁细胞,提取细胞蛋白,将等量的蛋白以12.5%十二烷基硫酸钠-聚丙烯凝胶电泳(SDS-PAGE)后将蛋白转移到硝酸纤维素膜上,含5%脱脂奶粉的Tris盐酸缓冲液(TBST)室温封闭1 h,再加入一抗caspase9、NF-κB及B-actin(抗体稀释浓度为1∶500),4℃孵育过夜,TBST洗涤3次,加入辣根过氧化物酶标记二抗室温孵育1 h,再用TBST洗涤3次,于硝酸纤维素膜上滴加化学发光法(ECL)显影,结果用图像处理仪(Gene Company)扫描,Image J软件分析条带的灰度值。

2 结 果
2.1MTT法检测药物最适浓度和作用时间 随着MG132和DDP的浓度和作用时间增加,细胞生长抑制率增加,呈浓度及时间依赖性。当MG132作用24 h时,IC50约为30 μmol/L;当DDP作用24 h时,IC50约为20 mg/L,因此本实验中MG132和DDP最适浓度分别为5 μmol/L和2.5 mg/L。
2.2Hoechst33342染色检测细胞形态变化 Hoechst33342能少许进入正常细胞膜,使其染上低蓝色,而凋亡细胞的膜通透性增强,染色体DNA的结构发生了改变从而使该染料能更有效地与DNA结合因此进入凋亡细胞中的Hoechst33342比正常细胞的多,荧光强度要比正常细胞中要高,并且凋亡细胞的染色体DNA结构也发生了改变。MG132组和DDP组,细胞核裂解,染色质凝集,表明细胞发生凋亡,Hoechst33342染色阳性细胞百分比分别为(15.2±0.1)%、(12.1±0.3)%。MG132与DDP联合组阳性细胞百分比为(33.5±1.3)%,与单用药组相比细胞凋亡明显增加(P<0.05)。见图1。
2.3Western印迹检测凋亡相关蛋白的表达 对照组、MG132组、DDP组及MG132+DDP组caspase9和NF-κB蛋白相对灰度值分别为0.37±0.12、0.46±0.04、0.49±0.07、0.72±0.14和0.75±0.08、0.53±0.02、0.59±0.07、0.34±0.01,差异均有统计学意义(均P<0.05)。MG132与DDP联合组干预24 h后caspase9表达明显增高,与单用药组相比具有统计学意义(P<0.05);两药联合干预24 h后,与单用药组相比,NF-κB表达明显降低(P<0.05)。见图2。
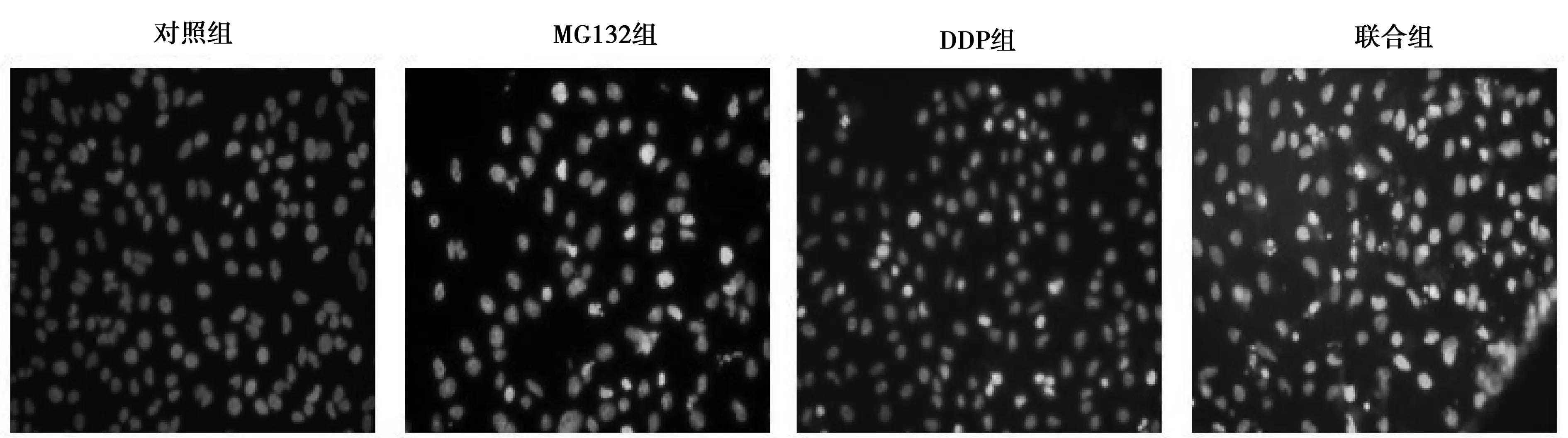
图1 Hoechst33342染色检测细胞形态变化(×200)

图2 Western印迹检测Bax和NF-κB蛋白的表达情况
2.4FCW检测细胞凋亡率 流式细胞仪检测MG132组细胞凋亡率为(22.13±0.36)%,与对照组(3.1±0.3)% 相比具有统计学意义(P<0.05)。DDP组细胞凋亡率为(25.76±0.25)%,与对照组相比具有统计学意义(P<0.05)。MG132与DDP联合组细胞凋亡明显增加,为(68.27±0.31)%,与MG132组相比具有统计学意义(P<0.05)。见图3。
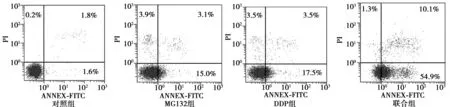
图3 MG132和DDP作用24 h后细胞凋亡情况
3 讨 论
肺癌发病率居恶性肿瘤首位,其中约80%为非小细胞肺癌。但是由于多数非小细胞肺癌患者就诊时已丧失手术机会,因此化疗就成为主要的治疗方法之一〔5〕。铂类药物(DDP、卡铂)是肺癌一线化疗方案的基础,DDP的主要作用靶点是DNA,进入肿瘤细胞后水解为双氯双氨铂,然后与细胞DNA形成DDP-DNA加合物,干扰细胞DNA的复制与转录,从而导致DNA错配并诱发细胞凋亡〔6〕。然而单用DDP易引起肿瘤的多种耐药性,且其毒副作用较大,肿瘤的耐药性一直是临床化疗难以克服的障碍〔7〕。因此,寻找新的毒副作用小耐药性小抗肿瘤作用靶点已成为当今的研究热点。
泛素蛋白酶体通路(UPP)是真核细胞中内源性蛋白质选择性降解的重要途径,阻断UPP可以提高凋亡信号的活性从而促使一些肿瘤细胞发生凋亡〔8〕。蛋白酶体抑制剂可以通过阻断蛋白酶体途径进而诱导多种肿瘤细胞凋亡,是一种非常有发展前途的抗肿瘤作用靶点〔9〕。目前,蛋白酶体抑制剂硼替佐米已被美国FDA认证是治疗多发性骨髓瘤的有效药物,其作用机制主要通过NF-κB信号通路抑制肿瘤细胞的增殖并促进其凋亡〔10〕。MG132是一种常见的醛基肽类特异性蛋白酶体抑制剂,已有许多研究证明它可以诱导多发性骨髓瘤、前列腺癌、卵巢癌、恶性血液病等多种肿瘤细胞的凋亡〔9〕。MG132通过抑制蛋白酶体的活性,进而抑制NF-κB的降解,阻止NF-κB释放,抑制NF-κB启动的基因转录,导致细胞凋亡蛋白水平降低,使细胞色素C容易与Apaf-1结合形成“凋亡小体”,激活caspase-9从而诱导细胞凋亡〔11〕。NF-κB是一种抑制细胞凋亡因子,调控多种免疫、炎症反应,在肿瘤的增殖、分化、转移和放化疗抵抗方面也起到重要的作用〔12〕。本研究提示,MG132与DDP联合作用促凋亡作用明显提高,其部分作用机制可能是蛋白酶体抑制剂MG132抑制DDP诱导肿瘤细胞中NF-κB的释放,提高了肿瘤细胞对DDP诱导凋亡的敏感性,进一步增强下游凋亡相关蛋白caspase9的活化以及表达。
综上,MG132与DDP联合应用能明显提高肺癌A549细胞凋亡率,并探讨其部分作用机制。这一研究成果,为临床上蛋白酶体抑制剂与化疗药物联合应用提高肿瘤对化疗药物的敏感性提供了实验依据。相信随着人们今后对蛋白酶体抑制剂的进一步研究,其在肿瘤的治疗过程中的作用机制也将得到明确。虽然本研究的体外实验结果有效,但是是否能有效地应用于临床治疗中,还需进一步进行动物实验来加以考证。
4 参考文献
1Spiro SG,Tanner NT,Silvestri GA,etal.Lung cancer:progress in diagnsis,staging and therapy〔J〕.Respirology,2012;15(1):44-50.
2Jin H,Yang R,Fong S,etal.Apo-ligand/tumor necrosis factor-related apoptosis- inducing ligand cooperates with chemotherapy to inhibit orthotopic lung tumor growth and improve survival〔J〕.Cancer Res,2004;64(14):4900-5.
3O'Leary EM,Igdoura SA.The therapeutic potential of pharmacological chaperones and proteosomal inhibitors,Celastrol and MG132 in the treatment of sialidosis〔J〕.Mol Genet Metab,2012;107(1-2):173-85.
4Inoue S,Nakase H,Matsuura M,etal.The effect of proteasome inhibit MG132 on experimental inflammatory bowel disease〔J〕.Clin Exp Immunol,2009;156(1):172-82.
5Schiller JH,Harrington D,Belani CP,etal.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer〔J〕.N Engl J Med,2002;346(2):92-8.
6刘彦国,杨 帆,姜冠潮,等.小分子干扰RNA抑制肺癌细胞Survivin表达对凋亡和顺铂耐药性的影响〔J〕.中华实验外科,2009;26(1):77-8.
7Köberle B,Tomicic MT,Usanova S,etal.Cisplatin resistance:preclinical findings and clinical implications〔J〕.Biochim Biophys Acta,2010;1806(2):172-82.
8Tu Y,Chen C,Pan J,etal.The Ubiquitin Proteasome Pathway (UPP) in the regulation of cell cycle control and DNA damage repair and its implication in tumorigenesis〔J〕.Int J Clin Exp Pathol,2012;5(8):726-38.
9Wu WK,Cho CH,Lee CW,etal.Proteasome inhibition:a new therapeutic strategy to cancer treatment〔J〕.Cancer Lett,2010;293(1):15-22.
10Kapnen A,Tucker C,Chikh G,etal.Cell based assays completed with the mantle cell lymphoma cell lines z138 and nceb-1 indicate that combinations of bortezomid and flavopiridol interact to achieve synergistic activity〔J〕.Blood,2005;11(106):2410-6.
11Guo N,Peng Z.MG132,a proteasome inhibitor,induces apoptosis in tumor cells〔J〕.Asia Pac J Clin Oncol,2013;9(1):6-11.
12Crawford LJ,Walker B,Irvine AE,etal.Proteasome inhibitors in cancer therapy〔J〕.J Cell Commun Signal,2011;5(2):101-10.
