高转移性结肠癌细胞株HT29的基因筛选
2014-09-12文西年文大成依里牙尔依里哈木许新才张文斌
王 理 文西年 文大成 依里牙尔·依里哈木 许新才 高 华 张文斌
(新疆医科大学第一附属医院胃肠外科,新疆 乌鲁木齐 830000)
大肠癌是我国最常见的恶性肿瘤之一,肝脏是大肠癌最常见的转移部位,已有研究认为结肠癌肝转移涉及原位癌细胞血管侵入、肝血管内皮细胞附着,以及肝实质浸润种植,从而导致肝转移灶的形成。其可能机制包括黏附分子、血管新生因子、细胞外金属基质蛋白酶等多种基因表达异常〔1〕。更加深入理解结肠癌肝转移的病理分子机制以及寻求新的治疗靶点,从而针对性开展临床试验是工作目标。本研究旨在建立一种新的结肠癌肝转移的模型,并通过体内及体外试验筛选出侵袭能力高、转移能力高的细胞株。
1 材料与方法
1.1试剂及器材 四甲基耦氮唑盐(MTT);二甲基亚砜(DMSO,美国Sigma公司);RPMI 1640(美国Gibco公司);胎牛血清(杭州四季青公司)。二氧化碳孵箱(美国NAPCO公司);超净工作台;离心机;ELISA酶标仪(Bio-Rad公司);倒置显微镜(日本Olympus公司);细胞培养板(Millipore公司);无菌滤器(美国Costar公司);无菌手术器械。
1.2细胞系及动物 结肠癌HT29 细胞株购自中国科学院上海细胞研究所。6~8周龄的BALB/c小鼠,雄性,体重18~22 g,由新疆医科大学实验动物中心提供〔实验动物生产许可证:SCXK(新)2003-0001〕。
1.3方法
1.3.1细胞培养 解冻人结肠癌HT29 细胞株,用生理盐水洗涤两次,接种于含10%新生牛血清(56℃灭活30 min)的RPMI 1640培养液中,在37℃,5%CO2培养箱中培养,接种于培养瓶中培养,待细胞铺满培养瓶底80%以上时,酶消化备用。
1.3.2结肠癌高转移细胞株的筛选 结肠癌HT29细胞悬液,用生理盐水洗涤两次,选用6~8周龄BALB/c小鼠,在腋侧皮下接种前述细胞,待皮下瘤生长到约1.5 cm3处死小鼠,完整剥离皮下转移瘤组织作为移植源材,重复3次,最后得到的皮下移植瘤细胞即为高转移、高侵袭性结肠癌细胞。
1.3.3建立高转移、高侵袭性结肠癌肝转移的动物模型 6~8周龄的BALB/c小鼠,取腹部正中切口,长约10~15 mm,充分暴露盲肠后,用无齿镊将损伤肠管向内推压,使局部肠壁形成凹陷,取上述皮下移植所得肿瘤组织块置于浆膜与浆膜下层,使用医用胶固定于肠壁,关闭腹腔。术后继续饲养于SPF 环境下建立高侵袭性结肠癌肝转移的模型。
1.3.4提取RNA及扩增 用冰冷PBS液洗涤细胞两次,Trizol一步法提取总RNA,加入Takara公司Trizol 试剂1 ml,静置15 min,小滴管吹打使细胞完全裂解,移入1.5 ml EP管内,再入200 μl氯仿,剧烈震荡混匀30 s,静置10 min,分层,上层水相,下层酚相。而后4℃15 000 r/min离心15 min后,上层为水相。将上层液体移入另一新EP管内,约400~500 μl,新EP管内加入等量异丙醇溶液,充分混匀,静置10 min后4℃ 15 000 r/min离心10 min,管底可见RNA沉淀。弃上清,留RNA沉淀,加入4℃ 75%乙醇漂洗两次,吸干液体后干燥约20 min,待沉淀为半透明状时,用20 μl DEPC水溶解RNA沉淀。紫外分光光度计检测RNA产物浓度和纯度。非变性电泳A260/A280判断RNA的纯度和完整性以满足后续实验要求。而后用TaKaRa RNA PCR Kit (AMV) 试剂盒合成cDNA。
1.3.5cDNA芯片 采用RNA Fluorescence Labeling Core Kit(M-MLV Version,Takara) 芯片技术〔2〕。10 μl逆转录体系中加入4 μg细胞总RNA,Cy3/Cy5-dUTP法分别标记亲代细胞和高转移细胞的RNA,纯化后乙醇沉淀,将标记探针混合溶解到10 μl杂交液中(含有50%甲酰胺,50 mmol/L DTT,5×Denhardt液,5%硫酸葡聚糖,4×SSC,0.2%SDS)。用人癌基因芯片〔Human Cancer Chipversion 4.0 (Takara,Japan)〕做cDNA杂交。95℃2 min将探针变性,后放冰上,完全冷却后15 000 r/min离心10 min取上清液置芯片上,覆盖玻片后置于杂交舱65℃ 16 h。洗涤依次为:4×SSC/0.2%SDS溶液55℃30 min×2次;2×SSC/0.2%SDS溶液65℃5 min×1次;0.05×SSC室温5 min×1次。基因芯片放入50 ml离心管3 000 r/min离心2 min,将其表面水分甩干。用Agilent扫描仪扫描,用Imagene3.0软件(Biodiscovery,Inc.)图像分析。计算2种荧光Cy3/Cy5信号强度的比值。定义高转移性相关基因标准:①上调基因:高转移性组Cy3/ Cy5>2.0,Cy5>500,且与亲代组细胞差异有统计学意义(P<0.05);②下调基因:高转移性组Cy3/Cy5 <0.5,Cy3>500,且与亲代组差异有统计学意义(P<0.05)。
1.3.6实时荧光定量PCR鉴定 基因引物序列见表1。采用StepOne PCR仪和TaqMan SYBR Green I(Takara)进行荧光定量检测。在差异表达基因中选择6个基因进行定量验证,3个上调基因,3个下调基因, GAPDH设为内参。20 μl qPCR反应体系(TaqMan SYBR Green I,Takara公司试剂)。每样品设三副孔,每次实验均设空白孔和阴性对照孔。

表1 7个基因的引物序列
1.4统计学分析 采用SPSS13.0统计软件行t检验。
2 结 果
2.1差异表达基因结果 高转移性组与亲代组相比共36个基因差异表达,差异有统计学意义(P<0.05) ,其中表达上调基因有20个,表达下调的基因有16个。两组间表达差异有统计学意义的基因的Cy3/Cy5比值波动于0.25~3.16。跟据差异表达基因的生物学功能进行分类,见表2。
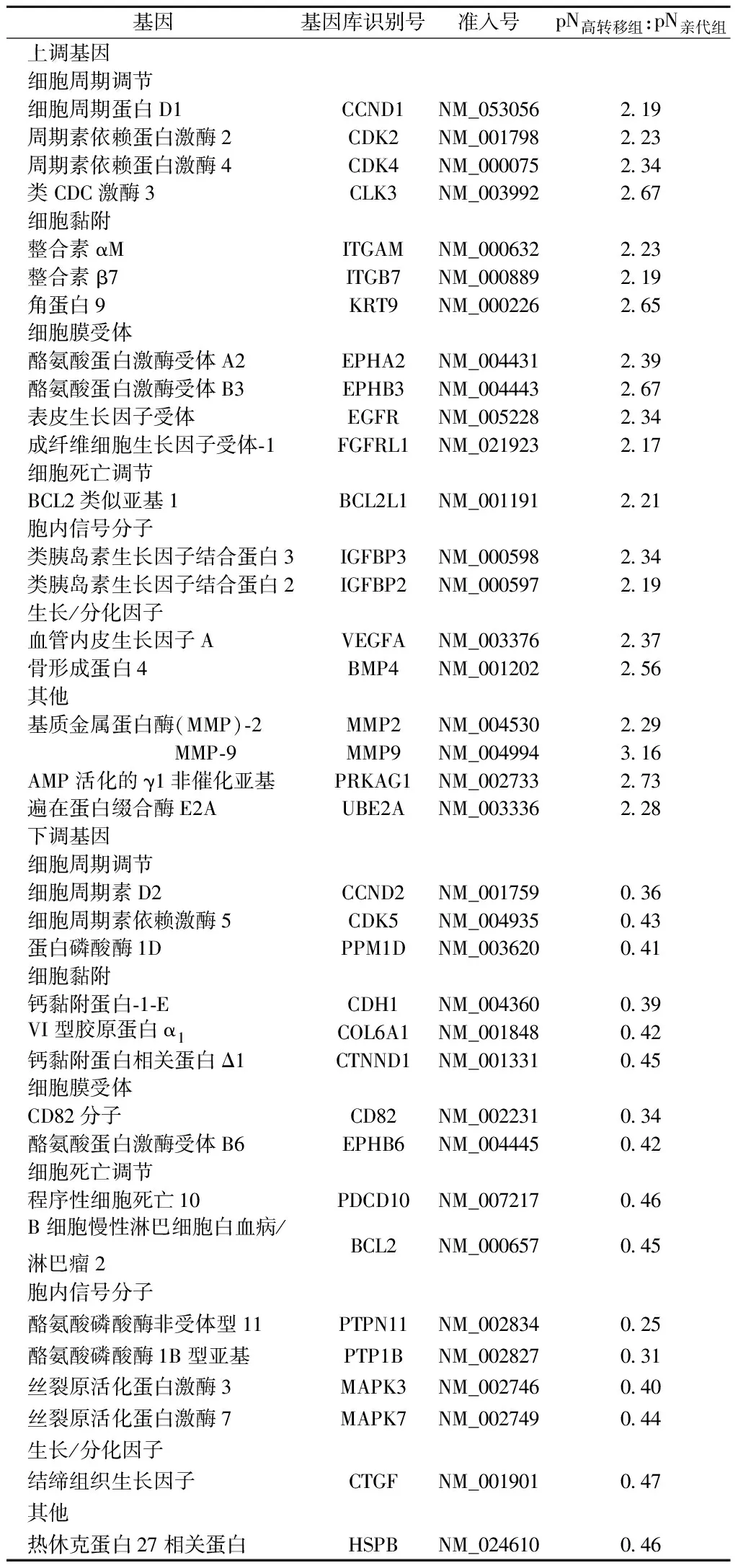
表2 差异表达基因
2.2实时荧光定量PCR结果 利用实时荧光定量PCR技术验证了3个上调和3个下调表达基因,显示基因芯片和实时荧光定量PCR两种检测技术对于检测mRNA表达可信度均较好,变化方向一致。见图1。

图1 qPCR验证6个差异基因的表达
3 讨 论
恶性肿瘤细胞具有迁移、侵袭和血管生成的生物学特性,这些生物学特性是肿瘤基因改变和环境异常共同作用的结果。本研究将结肠癌HT29 细胞株进行体内连续传代,获得高转移结肠癌细胞株,并建立了高侵袭性结肠癌肝转移的动物模型;同时利用cDNA-microarray技术筛选出结肠癌高转移性相关基因,结果显示,亲代组与高转移组之间有36个基因表达差异。
恶性肿瘤细胞高转移生物学特性机制涉及肿瘤细胞由原发病灶脱落、转移迁移、基底膜破坏、浸润、侵犯血管等过程〔3〕。本文结果显示上调表达的基因中牵涉到粘连相关蛋白基因。MMP2和MMP9为MMPs(基质金属蛋白酶)家族成员,能够降解细胞外基质(ECM)中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭生物学行为中发挥关键的作用〔4〕。我们筛选出的差异基因显示高转移性结肠癌可能存在生长因子信号通路异常高表达。以往研究表明酪氨酸激酶受体过度激活与肿瘤有良好的相关性。EPHB3是酪氨酸激酶受体Eph家族成员,可与ephrins结合相互作用参与肿瘤细胞迁移〔5〕。研究表明在非小细胞肺癌细胞系中高表达EPHB3能够促进细胞的生长和迁移,而干扰EPHB3表达可显著抑制肿瘤细胞生长、迁移以及在体内的成瘤和转移能力〔5〕。本文结果显示EPHB3高表达与结肠癌的高转移性有关。高转移性结肠癌组中PTPN11和PTP1B基因较低表达也从另一方面说明了酪氨酸磷酸酶与肿瘤细胞高转移生物特性相关〔6〕。PTPN11和PTP1B均为蛋白酪氨酸磷酸酶家族成员,能够通过调节细胞酪氨酸激酶磷酸化水平从而调节细胞生长、分化、迁移、转录和凋亡等;并且还与细胞免疫调节相关,该类酶活性的降低会导致细胞表面抗原低表达,从而使肿瘤细胞发生免疫逃脱。
细胞周期调控在高转移性结肠癌发生中可能发挥重要作用,而细胞周期的关键是G1期的启动。Cyclin D1(CCND1)是调控细胞周期的基因,在G1期合成,并与CDKs蛋白家族成员形成复合物从而参与细胞周期控制。近来也发现Cyclin D1蛋白在结肠癌中过度表达可能是该肿瘤进展中的重要事件,还可能是独立的预后因素〔7〕。细胞凋亡和细胞周期调控失衡共同作用可能是肿瘤细胞高转移性的重要机制,但是其中确切的机制需要深入研究。
本文结果也表明细胞黏附分子异常表达可能参与高转移性结肠癌发展,其中E-cadherin在高转移性组中低表达。E-cadherin是细胞膜表面分子,介导上皮细胞-细胞间的黏附,这个结果似乎与之前其他的黏附分子表达不相一致,考虑到肿瘤细胞从原病灶脱落迁移至转移部位再生长后重新表达黏附分子,可能发挥了在原发病灶中不同生物学作用〔8〕。新近也发现CD82基因是肿瘤转移抑制基因,它的正常表达能够抑制肿瘤的转移能力〔9〕。在结肠癌高转移组中CD82基因表达水平较亲代组低,这样可能更有利于结肠癌细胞高转移生物学行为,其中机制需深入探讨。
4 参考文献
1李俊材.结肠癌肝转移相关蛋白的比较蛋白质组学研究〔D〕.重庆:重庆医科大学硕士学院论文,2008.
2Mori M,Mimori K,Yoshikawa Y,etal. Analysis of the gene-expression profile regarding the progression of human gastric carcinoma〔J〕. Surgery,2002;131(1): 39-47.
3王 羊,黎成金,王 烈.结肠癌肝转移基因治疗研究进展〔J〕. 医学综述,2007;(19):132-5.
4Qin L,Liao L,Redmond A,etal.The AIB1 oncogene promotes breast cancer metastasis by activation of PEA3-mediated matrix metalloproteinase 2 (MMP2) and MMP9 expression〔J〕.Mol Cell Biol,2008;97(5): 1036-51.
5Cortina C,Palomo-Ponce S,Iglesias M,etal.EphB-ephrin-B interactions suppress colorectal cancer progression by compartmentalizing tumor cells〔J〕.Nature Genetics,2007;25(4): 2943-50.
6Bae HJ,Song JH,Noh JH,etal.Low frequency mutation of the Ephrin receptor A3gene in hepatocellular carcinoma〔J〕.Neoplasma,2009;25(21): 2987-98.
7Bochot A,Couvreur P,Fattal E.Intravitreal administration ofantisenseoligonucleotides:potential of liposomal delivery〔J〕.Prog Retinal Eye Res,2000;579(19): 4069-75.
8Saito T,Masuda N,Miyazaki T,etal.Expression of EphA2 and E-cadherin in colorectal cancer: correlation with cancer metastasis. Oncology Reports.2004.p38MAPkinase-mediated matrix metalloproteinase type 2 activation and cell invasion in human prostate cancer〔J〕. Oncogene,2006;23(4):324-8.
9Wan TY. Gene expression-driven diagnostics and pharmacogenomics in cancer〔J〕.Curr Opin Mol Ther,2005;7(3): 246-50.
