青海地区老年藏族300例非酒精性脂肪肝患者的临床特点和相关因素
2014-09-12杨青岩
杨青岩
(青海大学附属医院老年二科 ,青海 西宁 810001)
脂肪性肝病包括非酒精性脂肪性(NAFLD)和酒精性(ALD)肝病,与病毒性肝炎可合并存在,NAFLD不但导致肝硬化、肝衰竭,还与2型糖尿病(T2DM)和心脑血管疾病、代谢综合征密切相关。国内目前尚未见有关青海藏族NAFLD大规模的临床研究。旨在探讨青海地区藏族人群NAFLD的相关危险因素及临床特征,为NAFLD的早期诊断和预防提供依据。
1 对象与方法
1.1研究对象 选取2009年1月至2013年9月青海青大附院老干部保健科体检青海地区藏族人群600例,其中NAFLD组300例,男272例,女28例,年龄28~70(平均40.81±12.54)岁;对照组300例,男140例,女160例,年龄24~75〔平均(43.25±8.9)〕岁,为同期在青大附院体检中心的健康人。两组研究对象年龄,性别分布无显著差异(P>0.05)。NAFLD参照中华医学会肝脏病学分会脂肪肝和酒精性肝病学组的诊断标准〔1〕。体重指数(BMI)≥25 kg/m2为肥胖〔2〕。
1.2研究方法
1.2.1调查问卷 根据参考文献及诊断标准设计问卷,收集临床资料,制定表格,准确详细记录所有受检者的年龄、性别、体重、身高、血压及脂肪肝家族病史、既往病史、药物史、饮酒史。入选对象均排除肝豆状核变性、病毒性肝炎、全胃肠外营养、药物性肝病等可导致脂肪肝的特定疾病。
1.2.2生化指标测定 清晨抽取空腹静脉血5 ml,即时分离血清,采用奥林巴斯全自动生化仪测定空腹血糖(FPG)、血脂五项、同型半胱氨酸(Hcy)、血尿酸(UA)、肝功酶14项等指标,所有生化检查质量控制完备,能够保证检查结果的准确性。
1.2.3B超检查 受检者清晨空腹,取平卧或左侧卧位进行B超肝脏检查,采用美国通用公司彩色超声诊断仪,由专业B超技术人员操作,B超诊断脂肪肝〔3〕。
1.3统计学方法 采用SPSS13.0软件进行Logistic回归分析、方差分析及t检验。
2 结 果
2.1两组肝酶异常率的比较 与对照组相比,NAFLD组谷丙转氨酶(ALT)与谷草转氨酶(AST)值均明显增高,尤以ALT增高为著。见表1。
2.2两组生化指标比较 NAFLD组与对照组的患者血压、血糖、血甘油三酯(TG)、总胆固醇(TCH)及血尿酸(UA)均高于健康对照组(P<0.01),而年龄、低低密度脂蛋白(LDL)两组间无统计学意义(P>0.05)。见表2。
2.3NAFLD独立危险因素的多元Logistic回归分析 BMI、收缩压、高脂血症、高UA血症、血糖、载脂蛋白(APO)B及高脂饮食等7个因素与其独立相关,其中高密度脂蛋白(HDL)为NAFLD保护因素。见表3。

表1 NAFLD组与对照组AST/ALT异常率比较〔n(%),n=300〕
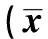
表2 两组年龄、血压、血糖、血脂、UA比较±s,n=300)

表3 NAFLD多因素Logistic回归分析
3 讨 论
NAFLD时,肝脏中的脂肪酸及其肝内代谢产物水平会升高,可造成肝脏实质细胞发生脂肪变性、坏死、炎症细胞浸润及纤维化改变〔4〕,通过肝功能检查可见ALT和AST升高。同时,肝脏炎性病变越重,纤维化程度越高,其NAFLD的预后越差〔5〕。因此ALT和AST可作为NAFLD进展和预后判断的一项重要指标。
NAFLD的发病机制主要学说为“二次打击学说”〔6〕,认为一种或多种受体后途径在胰岛素抵抗的发生中起主要作用,伴随其产生的结果是高胰岛素血症和多元代谢紊乱。发生胰岛素抵抗时,胰岛素抑制脂肪分解的作用减低,使脂肪组织分解大于合成,储脂能力降低,可造成脂肪在肝脏、肌肉及胰岛等部位的异位沉积。由于脂肪的沉积,可增加肝细胞受损的易感性,此外,随着脂肪分解的活跃度增加,可导致血浆游离脂肪酸(FFA)大量产生并进入血液,从而出现高FFA血症。血FFA的增高可通过抑制葡萄糖进入细胞内、抑制葡萄糖氧化及抑制肌糖原合成,促进糖异生,加重糖代谢紊乱,并进一步加重胰岛素抵抗。而且,FFA也可造成高胰岛素血症。肝内过多的FFA也可诱导细胞色素酶P450 2E1(CYP2E1)表达增多,导致脂质过氧化反应,形成氧应激,损伤肝细胞。调节脂肪生成的转录因子-甾体调节元结合蛋白-1(SREBP-1)对于胰岛素在NAFLD发生中起一定作用。有研究表明,胰岛素可诱导SREBP-1c基因转录,其过度表达可使乙酰辅酶A羧化酶(ACC)、脂肪合成酶(FAS)的mRNA水平升高,从而使TG合成增加,促进脂肪变性发生,最近研究发现,胰岛素也可刺激肝形状细胞,使结缔组织生长因子的合成和分泌增加,促进肝纤维化的发生率〔7,8〕。 青海地处高原,海拔高,气候严寒,当地藏族饮食习惯和生活方式较特殊,如羊肉、高脂、高蛋白类饮食:奶茶、酸奶、酥油,青稞糌粑等主食,同时少食鱼类、蔬菜水果等,而高脂、高盐、高蛋白饮食对NAFLD的形成有重要影响。这也是青海藏族居民NAFLD的主要影响因素。
肥胖是NAFLD常见危险因素,本研究显示:在藏族NAFLD患者中,女性肥胖患者较男性多,且随年龄增加而增加,肥胖患者NAFLD的ALT明显增高,且多在正常上限的2~3倍,研究中还发现若AST/ALT大于1.5倍,应详细询问病史,大多数患者有饮酒史,要考虑ALD。肥胖患者的NAFLD存在共同的发病机制,即胰岛素抵抗引起脂质代谢异常,肥胖患者体内存在胰岛素抵抗现象是由于脂肪细胞对胰岛素敏感性下降或外周脂肪数量增加,使机体代偿性出现高胰岛素血症。
本研究发现高UA血症与NAFLD密切相关,且血UA水平越高,发生NAFLD概率越大。这在以往的文献中报道较少。UA是人体内一种主要的抗氧化剂,是嘌呤代谢的最终产物,UA的升高与肥胖、糖尿病和代谢综合征的流行和发病密切相关〔9〕,但NAFLD与血UA的关系目前仍有争议,PeFronzo等〔10〕研究发现,注入血UA的Ob/ob大鼠,其脂肪肝几乎完全治愈,因此曾认为UA的升高可使脂肪肝患者对抗氧化应激的生理代偿机制增强,并可清除身体内的自由基。而Mendler等〔11〕近来研究发现,代谢综合征患者体内的UA具有强氧化剂作用,并与NAFLD的发生密切相关。
对同时伴有胰岛素抵抗和高水平瘦素的NAFLD患者,其胰岛素对抗不仅可以促进UA的合成,还可以抑制UA的排泄〔12〕,而高瘦素血症可通过促进血管内皮的氧化应激和影响肾小管的重吸收功能,使血UA的合成增加,排泄减少,最终导致血UA水平升高〔13〕。本研究结果也与上述文献一致。此外,高UA血症在青海NAFLD患者明显增多,也与当地生活习惯喜食牛羊肉,酥油等高嘌呤饮食有关。
综上,青海藏族NAFLD患病率不断增高,现已成为常见病,且与肥胖、高脂血症、糖尿病、高血压等疾病高发密切相关,本研究不足之处:缺乏临床病理研究资料,缺乏社区干预实验结果,在预防NAFLD方面应做到早期体检,控制体重,加强运动,控制血糖、血压、降低血UA,并通过改变生活方式等措施降低NAFLD发生。
4 参考文献
1中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊断标准〔J〕.中华肝脏病杂志,2006;11(5):71.
2Farrell CC,George J,Pauline de la M,etal.Fatty liver diseases: NASH and related disorders〔M〕.Oxford:Blackwell Publishing, 2005:1-22.
3Graif M,Yanuka M, Baraz M,etal.Quantitative estimation of attenuation in ultrasound video images: correlation with histology in diffuse liver disease〔J〕. Invest Radiol,2000;35(5):319-24.
4彭 飞,王宇明.非醇性脂肪性肝炎〔J〕.中国实用内科杂志,2000;20(2):115-6.
5Caldwell SH,Hespenheide EE.Subacute liver failure in obese women〔J〕. Am J Gastroenterol,2002;97(8):2058-62.
6Namikawa C,Shu-ping Z,Rayor-Vyselear J.Polymorphisms of microtonal triglyceride transfer protein gene and manganese superoxide dismutase gene in non-alcoholic steatohepatitis〔J〕. J Hepatol,2004;40(5):781-6.
7Xu H,Hirosumi J,Uysal KT,etal.Exclusive action of transmembrane TNF-α in adipose tissue leads to reduced adipose mass and local but not systemic insulin resistance〔J〕. Endocrinology,2002;143(4):1502-11.
8Bugianeri E,Manzini P,D'Antico S,etal.Relative contribution of iron burden,HFE mutations, and insulin resistance to fibrosis in nonalcoholic fatty liver〔J〕.Hepatology,2004;39(1):179-87.
9Choudhury J,Sanyal AJ.Insulin resistance and the pathogenesis of nonalcohdic fatty liver disease〔J〕.Clin Liver Pis,2004: 8(3):575-4.
10PeFronzo RA.Dysfunctional fat cells, liptoxicity and type 1 diabetes〔J〕.Int J Clin Pract Suppl, 2004;2(143):9-21.
11Mendler MH,Jurlin B, Moirand R,etal.Insulin resistance associated hepatic iron overload〔J〕.Gastroenterology,1999:117(5):1155-63.
12Cnop M,Landchild MJ, Vidal J,etal.The concurrent accumulation of inra-abdominal and subcutaneous fat explains the association between insulin resistance and plasma lepton concentrations: distinct metabolic effects of two fat compatments〔J〕.Diabetes,2002;51(4):1005-15.
13Ross R,Aru J,Freeman J,etal. Abdominal adiposity and insulin resistance in obese man〔J〕.Am J Physiology Endocrinol Metab,2002:282(3):E657-63.
