异体骨髓间充质干细胞联合自体PRP促进皮肤慢性溃疡创面愈合的实验研究
2014-09-11王和庚黎洪棉田举赵培冉梁双武
王和庚 黎洪棉 田举 赵培冉 梁双武
皮肤慢性溃疡在临床上极为常见。老年患者一般情况差,基础疾病多,细胞增殖和再生受限,创面修复和治疗较为棘手。组织工程化人工皮肤的构建和应用为临床大面积皮肤缺损的修复治疗提供了新的途径和方法。骨髓间充质干细胞(BMSC)是一种具有多项分化潜能的细胞,来源丰富,分离培养容易,已成为组织工程研究中常用的种子细胞[1-4]。近年的研究表明其对心、肺、皮肤、肌肉等组织创伤具有促进愈合和功能修复的作用[5-6]。富血小板血浆(PRP)是通过离心分离自体全血而得到的血小板浓缩物,经激活后能释放出大量高浓度的生长因子,刺激细胞增殖分化并促进软组织的修复[6]。本研究在前期对间充质干细胞体外分离培养与细胞标记等研究基础上,体外培养异体BMSC,并与自体PRP联合应用于皮肤慢性溃疡的治疗,以观察两者是否有协同作用[7]。
材料与方法
一、材料和试剂
1.实验动物
健康成年SD大鼠17只,6~8周龄,体质量约150 g,雌雄不限,由南方医科大学实验动物中心提供,实验过程中对动物的处置符合2006年科技部《关于善待实验动物的指导性意见》的规定。
2.主要试剂及仪器
包括DMEM、胎牛血清(美国Gibco),地塞米松、胰岛素、吲哚美辛、胰蛋白酶、茜素红、油红O、DiI、二甲亚砜、异丁基甲基黄嘌呤(IBMX)、转化生长因子(TGF)-β1、阿尔辛蓝、羊抗兔IgG-FITC、羊抗鼠IgG-cy3(美国Sigma),CO2恒温培养箱(德国HERABUS),兔抗鼠CD29、CD44抗体(武汉博士德),外科用冻干人纤维蛋白原及溶解液、外科用冻干人凝血酶(华兰生物)。
二、方 法
1.BMSC的分离、培养、传代与鉴定
取1只SD大鼠,行颈椎脱位法处死,于无菌条件下取出双侧股骨,去除股骨双侧干骺端,用DMEM高糖完全培养基冲洗骨髓腔,收集骨髓细胞,以Ficoll液低速离心5 min,收集并计数有核细胞,加入等量含体积分数为10%胎牛血清的DMEM,稀释后接种于75 ml培养瓶,置于5%CO2、饱和湿度、37℃恒温培养箱中进行细胞培养,5 d后半量换液,以后每3 d换液1次,待细胞长至80%融合后消化传代,以此获得大鼠BMSC,采用第3代细胞进行实验。BMSC生长至培养瓶底70%~80%面积时,改用向脂肪细胞分化的诱导培养基(含10%胎牛血清,1μmmol/L地塞米松,10μmol/L胰岛素,200μmol/L吲哚美辛,0.5 mmol/L IBMX)定向诱导,期间每2~3 d更换1次诱导培养基,诱导至第6 d后按半量换液,定向分化诱导2周后进行油红O染色定性观察体外诱导分化的结果。另取第3代BMSC接种培养,生长至瓶底70% ~80%面积时,改用向成骨细胞分化的诱导培养基(含10%胎牛血清、0.1μmmol/L地塞米松、50μmol/L抗坏血酸和10 mmol/L的β-磷酸甘油)定向诱导,3周后行茜素红染色定性观察诱导结果。另取第3代人BMSC培养生长至培养瓶底100%面积时改用向软骨细胞分化的诱导培养基(含10%胎牛血清、10μg/L TGF-β1、6.25 mg/L胰岛素、6.25 mg/L转铁蛋白、50μmol/L抗坏血酸-2-磷酸酯)定向诱导,每2 d更换1次诱导培养基,定向诱导14 d后行阿尔辛蓝染色,定性观察诱导分化结果。取第3代ADSC爬片行CD29、CD44的免疫细胞荧光染色,并计算CD分子表达呈阳性的细胞比例。
2.DiI标记BMSC
参照说明书的方法,将收集细胞用磷酸盐缓冲液(PBS)清洗、离心2次,加入无血清DMEM制成细胞悬液,以109/L密度加入5μl的DiI溶液,37℃下孵育25 min,1 200 r/min离心5 min,PBS清洗、离心2次,加入上述完全培养基中,荧光显微镜观察细胞显色情况,置于37℃、5%CO2培养箱培养48 h,所得BMSC用于移植。
3.PRP的分离、提取
抽取同一只SD大鼠的全血10 ml,枸橼酸二钠抗凝,采用改良的Appel法分离、提取PRP备用,同时进行全血及PRP血小板计数,以确保PRP中血小板的数量是全血的4倍以上[7]。
4.大鼠创伤模型制作及治疗干预
取16只SD大鼠,以30 mg/kg戊巴比妥麻醉,在其背部脊柱一侧旁距2 cm左上方处,利刀全层切除皮肤,形成一个直径2 cm、面积24 cm2的圆形全层皮肤切除创面(A组)。同法在左下方(B组)、右上方(C组)及右下方(D组)各对称部位皮肤作同样大小的创面。创面暴露2周后进行治疗,凡士林纱布覆盖创面。将标记好的5×106个BMSC制成细胞悬液,自体PRP制成凝胶状,各组治疗方案为:A组为局部注射异体BMSC悬液+PRP,B组为局部注射单纯异体BMSC悬液;C组为局部注射单纯PRP;D为局部注射等量生理盐水。7、14 d颈椎脱位法各处死8只小鼠,采集标本观察结果。采用大体观察、观察伤口的生长情况、伤口渗出量、损伤处的炎症反应;取得标本后,以10%甲醛固定,苏木素-伊红染色及免疫组织荧光染色观察创面愈合情况。
三、统计学处理
使用SPSS 13.0软件进行统计处理,所有数据至少进行3次独立实验。计量资料以s表示,采用t检验。以P<0.05为差异有统计学意义。
结 果
一、形态学及多向诱导分化
细胞约24~48 h贴壁,初为淋巴细胞样小圆细胞,24~48 h后贴壁细胞明显增多,并开始分裂增殖,圆形细胞变形伸出伪足,约7 d长满培养瓶底面积的70% ~80%,此时细胞逐渐融合成单层,细胞形态为梭形、多角形,呈集落状生长,并出现核分裂相。细胞围绕集落中央呈岛状分布,并分泌大量基质。传代后的细胞形态与原代相似,以梭形为主,但生长增殖较快。随着传代次数的增多,细胞变为形态均一、排列更有序的成纤维细胞样(图1A)。第3代细胞经成脂诱导14 d,可见细胞内有透亮的脂滴形成,油红O染色可见脂滴被染成鲜红色(图1B);成骨诱导3周,可见钙化结节样改变,茜素红染色结节呈红色(图1C);成软骨诱导2周后,可见高度聚集生长的细胞团,呈斑片状或结节状,周围细胞呈放射状,阿利辛蓝染色提示结节及周边聚集的细胞呈蓝色(图1D)。

图1 第3代大鼠BMSC形态学观察结果
二、Dil标记及免疫荧光染色
DiI标记后行台盼蓝染色,见BMSC活力好,仅偶见蓝染细胞,荧光显微镜下观察,见全部BMSC标记后胞浆及胞膜均显红色荧光(图2A)。所标记的BMSC呈梭形,胞浆丰富,保持了良好的正常形态,DiI标记阳性率为100%。DiI标记后早期细胞形态呈荧光环状,48 h后细胞中荧光颗粒增多,荧光增强,细胞标记后7 d内未见荧光明显减弱,但细胞核未染荧光。标记前、后的细胞形态无明显差别。第3代BMSC行免疫荧光染色结果表明,CD29和CD44免疫荧光染色呈阳性(图2B、C)。

图2 第3代大鼠BMSC DiI标记及CD29和CD44免疫荧光染色结果
三、大体观察
16只SD大鼠均单笼饲养,进食正常,全部存活。治疗7 d后,大鼠体质量(150±1)g,与术前体质量比较差异无统计学意义(P>0.05)。14 d时,小鼠体质量(159.05±1.89)g,比手术前有明显增长(t=12.728,P<0.001)。在治疗后7 d采集标本时,4组创面均已完全愈合,但愈合创面均低于周围正常皮肤,凹面程度不同,光滑不一。治疗14 d后,A组创面与周边组织连接程度较对照组紧密。B组和C组与周边组织有一定的连接,而D组尚有凹面。
四、组织学观察
治疗7 d后,可见淋巴细胞和中性粒细胞浸润,移植物与深筋膜贴近而存在。随植入治疗后时间的延长,在移植物与深筋膜之间,可见到由大量呈较大椭圆核、常染色质、着色淡、核仁清楚、Ⅰ型胶原阳性的、功能活跃的成纤维细胞,丰富的血管以及大量粗细不一的胶原纤维束等组成的新生真皮结缔组织。治疗14 d后真皮结缔组织更明显。A、B、C组不同时间点的新生真皮组织,均明显厚于D组,3组中功能旺盛的成纤维细胞,特别是I型胶原阳性的成纤维细胞、血管及胶原纤维均明显多于D组。在A、B、C 3组中则以A组新生真皮组织最厚,见图3。
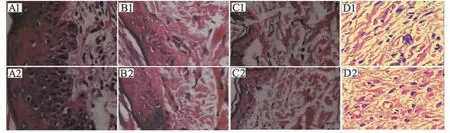
图3 治疗7、14 d后各组创面病理组织学切片(苏木素-伊红染色,×200)
五、免疫荧光染色
治疗后7、14 d组织切片A、B组免疫荧光染色均可见DiI染色阳性的细胞,胞膜呈红色荧光,标记的BMSC在创面边缘和创伤局部聚集,而C、D组未见有BMSC在创面边缘和创伤局部聚集,见图4。
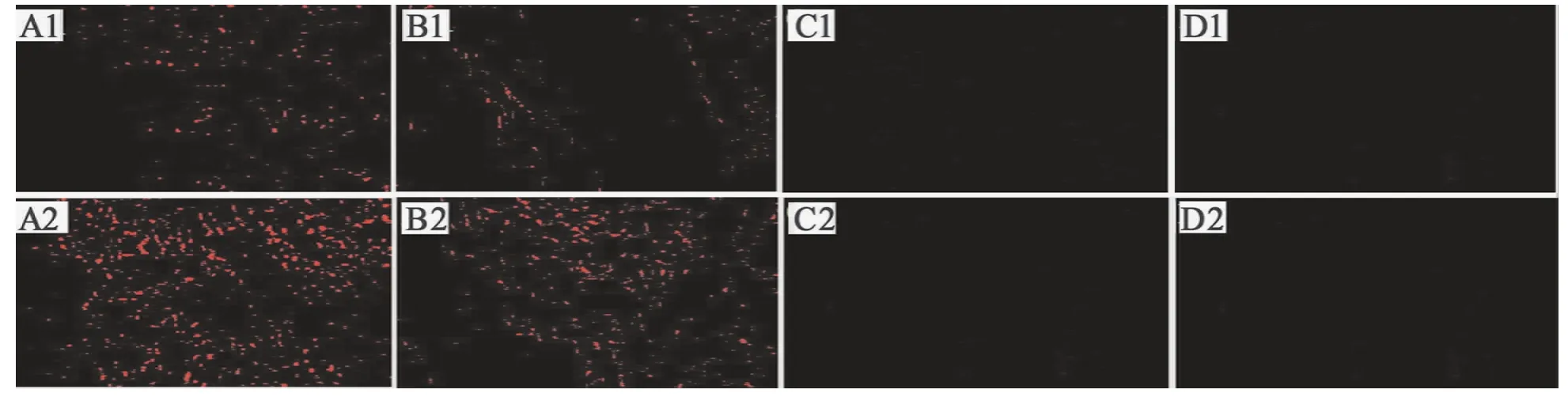
图4 治疗7、14 d后各组创面免疫荧光染色结果(DiI染色,×100)
讨 论
随着我国工业化的不断发展以及社会人口老龄化,各种原因造成的皮肤和软组织慢性溃疡等难愈性创面逐年增多。这类患者往往需要长期住院、换药,甚至经过多次手术却疗效欠佳,不仅消耗了大量医疗资源,而且容易引发医患纠纷,导致严重的社会问题。
创面愈合是一个复杂而有序的生物学过程,呈现高度的整体性和网络性。在机体的调控下,炎性细胞、修复细胞、细胞外基质及细胞因子等多因素相互协调,共同参与创面愈合。一般认为创面修复缓慢甚至修复停止的原因主要有以下4种:①伤口感染或坏死组织存在;②伤口血供微循环障碍;③局部生长因子数量减少,活性降低或多种生长因子网络调节失控;④修复细胞支架改变和过度凋亡,细胞膜上受体结构变化,导致生长因子与受体之间失偶联。移植补充新鲜的创面修复细胞和有活性的生长因子是目前慢性溃疡创面修复领域研究的重点和热点。BMSC是存在于骨髓组织中的一类成体干细胞,具有较低的免疫原性方便、易分离扩增、可塑性强、离成熟细胞近等特点,是再生医学中最有前途的种子细胞之一,特别是其跨胚层的分化潜能促使人们探讨能否将BMSC进行诱导分化以重建受创皮肤的解剖结构和生理功能。随着对BMSC研究的深入,现已证实BMSC在损伤等刺激下能参与多种组织的修复作用,但其机制尚未完全阐明[8-11]。本研究观察到,BMSC对创面愈合也有一定的促进作用。识别外源性的BMSC,是干细胞体内移植研究的重要环节。笔者通过多次实验,证明DiI标记的阳性率可达(98.5±2.2)%,可作为体外培养的间充质干细胞所特有的标记物以区分在体细胞。本研究在治疗后7、14 d时,新生肉芽组织中均可见有带DiI标记的细胞分布,表明BMSC在损伤的皮肤组织内能够存活并能向周围组织迁移。另外,本研究显示经BMSC治疗后创面愈合速度提高,愈合质量改善,创面肉芽组织中成纤维细胞多,功能旺盛,血管密度大,治疗组形成的新生表皮较厚,分层明显。因此笔者认为,局部创面应用BMSC可以促进皮肤损伤修复并提高愈合质量,与Satoh等[12-14]研究结果一致。
PRP是血小板浓缩物,经激活后能释放出大量高浓度的生长因子,可促进软组织的修复。由于PRP来源于自体,无免疫排斥,制作简单,不良反应少,近年来国外已有应用于牙周病、口腔种植、颅面及慢性溃疡创面的研究报道。本研究显示,单纯的BMSC或单纯的PRP对创面愈合也有一定的促进作用,但效果不如两者联合应用。其原因可能是,在创面愈合过程中,BMSC起到种子细胞的作用,在机体内环境的诱导作用下向组织细胞分化,而PRP则起到营养的作用。同时,PRP中各种高浓度有活性的生长因子可促进BMSC的增殖分化,增加修复细胞数量,这些修复细胞通过旁分泌和自分泌形式分泌生长因子又可以作用于周围细胞及细胞自身,构成了一个良性循环,两者联合起到协同修复的效果。然而,由于细胞存在于三维立体空间中,不同浓度的细胞,其细胞与细胞间的作用不同,对于BMSC参与组织修复可能是通过创伤的刺激以及局部创面的“壁龛”促进BMSC趋化并诱导BAMSC向所需要的组织或细胞分化,其具体分子机制仍有待进一步研究。
[1]Ziadloo A,Burks SR,Gold EM,et al.Enhanced homing permeability and retention of bone marrow stromal cells by noninvasive pulsed focused ultrasound.Stem Cells,2012,30:1216-1227.
[2]Kachgal S,Carrion B,Janson IA,et al.Bone marrow stromal cells stimulate an angiogenic program that requires endothelial MT1-MMP.J Cell Physiol,2012,227:3546-3555.
[3]Gehrke I,Gandhirajan RK,Poll-Wolbeck SJ,et al.Bone marrow stromal cell-derived vascular endothelial growth factor(VEGF)rather than chronic lymphocytic leukemia(CLL)cell-derived VEGF is essential for the apoptotic resistance of cultured CLL cells.Mol Med,2011,17:619-627.
[4]Hayashi M,Zhao C,An KN,et al.The effects of growth and differentiation factor 5 on bone marrow stromal cell transplants in an in vitro tendon healing model.J Hand SurgEurVol,2011,36:271-279.
[5]Yamada Y,Yokoyama S,Wang XD,et al.Cardiac stem cells inbrown adipose tissue express CD133 and induce bone marrownonhematopoietic cells to differentiate into cardiomyocytes.Stem Cells,2007,25:1326-1333.
[6]Sun W,Lin H,Xie H,et a.lCollagenmembranes loaded with collagen-bindinghuman PDGF-BB accelerate wound heal-ing in a rabbitdermal ischemic ulcermod-el.Growth Factors,2007,25:309-318.
[7]黎洪棉,余元龙,柳大烈,等.荧光活性染料DiI标记的大鼠骨髓基质干细胞生长增殖及其成骨分化.中国组织工程研究与临床康复,2009,13:7854-7858.
[8]黎洪棉,柳大烈,余元龙,等.自体PRP促进人脂肪来源干细胞成骨分化的体外实验研究.中国修复重建外科,2009,23:732-736.
[9]黎洪棉,高建华,吴涛,等.脂肪干细胞与外源性血管内皮生长因子及纤维蛋白胶复合物体内构建血管化组织工程脂肪.中国组织工程研究与临床康复,2009,15:7480-7484.
[10]Liu N,Patzak A,Zhang J.CXCR4-overexpressing bone marrow-derived mesenchymal stem cells improve repair of acute kidney injury.Am J Physiol Renal Physiol,2013,305:1064-1073.
[11]Peng LH,Mao ZY,Qi XT,et al.Transplantation of bone-marrow-derived mesenchymal and epidermal stem cells contribute to wound healing with different regenerative features.Cell Tissue Res,2013,352:573-583.
[12]Lim CT,Ren X,Afizah MH,et al.Repair of osteochondral defects with rehydrated freeze-dried oligo[poly(ethylene glycol)fumarate]hydrogels seeded with bone marrow mesenchymal stem cells in a porcine model.Tissue Eng Part A,2013,19:1852-1861.
[13]Fu X,Li H.Mesenchymal stem cells and skin wound repair and regeneration:possibilities and questions.Cell Tissue Res,2009,335:317-321.
[14]Kobayashi M,Spector M.In vitro response of the bone marrow-derived mesenchymal stem cells seeded in a type-I collagen-glycosaminoglycan scaffold for skin wound repair under the mechanical loading condition.Mol Cell Biomech,2009,6:217-227.
